温度对现场荧光法测定水体中叶绿素a的影响
2015-04-26吕鹏翼崔建升
吕鹏翼,崔建升
河北科技大学环境科学与工程学院河北省污染防治生物技术实验室,河北 石家庄 050018
水体中叶绿素a含量是表征浮游植物生物量的一个重要指标[1],当前以荧光原理为基础,浮游植物中叶绿素a含量在线快速检测装置的研发已成为环境监测领域的研究热点之一[2-4]。理论上关于温度对离体叶绿素a测定结果的影响研究已相对成熟,已知高温条件下叶绿素a不稳定、易降解[5-7];许金钩等[8]在所著的《荧光分析法》中指出温度对荧光物质的荧光强度有显著的影响,一般荧光物质的荧光量子产率和荧光强度会随着温度的降低而升高。在现场测定环境中荧光仪测定对象主要为活体藻中的叶绿素a,一般不同季节、一天中不同时间段水体的温度会有所差异,故温度会对活体藻中叶绿素a的测定产生一定影响。有研究[9-10]报道,天然海水中活体藻在12~30℃范围内,温度每升高1℃,荧光降低1.4%。厦门市环境监测中心站[11]采用YSI叶绿素传感器探头对厦门西港叶绿素含量进行监测,在肯定叶绿素水质自动监测仪轻便、操作简单、维护量小、可进行实时监测等优点的同时也指出叶绿素传感器易受温度的影响。Catherine等[12]使用德国bbe叶绿素在线分析仪对法国境内的大量湖泊、水库进行了大规模的测量,结果表明通过对水体中叶绿素 a的测定分析能够很好地估算浮游植物的生物量,但同时指出温度等环境因素会对叶绿素荧光产生怎样的影响仍需要进行深入研究。以往研究多侧重温度升高对荧光法测定叶绿素a的直观影响且实验对象多为叶绿素a萃取液[5],关于温度对荧光法测定活体藻中叶绿素a的影响的研究少见报道。对此,分别以纯叶绿素a和活体藻为实验对象研究了温度对荧光法测定叶绿素a的影响,首次提出了不同状态下叶绿素a(离体叶绿素a和活体藻中的叶绿素a)的温度系数,并测试了温度对自主研发的水体叶绿素现场检测仪的影响,对水体叶绿素在线监测系统的完善具有一定的理论意义。
1 实验部分
1.1 仪器与试剂
RF5301荧光分光光度计(日本),水体叶绿素现场检测仪,HH-6数显恒温水浴锅。
叶绿素 a标准品(10 mg,日本),铜绿微囊藻(Microcystis aeruginosa)、斜生栅藻(Scenedesmus obliquus)、蛋白核小球藻(Chlorella pyrenoidosa,BG-11培养基),90%乙醇。
1.2 实验方法
1.2.1 RF5301荧光分光光度计
1)取叶绿素a标准品用90%乙醇配制浓度为1.0 μg/mL的叶绿素 a样品置于恒温水浴锅中在60℃条件下恒温20 min后立即将样品取出,用荧光分光光度计在“Time Course”模式下连续测定10 min,采样间隔和采样点自动设定。
2)取叶绿素a标准品用90%乙醇配制浓度为0.50 μg/mL的叶绿素 a样品,测定不同温度水平(20、30、40、50、60、70 ℃)下样品的荧光强度值并求其降解率。
3)取叶绿素a标准品以90%乙醇为溶剂,分别 配 制 一 定 浓 度 梯 度 (0.2、0.4、0.6、0.8、1.0 μg/mL)的纯品叶绿素a样品系列,设置样品测定温度范围为5~70℃,按照从低温到高温的顺序依次测定相同浓度的叶绿素a样品的荧光强度值。分析温度对不同浓度的叶绿素a的影响是否具有一致性,并计算出叶绿素a的温度系数。
4)一般不同水体所含浮游藻类的种类不同,为更好地表征温度对实际水体中活体藻的影响,选取水体中的铜绿微囊藻、斜生栅藻、蛋白核小球藻为实验藻种。分别取其配制不同浓度的活体藻样品,设置实验温度范围为10~70℃,温度间隔为5℃,每个样品恒温20 min后测定其荧光强度值,并求其温度系数。
RF5301荧光分光光度计测定叶绿素a的参数设置为激发波长 436.0nm,发射波长672.0 nm,激发和发射狭缝宽度为5.0 nm。
1.2.2 水体叶绿素现场检测仪
配制浓度为60 μg/L的叶绿素a样品,将水体叶绿素现场检测仪与待测样品同时置于恒温水浴锅,调节温度以使溶液温度与水体叶绿素现场检测仪温度相同,模拟自然测定环境。设置温度范围为15~40℃,温度间隔为1℃。研究温度对水体叶绿素现场检测仪测定结果的影响,确定检测仪最佳测定温度范围。
水体叶绿素现场检测仪测定条件为“连续测量”模式,测量间隔30 s,每个样品连续测量10 min,取其平均值。
在实验过程中样品均为现测现配,在测定过程中待测样品需避光放置,避免叶绿素a发生光解。
2 结果与讨论
2.1 温度对叶绿素a荧光强度的影响
图1为叶绿素a的荧光强度值随时间的变化趋势。
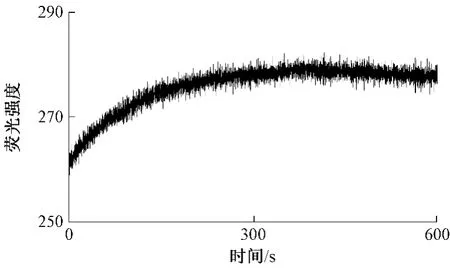
图1 叶绿素a的荧光强度值随时间的变化趋势
随着时间的延长,样品温度会逐渐降低至室温(约20℃),叶绿素a样品的荧光强度随着温度降低呈上升趋势,当样品温度达到室温后荧光强度值基本趋于平缓。
不同温度水平下叶绿素a样品的荧光强度值如表1所示。
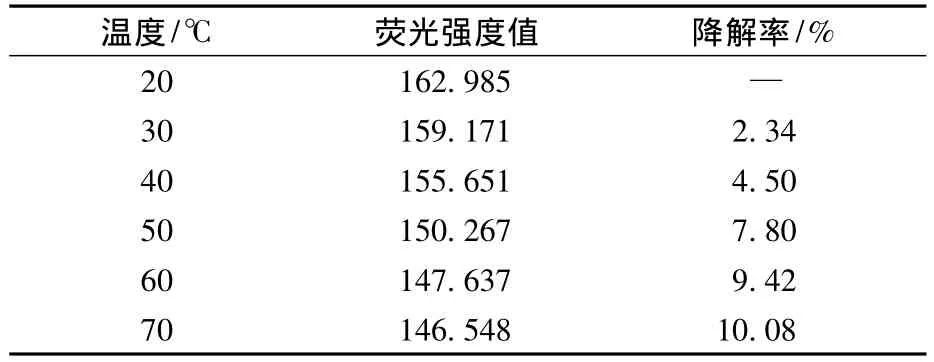
表1 不同温度水平下叶绿素a样品的荧光强度值及降解率
由表1可见,以20℃条件下测定的荧光强度值为对照组,随着温度的升高叶绿素a的降解程度加大。30℃时叶绿素a的降解率为2.34%;当温度为70℃时,叶绿素a的降解率达到10.08%左右,说明温度对叶绿素a降解程度有显著影响。
不同浓度叶绿素a样品的荧光强度随温度的变化情况如图2所示。
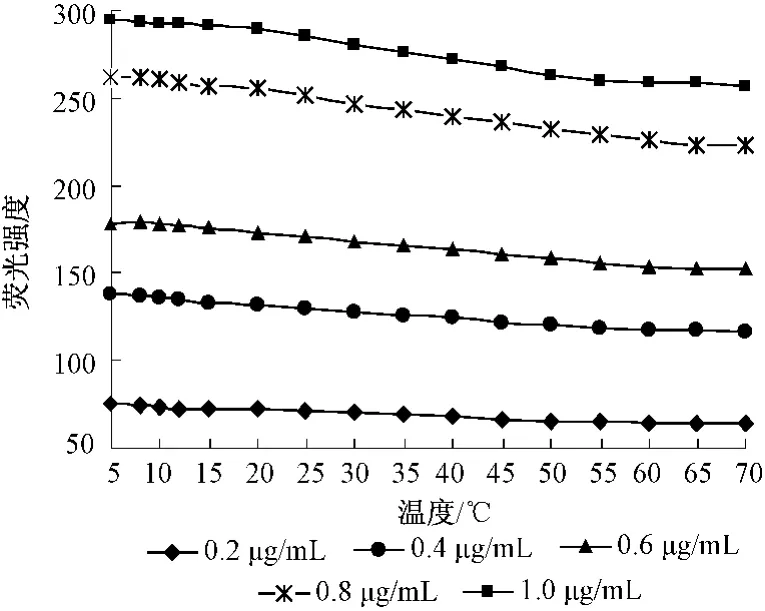
图2 不同浓度叶绿素a样品的荧光强度值随温度的变化情况
由图2可见,随着温度的升高叶绿素a样品的荧光强度值总体呈下降趋势,不同浓度的样品均符合此变化规律。分析原因主要有2方面:①温度的升高使部分叶绿素a降解生成了以脱镁叶绿素a为主的降解产物,两者荧光特性有所差异,从而降低了叶绿素a的荧光量子产率;②由于温度升高提高了分子动能,促进了分子间流动,使液体动力增加粘度减小,增大了荧光分子和溶剂分子的碰撞机会,荧光物质分子通过其他分子的碰撞造成内部能量的转移,从而导致温度淬灭,降低了荧光物质的荧光强度。
为更清楚直观地观察叶绿素a的荧光强度随温度的变化情况,取浓度为1.0 μg/mL样品系列进行具体分析。图3为5~70℃范围内叶绿素a样品荧光强度随温度的变化情况。

图3 5~70℃范围内1.0 μg/mL叶绿素a样品的荧光强度值随温度变化示意图
由图3可知,在5~20℃温度范围内荧光强度值随温度的升高下降幅度较小,即低温条件下叶绿素a降解率较低且低温状态下温度对叶绿素a分子能量转移影响较小,温度淬灭效应不显著。在20~50℃范围内荧光强度值与温度呈良好的负线性相关,回归方程为y=-0.893x+307.82,回归系数为0.999 5;在50℃左右时,1.0 μg/mL叶绿素a样品的荧光强度与温度的关系曲线出现了拐点,变化趋于平稳。
2.2 叶绿素a温度系数实验
一般而言,荧光物质的荧光强度随温度的降低而增强,温度的升高与荧光强度的减弱在一定范围内呈线性关系。温度每升高1℃,荧光减弱的百分数称为其温度系数,不同荧光物质的温度系数不同。计算叶绿素a的温度系数(TC),如式(1)所示。不同浓度叶绿素a样品的温度系数列于表2。由表2可以看出,叶绿素a温度系数在0.29% ~0.30%之间变动,取其平均值(0.295%)为叶绿素a的温度系数。该值反映的是叶绿素a的荧光强度随温度变化的特性。
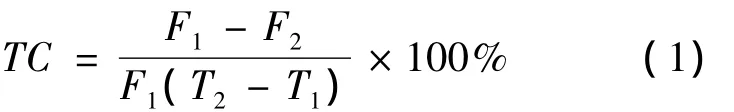
式中:TC为叶绿素a的温度系数;T1、T2为不同的测定温度;F1为叶绿素a在T1温度下的荧光值;F2为叶绿素a在T2温度下的荧光值。

表2 不同浓度叶绿素a样品的温度系数
2.3 温度对活体藻中叶绿素a荧光强度的影响
图4为不同藻类的叶绿素a荧光强度随温度的变化情况。
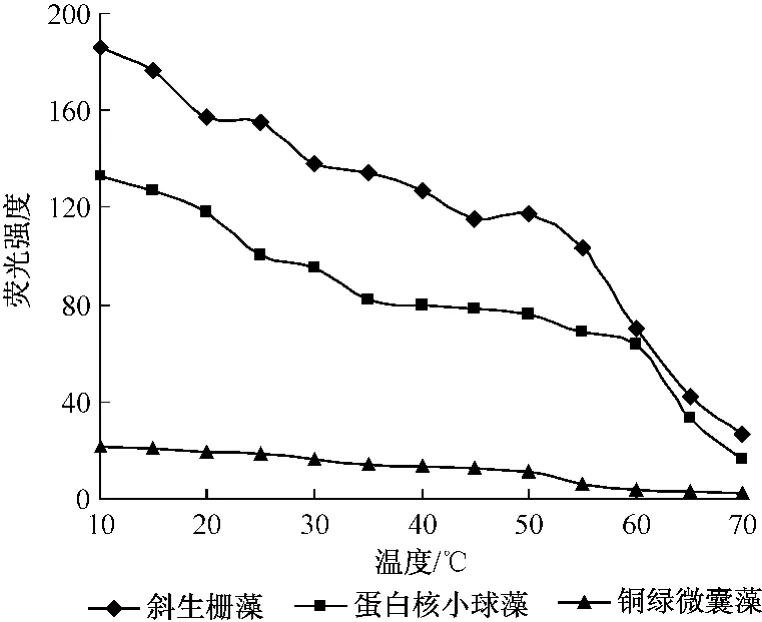
图4 不同藻类的荧光强度随温度的变化情况
由图4可知,活体藻的荧光强度值随着温度的升高同样呈下降趋势,与纯叶绿素a相比线性关系较差,分析原因可能是与纯叶绿素a相比活体藻结构更为复杂,逆境环境下温度胁迫使活体藻结构、光合速率或叶绿体的微环境发生了改变,从而影响了叶绿素a的荧光特性[13]。
图5为斜生栅藻、蛋白核小球藻及铜绿微囊藻在10~45℃范围内的原藻液荧光强度与温度的关系曲线。
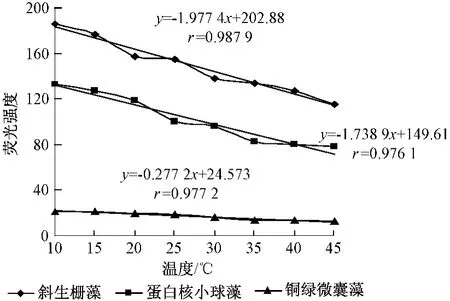
图5 10~45℃范围内不同藻类的荧光强度随温度的变化情况
分析图5可知,随温度的升高3种活体藻的荧光强度值均呈下降趋势且相关系数均在0.97以上,运用式(1)计算得斜生栅藻的温度系数约为1.09%,蛋白核小球藻的温度系数约为1.17%,铜绿微囊藻的温度系数约为1.14%。
2.4 温度对水体叶绿素现场检测仪测定结果的影响
温度过高或过低均会对叶绿素a的荧光强度值产生影响,在实际测量环境中,环境温度除对浮游植物的荧光特性产生影响从而降低测定结果的准确性外,温度对叶绿素荧光仪的光电倍增管的信号输出也会产生一定影响,对此采用荧光强度随温度变化的百分率作为补偿因子对水体叶绿素现场检测仪进行了温度补偿,以降低温度对检测仪的影响。
以浓度为60 μg/L的26个叶绿素 a样品为测定对象,用水体叶绿素现场检测仪在15~40℃温度范围内测定样品的浓度值,设置温度间隔为1℃。测定结果如表3所示。

表3 不同温度水平下水体叶绿素现场检测仪测定值及其相对误差
由表3可见,在15~40℃温度范围内测定值与真实值的相对误差为9.26% ~-15.45%,在15~35℃温度范围内测定值与真实值的相对误差为±10%。分析结果可知,温度越高检测仪测定值与真实值的相对误差越大,测定结果偏低主要是由叶绿素a高温降解所贡献;虽然对检测仪的输出信号进行了温度补偿,但在实际测定中温度对检测仪的影响是难以避免的。此外,随着温度的升高,检测仪测定结果整体呈下降趋势,该结果与温度对实验室荧光法测定叶绿素a的影响趋势一致。实验表明,在15~35℃温度范围内,水体叶绿素现场检测仪测定结果可取,满足一般水体测定环境的温度要求。
3 结论
分别以纯叶绿素a和铜绿微囊藻、斜生栅藻及蛋白核小球藻3种活体藻为实验对象研究了不
同温度水平下叶绿素a及活体藻的相对荧光强度的变化情况。结果显示,不同状态的叶绿素a的荧光强度值均会随温度的升高而降低,分析原因主要是由叶绿素a高温降解和溶液粘度减小导致的温度荧光淬灭所引起;不同状态的叶绿素a温度系数的导出对进一步研究叶绿素a的荧光特性随温度的变化规律意义重大,对水体叶绿素现场检测仪的温度校准和提高水体中叶绿素a现场检测装置的准确度具有一定参考价值。
[1]王俊,李洪志.渤海近岸叶绿素和初级生产力研究[J].海洋水产研究,2002,23(1):23-28.
[2]Gregor J, Marsalek B. Freshwater phytoplankton quantification by chlorophyll a:a comparative study of in vitro,in vivo and in situ methods[J].Water Research,2004,38(3):517-522.
[3]Izydorczyk K,Carpentier C,Mrowczynski J,et al.Establishment of an alert level framework for cyanobacteria in drinking water resources by using the algae online analyser for monitoring cyanobacterial chlorophyll a[J].Water Research,2009,43(4):989-996.
[4]Tammi L R,Evelyn L,James L P,et al.Spectral fluorometric characterization of phytoplankton community composition using the Algae Online Analyser[J].Water Research ,2010,44(8):2 461-2 472.
[5]张武昌,王荣.光和温度对叶绿素a和脱镁叶绿酸a降解的影响[J].海洋科学,2000,24(4):50-52.
[6]李翠华,张鲁勉,何小英.叶绿素a降解产物及其衍生物应用研究[J].汕头大学医学院学报,2002,15(2):121-122.
[7]阴金香,杨楷.天然绿色植物中去镁叶绿素的分离和鉴定[J].广西师范大学学报(自然科学版),2003,21(z1):286-287.
[8]许金钩,王尊本.荧光分析法[M].3版.北京:科学出版社,2006:49-63.
[9]Lorenzen C J. A method for the continuous measurement of in vivo chlorophyll concentration[J].Deep-Sea Res,1966,13(2):223-227.
[10]丁永耀,张欣梅,吕培顶,等.荧光法测定海中生物体内的叶绿素 a[J].海洋学报,1983,5(8):340-348.
[11]张江龙.叶绿素检测仪器在水质自动监测应用中的优劣浅析[J].现代科学仪器,2007(1):41-42.
[12]Catherine A,Escoffier N,Belhocine A,et al.On the use of the FluoroProbe,a phytoplankton quantification method based on fluorescence excitation spectra for large-scale surveys of lakes and reservoirs[J].Water Research,2012,46(6):1 771-1 784.
[13]王静.高温、高光强胁迫对植物离体叶绿体光合色素的降解及沙丘芦苇纯化内含铆对其减缓作用的研究[D].兰州:兰州大学,2008.
