常压室温等离子体结合紫外诱变筛选红霉素高产菌株
2015-04-26沈小静石彦鹏
沈小静,张 萍,石彦鹏
(宁夏泰瑞制药股份有限公司,银川750101)
常压室温等离子体结合紫外诱变筛选红霉素高产菌株
沈小静,张 萍,石彦鹏∗
(宁夏泰瑞制药股份有限公司,银川750101)
利用常压室温等离子体射流诱变(ARTP)和紫外照射对红霉素产生菌进行复合诱变,得到4株产量明显提高的突变菌株,4株菌的平均发酵效价较出发菌株提高25.2%;其中一株(12#菌株)经发酵摇瓶验证,红霉素发酵单位可达10029单位/mL,比出发菌株提高了28.6%,且遗传稳定性良好。实验证明ARTP-UV复合诱变是一种简单高效的筛选方法。
红霉素;常压室温等离子体;紫外;复合诱变;遗传稳定性
红霉素(erythromycin,Er)是由红色糖多孢菌(Saccharopolyspora erythraea,也称糖多孢红霉菌)合成的次生代谢产物,为一类大环内酯类抗生素。目前我国已成为世界大环内酯类抗生素原料药第一生产大国,但与发达国家相比仍有很大差距,大多数产品只是因为低人力成本而成为欧美和东南亚红霉素类原料药的主要供应国。因此,提高发酵单位和改善组分成为国内外红霉素发酵过程面临的主要问题。常压室温等离子体诱变(Atmospheric and Room Temperature Plasma,ARTP)是近几年发展起来的一种等离子体源,能够在大气压下产生温度在25~40℃之间的具有高活性粒子(包括处于激发态的氦原子、氧原子、氮原子、OH自由基等)浓度的等离子体射流。其作用于生物大分子和细胞的效果明显、微生物基因组突变速度快、多样性大,而且ARTP操作方便、安全性高,已成功实现了30种以上微生物的突变,成为高效的微生物基因组突变新方法[1]。整合多种诱变方法进行的复合诱变,因其突变率高成为研究热点,常使用的诱变方法有亚硝基胍化学诱变、紫外线照射诱变和等离子诱变[2]。对于化学诱变,若操作不慎会对实验人员和环境造成很大的危害。与常规的菌株改造手段相比,ARTP对遗传物质的损伤机制多样,因而获得突变型多样性的可能性增大,具有对环境无污染、保证操作者的人身安全等很多独特的优点。本文采用紫外线、等离子复合诱变方法,对红色糖多孢菌进行诱变筛选,获得了理想的高产红霉素菌株。
1 材料与方法
1.1 材料
1.1.1 供试菌株 红色糖多孢菌(Saccharopolyspora erythraea),CGMCC,经宁夏泰瑞制药股份有限公司分离纯化得到生产能力稳定的菌株:EM13-165,用沙土管保藏。
1.1.2 主要设备 旋转摇瓶机,XDW25/96型,四川长征制药机械厂;紫外可见分光光度计,UV-1800,日本岛津;恒温、净化工作系统;ARTP常压室温等离子体生物育种机,ARTP-Ⅱ型,北京思清源生物科技有限公司。
1.1.3 试剂及原料 黄豆饼粉、淀粉、棉籽饼粉、CaCO3均购自本地;玉米浆购自华北制药康欣股份有限公司;NH4SO4、MgSO4·7H2O、KH2PO4、糊精、蛋白胨、葡萄糖,均为天津市凯通化学试剂有限公司产品;红霉素对照品(中国兽医药品监察所,批号:130307,含量:883 U/mg)。
1.2 方法
1.2.1 培养基及培养条件 参考文献[3],种子培养基:含淀粉,糊精,蛋白胨,葡萄糖,黄豆饼粉,NaCl,NH4SO4,MgSO4·7H2O,KH2PO4,CaCO3,pH 7.0。250 mL摇瓶装种子培养基30 mL,28℃,200 r/min培养48~52 h。
发酵培养基:含正丙醇,CaCO3,MgSO4·7H2O,NH4SO4,淀粉,糊精,黄豆饼粉,棉籽饼粉,玉米浆,葡萄糖,pH 7.0。250 mL摇瓶装种子培养基30 mL,121℃灭菌30 min。接种量10%,28℃,220 r/min培养7 d。
1.2.2 ARTP诱变操作 以99.99%氦气作为工作气体,氦气流量10 SLM;处理功率120 W;样品与等离子体发生器出口距离2 mm;处理样品为20 μL孢子悬液。为了寻找最佳的诱变处理时间,首先分别考察了照射时间为20、40、60、80、100、120 s时的细胞致死率。对处理过的样品在适当的稀释度下涂板,采用活菌计数法(CFU)计算致死率并获得致死曲线。
1.2.3 紫外照射诱变与ARTP复合诱变 采用先紫外线诱变后等离子诱变的方法。取新鲜斜面加入生理盐水制成孢子悬液,玻璃珠打碎,过滤,收集单孢子悬液,控制浓度为107个/mL左右。取2 mL孢子悬液加入 φ 90 mm玻璃培养皿中,在距离30 W紫外灯30 cm下照射30 s。将紫外诱变后的孢子悬液进行等离子体诱变。取20 μL紫外诱变后的菌悬液滴在专用圆形不锈钢载片上,诱变处理40 s,将载片放入有1.5 mL生理盐水的离心管进行复苏,充分振荡混匀。稀释到一定倍数,取100 μL稀释菌液涂布平板,32℃培养9~11 d。按照上述诱变操作程序,平行诱变8块载片并涂平板。根据菌落生长的大小、圆整和丰度,随机挑选单菌落进行摇瓶初筛和复筛。
1.2.4 红霉素标准曲线制备方法 参考文献[4]精密称量红霉素对照品0.0502 g,置100 mL容量瓶中,加乙醇20 mL溶解,用水稀释至刻度。精密量取0~5 mL,分别置于100 mL的容量瓶中,定容后使其最终浓度相当于含红霉素0、1、5、10、20、30、40、50 mg/L。分别加入硫酸溶液(5 mol/L)12 mL,在80℃水浴7 min,取出立即水浴冷却至室温,用硫酸溶液稀释至刻度,在483 nm处测定吸光度,以效价为纵坐标,吸光度为横坐标,做回归方程(r≥0.999),列表备用。
1.2.5 发酵液化学效价检测方法 本法[5]是硫酸水解法,即红霉素经硫酸水解后呈黄色,于483 nm处有极大吸收值,可以定量测定。在发酵液经离心后,根据确定好的倍数吸取一定量的滤液,用0.35%碳酸钾液稀释。然后,取稀释液20 mL于分液漏斗中,加入醋酸丁酯20 mL,振摇30 min,放置分层,弃去下层水液,于丁酯液中加入无水硫酸钠1 g左右(可酌量多加使丁酯液澄清),振荡至透明。准确吸取其上层脱水液10 mL于另一干燥的分液漏斗中,精确加入盐酸(0.1 mol/L)10 mL,振荡30 min,放置分层,把下层盐酸水液放入试管中,从中吸取5 mL放入另一试管中,加入硫酸(8 mol/L)5 mL,摇匀,放入 50℃水浴中,保温 30 min取出冷却。在483 nm处测定吸光度值,同时以蒸馏水为空白,用所得的吸光度值查标准曲线。效价=查出数×稀释倍数。
1.2.6 菌株遗传性状稳定性实验 将4株高产突变株在斜面培养基上连续传代4代,然后按1.2.1项进行同批发酵培养,测定其化学效价并进行分析比较,检测菌株遗传性状是否稳定。
1.2.7 12#突变株生物学特性研究方法
1.2.7.1 生长曲线 将12#突变株及出发菌株分别接入种瓶培养基中,按1.2.1项方法进行培养,分别于10、20、30、40、50 h取样按体积法测定其菌浓。
1.2.7.2 不同pH条件下的生长情况 将12#突变株及出发菌株分别接入不同pH(4、5、6、7、8、9、10)的种瓶培养基中培养,于 50 h按体积法测定其菌浓。
1.2.7.3 生长温度范围 将12#突变株及出发菌株分别接入种瓶培养基中,分别置于20、25、28、35℃进行培养,于50 h按体积法测定其菌浓。
2 结果与分析
2.1 红霉素标准曲线 结果如图1所示。
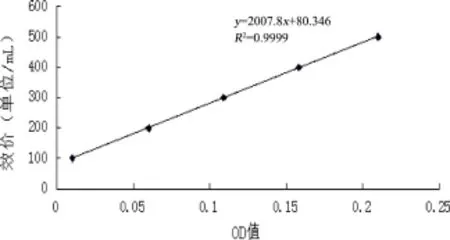
图1 红霉素标准曲线图
2.2 ARTP诱变致死率曲线 结果如图2所示。
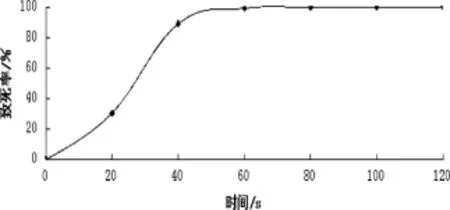
图2 红色糖多孢菌的ARTP诱变致死率曲线图
由图2可知,ARTP对红色糖多孢菌具有很强的致死效应,按方法1.2.2项对菌体的致死率进行计算,ARTP处理60 s时,其致死率达到了99.2%。根据诱变理论研究,80%~90%的致死率有利于正突变菌株的产生[6-8],而过高的诱变剂量导致存活菌落生长微弱,无筛选价值,因此本实验选择致死率为89%左右、照射时间40 s进行诱变筛选。
2.3 紫外照射诱变与ARTP复合诱变 出发菌株EM13-165经常压室温等离子体射流诱变与紫外照射复合诱变后,自分离培养皿中得到216个单菌落,挑取单菌落接斜面后,初步筛选出27株效价提高的正突变菌株。由于这27株菌中还可能存在遗传不稳定或者试验操作误差筛选的高产菌株,为了获得准确的遗传稳定的高产突变菌株,还需从这些初筛菌株中重复筛选。复筛结果如图3所示。复筛最终按照效价提高20%的标准筛选出2#,10#,12#,17#4株突变株。由结果可知,利用ARTP-UV筛选到的正突变株占初筛菌株的12.5%,其中突变株12#摇瓶发酵化学效价最高,达到10029单位/mL,比出发菌株提高了28.6%。
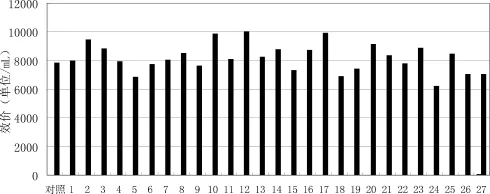
图3 27株菌株与原始菌株效价的比较图
2.4 突变菌株遗传稳定性的验证 为了验证突变株的遗传稳定性,对筛选到的4株高产突变株2#,10#,12#,17#进行遗传稳定性的比较。将4株高产突变株连续传代4代,然后同批进行摇瓶验证,结果如图4所示。
突变株2#,10#,12#和17#较出发菌株分别提高了20.8%、25.2%、28.6%和26.1%。经过连续传代4次,其效价分别下降了6.2%、3.3%、1.6%和8.9%。相比于其他3株菌,12#突变株具有较高的产量,且具有良好的遗传稳定性。
2.5 突变菌生物学特性研究 对获得的12#突变株进行生物学特性研究实验,通过与出发菌株比较生长曲线、pH和温度范围,结果如图5所示。
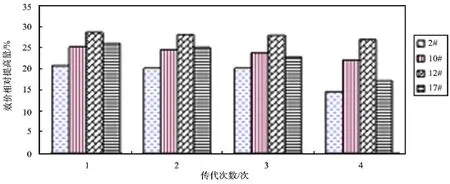
图4 高产突变株2#,10#,12#,17#连续传代4次的遗传稳定性

图5 出发菌株与12#突变株生长曲线(a)、不同pH条件下的生长情况(b)及生长温度范围的比较(c)
由图5中a可以看出,出发菌与突变菌的生长趋势基本一致,都能快速进入对数生长期,只是突变菌比出发菌要生长稍快一些。图5中b通过研究两株菌的生长pH范围,发现突变菌和出发菌在pH 5~10范围均能生长,两者的最适生长pH一致。由图5中c可知,突变菌与出发菌的最适生长温度是28℃。
3 讨论与小结
由于大多数生产菌株已被传统诱变方法反复诱变,因此对传统诱变方法具备了一定抗性和饱和性。等离子诱变作为一种新兴的诱变方法,能在一定程度上弥补传统诱变方法在这方面上的缺陷。阿维链霉菌、发孢甲基变菌、酶母菌等微生物通过ARTP诱变,突变速度快、突变库多样性大,并成功地筛选获得高产突变株[9-10],但这种诱变方法在红霉素选育相关文献中未见有报道。本研究采用这种新型的常压室温等离子体协同紫外诱变作用于红色糖多孢菌,获得了一株红霉素产量明显提高的突变菌株12#,其发酵单位可达10029单位/mL,比出发菌株提高了28.6%。通过生物学特性研究实验,出发菌与突变菌的生长趋势基本一致,两者的最适生长pH一致,突变菌与出发菌的最适生长温度都是28℃。通过传代培养,红霉素产量能稳定维持在高水平,表明经复合诱变获得的这株突变菌的遗传稳定性高。
实验表明ARTP诱变育种技术是一种新型、有效的微生物诱变育种方法,可与传统诱变方法结合为改善微生物的生产能力提供了一条新的途径,其能够用于诱变红霉素产生菌,且诱变效果显著。本文的实验结果均是在摇瓶条件下得到的,由于摇瓶培养过程中营养、溶氧和pH等条件不进行调控,所以菌种的优良性能并没有得到很好的发挥,在生产应用时还需要通过发酵罐对其代谢特性进行分析,并进一步优化其发酵条件及培养基组成,以达到最佳水平。
[1]陈韵亿,金丽华,李和平,等.常压室温等离子体非转基因生物诱变木糖代谢产油酵母的方法及特性研究[J].食品科学,2012,33:213.
[2]宋道军,姚建铭,邵春林,等.离子注入微生物产生“马鞍型”存活曲线的可能作用机制明[J].核技术,1999,22(3):129-132.
[3]华承伟,于江傲,谢凤珍.红色链霉菌发酵产红霉素培养基的响应面优化[J].中国生物制品学杂志,2011,24(6):728-729.
[4]南京药学院.药物分析化学[M].南京:江苏科技出版社,l985:265-272.
[5]范代娣,党 政,孙晓红,等.红霉素摇瓶发酵实验工艺条件[J].西北大学学报,2000,30(1):43-44.
[6]张晓勇,陈秀霞.低能离子诱变育种作用机理及生物学效应研究进展[J].广东农业科学,2008,(6):20-22.
[7]SONG Yun,ZHANG Huaiyu,CHANG Zhijian.Progress of mutation breeding with ion beam implantation[J].Molecular Plant Breeding,2004,2(2):301-305.
[8]FENG Huiyun,YU Zengliang,CHU P K.Ion implantation of organisms[J].Materials Science and Engineering,2006,54(3/4):49-120.
[9]L Y Wang,Z L Huang,G Li,et al.Novel mutation breeding method forStreptomyces avermitilisusing an atmospheric pressure glow discharge plasma [J].Appl Microbiol, 2009,108:851-858.
[10]郑明英,蔡友华,陆最青,等.常压室温等离子体快速诱变筛选高脯氨酸产率突变株[J].食品与发酵工业,2013,39(1):37-41.
(编 辑:侯向辉)
A Mutant Strain with High Erythromycin Yield Obtained by Using Novel Atmospheric and Room Temperature Plasmas and UV Mutation
SHEN Xiao-Jing,ZHANG Ping,SHI Yan-Peng∗
(Ningxia Tairui Pharmaceutical Co Ltd,Yinchuan750101,China)
Atmospheric and room temperature plasma(ARTP)-UV composite mutagenesis were adopted to treat with erythromycin-producing strain,four high-efficient producing strains were obtained by screening,which was increased in fermentation potency by 25.2%over the original strain.The mutant 12#with genetic stability was obtained.Its yield of erythromycin was 10029 U/mL,28.6%higher than the original strain.ARTP-UV composite mutation was a simple and efficient method for screening.
erythromycin;atmospheric and room temperature plasma(ARTP);ultraviolet(uv);composite mutagenesis;hereditary stability
2014-11-12
A
1002-1280(2015)01-0019-05
S859.796
沈小静,硕士,从事抗生素发酵菌种培养、选育研究。
石彦鹏。E-mail:shiyanpeng@tairuiworld.com
