严格管理心率对慢性心力衰竭患者心功能和生活质量影响
2015-04-26王璐董梦青吴迪葛智儒
王璐,董梦青,吴迪,葛智儒
心力衰竭(心衰)是各类心脏疾病的终末阶段。流行病学资料估计,全球心衰患者达2250万,且每年以200万人次递增[2]。我国心衰患病率为0.9%,成年人中约400万的心衰患者[3]。心衰患者通常反复住院,生活质量差,给家庭及社会带来沉重负担。随着β受体阻滞剂在心衰中的广泛应用,控制心率能否改善心衰患者心功能和生活质量,逐渐成为一个研究热点。本研究旨在比较严格控制静息心率与常规治疗对改善心功能及生活质量的差异。
1 资料与方法
1.1 病例入选 选取2012年7月至2013年6月在上海市浦东新区公利医院心血管内科住院的93例慢性心衰患者。入选标准:①左室射血分数(LVEF)≤40%;②纽约心功能分级(NYHA)Ⅱ-Ⅲ 级;③美国心衰指南C阶段。排除标准: ①心源性休克;②病态窦房结综合征、Ⅱ、Ⅲ度房室传导阻滞、有症状的心动过缓;③不稳定、失代偿性心力衰竭(肺水肿、低灌注或低血压);④持续性或间歇性接受β受体激动剂治疗的患者;⑤伴有坏疽危险的严重外周血管疾病患者;⑥支气管哮喘;⑦慢性阻塞性肺疾病;⑧甲状腺疾病;⑨预计生存时间<1年者;⑩孕妇及哺乳期妇女。
1.2 随机分组 通过信封抽签法随机分为试验组和对照组。试验组即严格控制静息心率组48例,其中男性32例,女性16例;对照组即常规治疗组45例,其中男性32例,女性13例。两组患者均给予心衰指南导向性治疗(包括AECI/ARB类药物、β受体阻滞剂、醛固酮受体拮抗剂),酌情使用利尿剂、洋地黄类及抗心律失常等药物。试验组中对于NYHA Ⅱ级患者,每2周调整一次美托洛尔缓释片剂量,直至静息心率控制在55~60次/min;对于NYHA Ⅲ级患者,起初为1~2周调整一次药物剂量,而后则每2周调整一次药物剂量,直至静息心率达到55~60次/min[4],长期随访1年。对照组则在普通门诊随访。
1.3 观察指标
1.3.1 静息心率、血压测定 医师测量:①坐位休息15 min;②测量前1 h须停止剧烈运动、进食咖啡、烟酒等;③室内保持安静;④被测试者放松并停止交谈;⑤测定血压、心率。
鼓励患者自我心率管理:清晨醒来起床之前,找到腕部或颈部脉搏搏动部位,将食指和中指同时压在此处,计数每分钟脉搏跳动次数。
1.3.2 心脏超声 采用美国GE公司生产的Vivid7彩色超声诊断仪测定,左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)和左室射血分数(LVEF)。
1.3.3 心功能指标 包括血浆N-末端B型脑钠肽前体(NT-proBNP)、6分钟步行试验、明尼苏达心衰生活质量评分。①血浆NT-proBNP,入组时及随访1年时,分别抽血检测;②6分钟步行试验(6MWT)测定方法:在心内科病房的直线走廊,取30米距离划一红色直线,起点终点各放置一把椅子做标记物,使受试者沿直线往返步行,至6分钟结束,测量步行距离。测定前充分告知患者尽己所能快步行走。测试过程中,患者可调整步速或坐下休息。如受试过程中,出现心绞痛、呼吸困难、晕厥等,则试验终止[4]。每位患者测定两次,间隔>30 min,取高值;③明尼苏达心衰生活质量评分。
1.3.4 再入院率指标 统计两组患者再入院率。
1.4 基线资料 两组患者的性别、年龄以及入组时心功能分级和明尼苏达心衰生活质量评分等指标均无明显差异(P>0.05),具有可比性。其中在诊断上,缺血性心肌病与非缺血性心肌病在试验组分别占54.17%和45.83%,在对照组分别占64.44%和35.56%(表1)。
1.5 统计方法 采用 SPSS15.0 统计软件,计量资料以均数±标准差表示,组间比较采用t检验,采用方差分析,计数资料比较采用卡方检验,检验水准为α=0.05,P<0.05为统计学差异有显著意义。
2 结果
2.1 试验组与对照组治疗前后的比较 分别比较治疗前后的实验组与对照组,发现经过普通心衰规范化治疗的对照组在心率、NYHA、心衰指标、步行试验有一定统计学意义(P<0.05);而经过严格控制心率治疗的试验组在心率、LVEF、NYHA、心衰指标、6分钟步行试验指标有明显统计学差异(P<0.05)(表2)。
2.2 试验组与对照组治疗后比较 治疗后的试验组和对照组比较, LVEF及LVESD具有显著性差异(P<0.05,P<0.01);两组美托洛尔缓释片剂量为(57.61±28.03 mg/d vs. 36.70±16.76 mg/d)差异具有显著性意义(P<0.01);再次住院 明显低于对照组(33.33% vs. 55.56%,P<0.05)。(表3)。
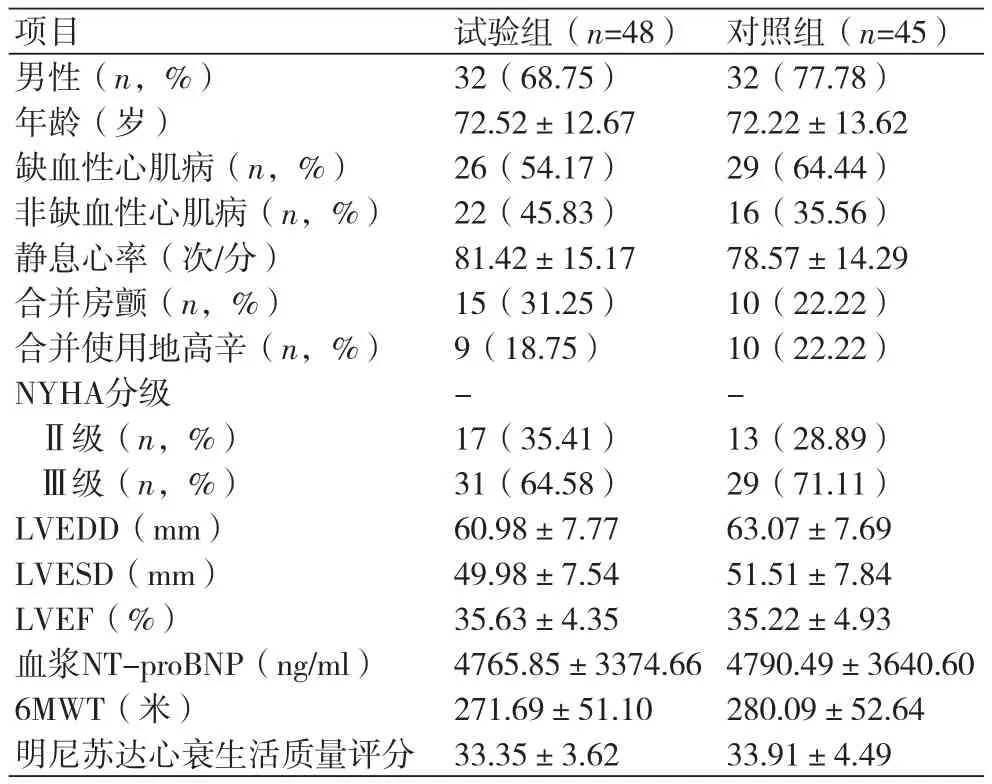
表1 两组一般资料对比
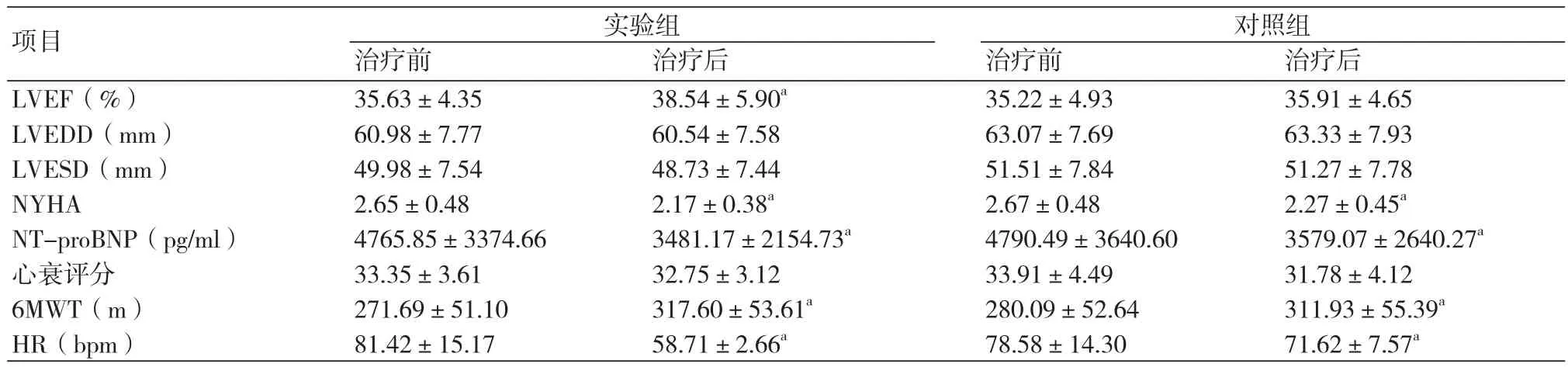
表2 试验组与对照组治疗前后的比较

表3 试验组与对照组治疗后比较
3 讨论
β受体阻滞剂在心衰治疗中的地位近年来不断提高,并已列入各大心衰治疗指南的Ia类推荐[1,5,6]。β受体阻滞剂是唯一的能减少心源性猝死的心血管药物,且可早期、显著地降低总死亡率(MERIT-HF[7]、CIBIS Ⅱ[8]、和COPERNICUS[9])。交感神经系统激活致心肌重构是心力衰竭发生与发展的重要病理生理学机制,也构成了β受体阻滞剂治疗慢性心衰的基石。β受体阻滞剂通过上调β受体的密度,恢复β1受体对于去甲肾上腺素和肾上腺素的敏感性,从而改变β受体下游信号转导;通过上调β1受体密度并改善其功能,恢复心肌细胞β1与α1受体的密度与效应比值,使α1受体所介导的血管收缩和致心肌细胞的肥大与凋亡作用受到遏制;抑制交感神经兴奋后由肾脏β1受体所介导肾素-血管紧张素-醛固酮系统(RASS)的持续活化,降低了血管紧张素Ⅱ和盐皮质激素过度分泌对心肌与血管重构作用[6]。β受体阻滞剂“去交感神经化”的作用是心衰治疗中的关键。
静息心率是慢性心衰发生、发展和死亡强有力的预测及危险因素[10-13]。SHIFT、BEAUTIFUL等研究证实,控制静息心率在55~60 次/min,可以改善心衰患者的预后[11,14]。本研究结果显示,在心衰患者中,通过个体化调整美托洛尔剂量,严格控制静息心率,可显著改善慢性心衰患者的生活质量及心功能水平,该结果与大规模研究结果相符。但在明尼苏达心衰生活质量评分上,结果无统计学意义,可能与入选患者年龄大、样本量少有关。
尽管有指南和大量研究证实,β受体阻滞剂治疗剂量的个体化调整标准是心率达标,但是真实世界和治疗指南之间仍存在较大差距。在冠心病患者中,据我国2007~2009年公布(13 078例)的调查数据,β阻滞剂的使用比例较低仅为60%,其中心肌梗死患者使用的比例也仅61.9%。同样,对于已经接受β受体阻滞剂治疗的患者,剂量使用明显不足,心率是否已积极控制达标,是否逐渐调整剂量存在认识不足。因而提高患者及医师对于控制心率的重要性的认识。
对于慢性心衰患者,提高其对于控制心率的意识,在给予心衰指南导向性治疗的前提下,积极个体化调整药物剂量,控制心衰患者的静息心率,可以显著提高心衰患者的心功能水平及生活质量。
[1] Yancy CW,Jessup M,Bozkurt B,et al. 2013 ACCF/AHA Guideline for the Management of Heart Failure[J]. Journal of the American College of Cardiology,2013,62(16 ):e147-239.
[2] 姜红,葛均波. 心力衰竭流行病学特点[J]. 中国医学前沿杂志(电子版),2012,2(1):1-5.
[3] 顾东风,黄广勇,何江,等. 中国心力衰竭流行病学调查及其患病率[J]. 中华心血管病杂志,2003,1(31):3-6.
[4] 张忠玲,毛静远. 6分钟步行试验在慢性心力衰竭中的应用思考[J]. 吉林中医药杂志,2011,31(7):3-6.
[5] McMurray JJ,Adamopoulos S,Anker SD,et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology[J]. Eur Heart J,2012,33:1787- 847.
[6] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2014[J]. 中华心血管病杂志,2014,42(2):98-122.
[7] MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart Failure(MERIT-HF)[J]. Lancet,1999,353:2001-7.
[8] Lechat P,Hulot JS,Escolano S,et al. Heart rate and cardiac rhythm relationships with bisoprolol benefit in chronic heart failure in CIBIS II trail[J]. Circulation,2001,103(10):1428-33.
[9] Packer M,Coats AJ,Fowler MB,et al. Effect of carvedilol on survival in severe chronic heart failure[J]. N Engl J Med,2001,344(22):1651- 8.
[10] Kaplon-Cieslicka A,Balsam P,Ozierański K,et al. Resting heart rate at hospital admission and its relation to hospital outcome in patients with heart failure[J]. Cardiol J,2014,21(4):425-33.
[11] Böhm M,Swedberg K,Komajda M,et al. Heart rate as a risk factor in chronic heart failure(SHIFT): the association between heart rate and outcomes in a randomized placebo-controlled trial[J]. Lancet,2010,376(9744):886-94.
[12] 郑宏健,卢新郑. 心率控制的新认识[J]. 心血管病学进展,2011,32(6):809-12
[13] Fox K,Borer JS,Camm AJ,et al, for the Heart Rate Working group.Resting heart rate in cardiovascular disease[J]. J Am Coll Cardiol,2007,50:82-130.
[14] Fox K,Ford I,Steg PG,et al. Ivabradine for patients withstable coronary artery disease and left-ventricular systolic dysfunction( BEAUTIFUL) a randomized double-blind, placebo-controlled trial[J]. Lancet,2008,372 (9641):807-16.
