酒曲中产酯酵母的分离筛选
2015-04-25万世旅李光辉钟姝霞边名鸿
万世旅,李光辉,钟姝霞,边名鸿
(1.四川理工学院生物工程学院,四川 自贡 643000;2.酿酒生物技术及应用四川省重点实验室,四川 自贡 643000)
引言
产酯酵母又称生香酵母,是可生成较多酯类物质的酵母通称,分属于汉逊酵母属,产朊酵母属、假丝酵母属、球拟酵母属和酒香酵母属等,是中国白酒中酯香的主要产生菌。产酯酵母主产乙酸酯类,特别是乙酸乙酯[1-3]。
小曲酒是我国白酒的主要酒种之一,在四川、贵州、云南、江西、湖北和湖南等省有广泛的分布。随着小曲白酒生产工艺技术的改革和科研的进步,小曲酒的质量有了一定提高,但仍普遍存在放香不足等问题[4]。乙酸乙酯作为小曲白酒的主体香味成分,其含量对于小曲酒的质量有着重要影响,因此,筛选产乙酸乙酯能力强,产酯丰富并且适合小曲酒生产的酵母,可以为小曲的制曲提供优良的菌种,提高小曲质量,改善小曲酒酒质,促进小曲酒的发展,同时提高小曲酒生产企业的经济效益和市场竞争力[5]。
传统酒曲中含有大量酿酒有益微生物,包括优良糖化菌、酵母菌等,本文从优质酿造酒曲中筛选产酯酵母,并以高粱酶解液作为培养基研究其产酯情况,以期获得适于小曲酒酿造的优良产酯酵母。
1 材料与方法
1.1 试验材料
1.1.1 样品及菌种来源
样品:8种来源于川西南片区不同区域的酿造酒曲,其中,5种大曲,3种小曲。
对比菌株:产酯酵母Njsys-SYT由实验室分离培养并保存。
1.1.2 主要试剂
氢氧化钠、醋酸钠、氯化钾、硫酸、无水乙醇、酚酞、氯化钠、葡萄糖、琼脂粉(分析纯,成都科龙化工);糖化酶、淀粉酶、蛋白胨、酵母浸膏(北京奥博星生物技术有限责任公司);三丁酸甘油酯(阿拉丁试剂(上海)有限公司);链霉素、青霉素、土豆、高粱(市售)。
1.1.3 培养基
产香初筛培养基:马铃薯20%,蔗糖2%,琼脂2%,三丁酸甘油酯0.4%,pH自然(涂布时培养基中加入60 mg/L的青霉素抑制细菌生长,在温度40℃左右时,添加摇匀)。
菌种活化培养基:葡萄糖2%,酵母膏1%,蛋白胨2%,pH自然。
发酵产酯培养基[6]:取150 g高粱粉于2 L烧杯中,加入少量自来水,搅成糊状,再加热水600 mL,搅匀,调pH值为6.0~6.5,加入α-淀粉酶和糖化酶经液化和糖化后取上清液将其糖度调到8°Bx备用。
1.1.4 主要仪器
E100生物显微成像系统(日本NIKON公司),UV-200紫外可见分光光度计(上海尤尼柯有限公司),PHJ-02型pH计(上海精密科学仪器有限公司),BS-2F数控恒温摇床培养箱(常州精成国华仪器有限公司),MJ-250生化培养箱(上海齐欣科学仪器有限公司)。
1.2 试验方法
1.2.1 酵母的分离纯化
称取5 g酒曲样品,加入装有45 mL无菌生理盐水的三角瓶中,150 r/min振荡30min,充分摇匀。取5 mL上清液加入45 mL麦氏培养液三角瓶中30℃摇床富集培养24 h,经梯度稀释后涂布,依次挑取有透明圈的单菌落,经多次平板划线纯化后,通过显微镜观察是否为纯种菌落,将纯菌种移入试管斜面,冰箱内保存备用;不纯的继续分离划线,直至纯化为止。
1.2.2 产酯酵母初筛
将从曲样中分离得到的产酯酵母菌和对比菌株Njsys-SYT采用点种的方式接种到产香初筛培养基上,30℃培养48 h,每株菌设计3个平行对照组,测量菌落直径d,透明圈直径D,计算D/d值,选择D/d值较大的作为复筛出发菌株。
1.2.3 产酯酵母复筛
对复筛菌株进行活化,接种在液体活化培养基中,摇床培养24 h后,将细胞数稀释到108个/mL,按10%的量接种于装有100 mL发酵产酯培养基的三角瓶中,28℃恒温静置培养4 d,每株菌设计3个平行对照组,检测总酯含量,总酯的测定采用皂化回流法[7]。同时将这几株菌制作成纯种酵母曲测定其对四大酯催化生产能力:称取相当于5 g干曲的曲量加入100 mL含1%相应有机酸和20%乙醇的酯化体系中32℃酯化100 h,加水50 mL蒸馏,接溜出液100 mL测定相应酯含量[8]。
1.2.4 产酯酵母的耐受性研究
耐酒精试验:在酒精浓度为0%,6%,8%,10%,12%,14%的YEPD液体培养基中接入菌种,120 rpm摇床培养24 h后测定600 nm波长下的吸光值,浓度大的菌液可以作适当稀释,使其测得OD值在0.10~0.80以内,经稀释后测得的OD值乘以稀释倍数,即为培养液实际的 OD 值[9]。
耐热试验:分别将接有菌种的培养基置于30℃、34℃、36℃、38℃和40℃下120 rpm振荡培养24 h后,测定600 nm波长下的OD值。
耐酸性试验:用盐酸调节培养基 pH 为 2.0、3.0、4.0、5.0、6.0,接入酵母菌悬液,30 ℃、120 rpm 摇床培养24 h后,测定600 nm波长下的OD值。
2 结果与分析
2.1 酵母的分离纯化
采用传统分离手段对酒曲中酵母菌进行分离,将富集后的酒曲菌悬液经过涂布、划线后共分离出31株酵母菌株,其中有透明圈的产酯酵母有18株,菌落大多呈乳白色,表面较湿润粗糙,中央平坦边缘整齐,细胞多呈圆形。透明圈明显的代表性菌株如图1所示。
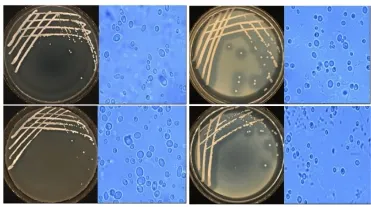
图1 部分菌落与菌体形态
2.2 产酯酵母的初筛
将从曲样中分离得到的18株产酯酵母及对比菌株Njsys-SYT接入产香初筛培养基上。通过测量酵母菌落直径d、透明圈直径D,计算其比值D/d,通过D/d值的大小来表征酵母菌酯化酶活力的高低,结果如图2所示。
对比菌株Njsys-SYT是实验室保存的一株优良产酯酵母菌,因此考虑以Njsys-SYT为参考,选择D/d≥3.0作为复筛条件,由图 2可知,Y1、Y2、Y4及 Y6的D/d值均大于3.0,因此选择这4株菌作为复筛出发菌株,进一步研究其产酯化酶能力。
2.3 产酯酵母的复筛
将 Y1、Y2、Y4、Y6 及 Njsys-SYT 5 株菌株进行发酵,测定其总酯含量,并将其制作成纯种酵母曲考察其对己酸乙酯、乙酸乙酯、乳酸乙酯、丁酸乙酯的催化生成能力。结果分别如图3和图4所示。
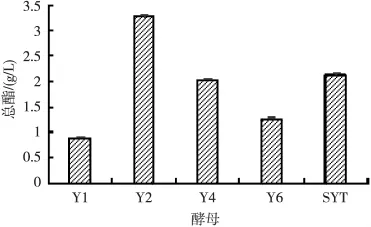
图3 复筛酵母的产总酯结果比较

图4 复筛酵母的四大酯催化生成能力比较
从图3中可知,在相同的条件下,酵母Y2、Y4和Njsys-SYT产酯效果较好,其中酵母Y2产酯能力突出,发酵液中总酯含量达到3.273 g/L,酵母Y4和Njsys-SYT的发酵液中总酯含量分别也达到2.042 g/L和2.129 g/L。
由图4可知,5株酵母均对乙酸乙酯有很高的催化生产能力,其次是己酸乙酯,其中酵母Y2对这两种酯的催化能力最强,其催化生成乙酸乙酯和己酸乙酯的量达到2.731 g/L和1.921 g/L;5株酵母对己酸的催化能力高于对乳酸的催化能力,这与产酯酵母有升己酸乙酯,降乳酸乙酯作用的研究报道相符[10]。综上分析,酵母Y2在液态和固态发酵下都有较强的酯化能力,可作为一株优良的产酯酵母。
2.4 产酯酵母生长特性研究
小曲酒酿造环境(高酒精浓度、低pH及高温)对产酯酵母影响较大,因此需要研究产酯酵母在不同条件的生长情况,以考察菌种对酒精、温度及酸度的耐受性。
2.4.1 酒精浓度对菌株生长的影响
将酵母菌悬液接种于酒精含量分别为0%,6%、8%、10%、12%、14%的YEPD液体培养基中30℃培养24 h后,测定其在600 nm的菌体浓度,结果如图5所示。

图5 不同酒精含量下Y2菌株的生长情况
由图5可以看出菌株的生长随着酒精浓度的升高而受到严重影响。菌株Y2能耐受10%的酒精环境,有较高的耐酒精能力,这样在白酒发酵后期,酒精的积累对菌株Y2的影响相对会较小,有利于香味物质的合成。
2.4.2 耐热性试验
将酵母菌悬液接种于YEPD液体培养基中,分别置于30℃,34℃,36℃,38℃,40℃下120 rpm振荡培养24 h后,测定其在600 nm波长下的菌体浓度,结果如图6所示。
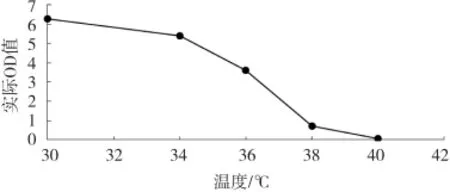
图6 不同温度下Y2菌株的生长情况
小曲白酒因为发酵周期短,因此在发酵过程中升温幅度较大。耐高温的产香微生物有利于代谢产物的积累,同时,温度影响微生物细胞内生物大分子(如蛋白质和核酸)的稳定性、细胞膜的流动性等方面[11],温度变化能够导致细胞膜破坏、代谢活动减弱,影响细胞生长。由图6可知,菌株Y2在38℃仍有一定的生长,有较强的耐热性。
2.4.3 耐酸性试验
将酵母菌悬液接种于 pH 值分别为 2.0、3.0、4.0、5.0、6.0的YEPD液体培养基中30℃培养24 h后,测定其在600 nm的菌体浓度,结果如图7所示。

图7 不同pH条件下Y2菌株的生长情况
小曲酒发酵周期短,产酸快,酿酒过程pH值较低,因此对微生物耐酸性要求很高。同时pH值变化能使微生物细胞中的电解质发生变化,从而影响微生物的生长代谢[12]。由图7可知,Y2酵母菌株在pH值为2的情况下生长依然旺盛,可见该菌株耐酸性能很好。
3 结束语
本文从不同酒曲样品中分离纯化出有产酯能力的酵母菌18株,通过初筛、复筛,得到一株产乙酸乙酯能力较强的酵母 Y2,其在高粱糖化液中总酯产量为3.273 g/L,在100 mL的酯化体系中催化生成乙酸乙酯和己酸乙酯的量为2.731 g/L和1.921 g/L。该酵母菌能在酒精浓度10%、pH2.0、温度为38℃的条件下生长,具有良好的耐酒精、耐酸和耐热能力,是一株优良的产香酵母,在改善小曲酒风味及稳定酒的质量有较好的应用前景。
[1] 徐姿静,唐清兰,刘孟华,等.剑南春酒曲中生香酵母菌株的选育[J].酿酒,2012(3):11-14.
[2] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998.
[3] 胡沂淮,贾亚伟,戴源,等.生香酵母Yeast-1产香物质的GC-MS分析[J].酿酒科技,2013(6):21-24.
[4] 李一川.高质量小曲白酒的研究[D].武汉:湖北大学,2014.
[5] 吴赫川,马莹莹,杨建刚.川法小曲白酒发展现状及其瓶颈问题分析[J].安徽农业科学,2014,42(33):11850-11853.
[6] 董士伟.豉香型白酒中功能微生物的筛选与应用[D].郑州:河南工业大学,2012.
[7] 王福荣.酿酒分析与检测[M].北京:化学工业出版社,2012.
[8] 蒲春,胡沂淮,贾亚伟,等.产酯酵母的筛选及其发酵特性研究[J].酿酒科技,2013(3):47-49,53.
[9] 彭源德,朱作华,唐守伟.耐高温、高浓度酒精酵母的选育与耐受性能初步鉴定[J].中国麻业科学,2010(3):135-139,142.
[10] 施安辉,刘积和,曲维祺.当前浓香型白酒增己降乳的微生物学技术[J].中国酿造,2001(3):8-10.
[11] 张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[12] 兰天晴.固定细胞发酵产纤维素酶及纤维素乙醇的生产应用研究[D].广州:华南理工大学,2013.
