不同温度对采后杏鲍菇贮藏品质的影响研究
2015-04-24谢丽源郑林用彭卫红黄忠乾甘炳成
谢丽源,郑林用,彭卫红,唐 杰,黄忠乾,谭 伟,甘炳成
(四川省农业科学院土壤肥料研究所,四川成都610066)
不同温度对采后杏鲍菇贮藏品质的影响研究
谢丽源,郑林用,彭卫红,唐 杰,黄忠乾,谭 伟,甘炳成*
(四川省农业科学院土壤肥料研究所,四川成都610066)
以杏鲍菇为实验材料,分别置于2、4、6、8、10、12℃下贮藏,研究不同贮藏温度对杏鲍菇采后生理生化及品质的影响,以此确定杏鲍菇的最佳贮藏温度。结果表明,贮藏温度2、4℃较好地保持了杏鲍菇超氧化物歧化酶(SOD)(p<0.01)、过氧化氢酶(CAT)活性(p<0.05),有效抑制了蛋白质、VC、总糖、水分的快速流失(p<0.01或p<0.05)和丙二醛(MDA)含量的快速增加(p<0.01),降低了多酚氧化酶(PPO)活性(p<0.05),延缓了杏鲍菇贮藏过程中的品质劣变及衰老进程,较好地保持了菇体的商业品质。因此,2~4℃为杏鲍菇的适宜贮藏温度,延长了杏鲍菇的贮藏期,为杏鲍菇的贮藏保鲜提供理论依据和技术方法。
杏鲍菇,贮藏温度,采后生理,品质
杏鲍菇[Pleurotus eryngii(DC.Ex Fr.)Que]又名刺芹侧耳,营养丰富,味道鲜美,风味独特,素有“平菇王”、“草原上的美味牛肝菌”之美誉,隶属于真菌门(Eumycota)、担子菌亚门(Basidiomycotima)、层菌纲(Hymenomycetes)、无隔担子菌亚纲(Homobasidiomycetidae)、伞菌目(Agaricales)、侧耳科(Pleurotaceae)、侧耳属(Pleurotus)[1]。杏鲍菇富含蛋白质、多糖、维生素、氨基酸、甾醇等营养物质,具有降血压血脂、降低胆固醇、抗动脉粥样硬化,能刺激抗体形成、增强人体免疫力,发挥防癌抗癌的作用,而且对脂肪肝、急性肝炎、心肌梗塞、脑梗塞、某些肿瘤均具有良好的预防和治疗作用[2-7]。近年来,随着市场需求的增加以及工厂化栽培模式的推广,杏鲍菇的产量大幅度提升,而杏鲍菇的采后贮运也愈来愈成为其产业发展亟需解决的问题。然而杏鲍菇采后由于含水量大,酶活性强,生理代谢旺盛、营养物质消耗快,常温下不耐贮藏,容易出现变软、变黏、褐变、发臭等现象,影响贮运和消费[8-9]。但目前杏鲍菇采后贮、运、销技术相对比较落后,生产上迫切需要适宜的贮藏保鲜技术。贮藏温度是采后影响其贮藏品质的关键因素,适宜的贮藏温度可以降低菇类的生理代谢水平,延长贮藏期,对保持良好商品性状和营养价值具有重要的意义[10]。研究发现气调保鲜[11-13]、臭氧保鲜[14]、辐照保鲜[15-16]、涂膜保鲜[17]等处理,再辅助低温(大多数文献报道为4℃),均能抑制杏鲍菇的呼吸作用和失重率的升高,减少营养物质的流失,保持杏鲍菇的新鲜品质,延长贮藏期。但是对于最适温度对贮藏品质影响的研究还较少见。
本文研究采后子实体在不同贮藏温度下,采后贮藏期间失重、相关酶活性(SOD、CAT、PPO、POD)、MDA含量、可溶性蛋白、总糖等生理生化指标的变化情况,揭示了他们与子实体衰老及耐贮性的关系,确定最适贮藏温度,为大规模栽培杏鲍菇的采后贮藏提供理论依据。
1 材料与方法
1.1 材料与仪器
供试材料 为人工栽培的新鲜杏鲍菇,采自成都榕珍菌业有限公司,采摘标准为7~8成熟度杏鲍菇,挑选菇体完整,色泽洁白、表面光洁、未开伞、无病虫害、无机械损伤、大小一致的子实体,采后立即运送至四川省农业科学院微生物研究中心;葡萄糖、浓硫酸、考马斯亮蓝G250、牛血清蛋白、硫代巴比妥酸、三氯乙酸、氮蓝四唑、聚乙烯吡咯烷酮、核黄素、邻苯二胺、甲硫氨酸、邻苯二酚 均为分析纯,购于成都市长征化玻有限公司
UV1240紫外分光光度计 日本岛津仪器公司;GLI66-Ⅱ高速离心机 上海安亭科学仪器厂;HH. S11-Ni6-列六孔恒温水浴锅 北京长安科学仪器厂;ALC-Z10.3电子天平 北京赛多利斯天平有限公司。
1.2 测定指标和方法
1.2.1 样品处理 选取新鲜无损伤杏鲍菇样品,每个处理组样品控制在100~140 g,分别放置于温度为2、4、6、8、10、12℃,相对湿度90%±5%的冷藏柜中贮藏,从贮藏期开始,每隔2 d随机取样一次,对所取样品的菌柄靠近菌盖的1/3处进行切片(先纵向切为两半,再横向切片),所切样品定期取样观察及测定相关生理生化指标,每个组重复3次。
1.2.2 冰点测定方法 将铜康铜(T型)热电偶温度传感器(感应头裸露,直径小于1 mm)的感应头插入杏鲍菇子实体中部,放入-80℃低温冰箱中,记录时间和温度,做时间-温度曲线,当曲线出现回折点后又下降至水平,保持水平5 min后停止测试,每2 min测定一次,重复3次。整个曲线的最低点为冻结点,回折点即为冰点[18]。
1.2.3 总糖含量的测定 采用苯酚-硫酸法,以标准葡萄糖制作标准曲线(y=0.0086x+0.0089,R2=0.9952)。称取1.0 g杏鲍菇样品组织置于研钵中,液氮研磨均匀,加少量蒸馏水研磨匀浆,转入20 mL具塞试管中,加入5~10 mL蒸馏水,薄膜封口,沸水中煮沸提取30 min,冷却、过滤,将残渣回收到试管中,加入10 mL蒸馏水,重复沸水浴提取10 min,冷却、过滤、洗涤,将两次滤液收集于100 mL容量瓶中并定容至刻度。吸取10 mL提取液于100 mL容量瓶中并定容至刻度。取1.0 mL稀释液于具塞刻度试管中,加入1.0 mL蒸馏水,1.0 mL 0.09 g/mL苯酚溶液,摇匀,再加入5.0 mL的浓硫酸,充分振荡后在室温下反应30 min,在波长490 nm处比色测定其吸光度,重复3次,通过标准曲线测定样品中的总糖含量[19]。
1.2.4 蛋白质含量的测定 考马斯亮蓝G250法测定[20],以标准牛血清蛋白溶液制作标准曲线(y=0.0039x+0.9581,R2=0.9999)。称取1.0 g杏鲍菇样品组织,加5 mL蒸馏水研磨成浆,于4℃、12000 g离心20 min,吸取提取液1.0 mL与25 mL容量瓶中并用蒸馏水定容至刻度,取1.0 mL稀释液放入具塞刻度试管中,加入5 mL考马斯亮蓝G250蛋白试剂,充分混合,放置2 min后在波长595 nm处比色测定其吸光度,重复3次,记录光密度OD值,并通过标准曲线计算待测样品中蛋白质的含量。
1.2.5 VC含量的测定 紫外快速测定法,以VC作标准曲线(y=0.0451x+0.0035,R2=0.9998)。称取剪碎混匀的菇5.0 g,加入5 mL 1%盐酸匀浆,转移至25 mL容量瓶中,稀释定容。离心(10000 r/min)10min后,取0.2 mL上清液,加入盛有0.2 mL 10%盐酸的10 mL容量瓶中,定容后以蒸馏水为空白,在243 nm处用紫外分光光度计测定吸光值,根据标准曲线,计算VC含量[21]。
1.2.6 丙二醛含量的测定 采用硫代巴比妥酸(TBA)比色法[19]。取样1 g,加入2 mL 10 g/100 mL三氯乙酸(TCA),研磨后转移至离心管,再加入8 mL TCA洗涤研钵一并转移至离心管。匀浆离心后取上清液2 mL(参比用10 g/100 mL TCA代替),加入2 mL 6 mg/mL TBA溶液,混匀于沸水浴上反应15 min,迅速冷却后再离心,分别取上清液测定OD450、OD532和OD600值。重复3次。
MDA含量(nmol·g-1FW)=[6.45(OD532-OD600)-0.56 OD450]V(Vs·W)-1
式中:V为提取液体积(mL);W为杏鲍菇组织鲜重(g);Vs为测定时取样品提取液体积(mL)。
1.2.7 SOD酶活测定 氮蓝四唑(NBT)法[22-23]。称取剪碎混匀的菇肉1.0 g,加入l mL预冷的0.05 mol/L pH7.8磷酸缓冲液(内含1%聚乙烯吡咯烷酮),在冰浴上研磨成匀浆,加缓冲液使终体积为5 mL后,于4℃10000 r/min低温离心15 min,上清液即为SOD粗提液。用0.05 mL提取液,分别加入1.5 mL 0.05 mol/L pH7.8磷酸缓冲液,0.3 mL 130 mmol/L甲硫氨酸(Met)溶液,0.3 mL 750 μmol/L氮蓝四唑(NBT)溶液,0.3 mL 100 μmol/L EDTA-Na2溶液,0.3mL 20 μmol/L核黄素溶液及0.25 mL蒸馏水,两支对照管以缓冲液代替酶液,混匀后一支对照管置暗处,其他各管于4000 Lx日光灯下反应20 min,置暗处终止反应。反应结束后,以不照光的对照管作空白,分别在560 nm下测定其他各管的吸光度,计算SOD活性。每组实验重复3次。以每分钟抑制NBT光化还原的50%为1个SOD酶活力单位(U)
SOD活性(U·g-1FW)=(A0-AE)×V×(0.5×A0×Vs× W×t)-1
式中:A0为光照对照管的吸光度;AE为样品管的吸光度;V为样品提取液总体积(mL);Vs为测定时样品用量(mL);W为样品鲜重(g),t为光照时间(min)。
1.2.8 POD酶活测定 取杏鲍菇2.0 g,加入4倍体积的0.05 mol/L、pH7.0的磷酸缓冲液(含1%PVPP),冰浴研磨10 min后,于4℃下12000×g离心,上清液即为粗酶液。pH7.0的PBS 2.5 mL,1%邻苯二胺-无水乙醇溶液0.20 mL,0.3%H2O20.1 mL,加入0.20 mL酶液,在470 nm处测定吸光度,每30 s测定一次,共测3 min,重复三次。以反应体系每克样品每分钟吸光度(A)变化0.01为一个POD酶活力单位(U),结果以U·g-1FW表示[19,23]。
1.2.9 PPO酶活测定 酶液的提取同POD。取0.2%的邻苯二酚溶液2.1 mL,加0.8 mL的0.1 mol/L、pH7.0的磷酸缓冲液,再加入0.1 mL的粗酶液,在420 nm处测定吸光度,每10 s记录1次,共记录3 min,以初始直线段的斜率(△OD/t)计算酶活力。每克样品每分钟吸光度变化0.001为一个酶活力单位(U),结果以U·g-1FW表示[19,23]。
1.2.10 CAT活性测定 取2.0 g杏鲍菇组织样品,在冰浴条件下用2.0 mL 0.1 mol/L pH7.5 PBS研磨,匀浆后转入离心管中,用该缓冲液3 mL洗涤研钵一并转移至离心管内,于4℃下12000×g,离心,上清液为粗酶液。取0.2 mL上清液,加入1.5 mL、0.05 mol/L、pH7.0磷酸缓冲液和0.3 mL 0.3%H2O2,加入后立即计时,并在240 nm处测吸光度。以l min内在240 nm处吸光度(A)变化0.001的酶量为一个酶活力单位(U)。结果以U·g-1FW表示[19,23]。
1.2.11 失重率测定 采用称量法称每组平行样品,分别记录贮藏前菇体重量和不同贮藏期菇体的重量。失重率(%)=(m-m1)×m-1×100
式中:m1为取样时重量(g);m为样品初始重量(g)。
1.2.12 数据统计 全部实验数据用Microsoft Excel 2003进行统计处理,所有数据为3次以上重复实验的平均值和标准误差(±SE),并制图;使用SPSS 18.0软件进行差异显著性分析,利用邓肯多重比较法(Duncan)对数据间进行差异显著性分析。p<0.05表示差异显著,p<0.01表示差异极显著。
2 结果与分析
2.1 杏鲍菇冰点
冰点是果蔬重要的物理特征之一,贮藏温度低于冰点时容易引起冻害,导致细胞结冰破裂,组织损伤,出现萎蔫、变色和死亡。测定冰点有助于确定果蔬的最适贮运温度[18]。
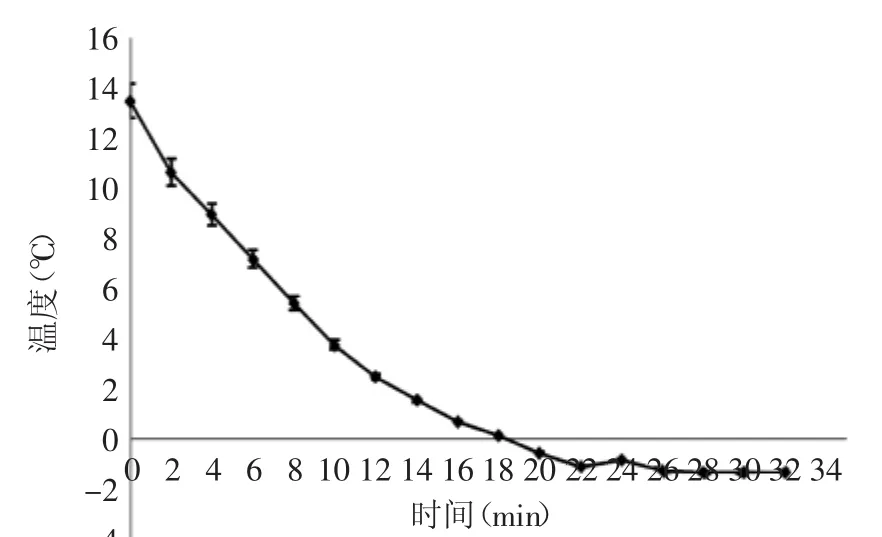
图1 杏鲍菇冰点温度曲线Fig.1 Freezing temperature curve of P.eryngii
杏鲍菇冰点温度的测定曲线如图1所示,杏鲍菇温度曲线在24 min时出现回折点,回折点温度分别为-0.8、-0.9、-0.8℃,平均为-0.83℃。由此可见杏鲍菇的冰点温度为-0.83℃。杏鲍菇在贮藏过程中若环境温度低于-0.83℃,就会出现冻害现象,从而为杏鲍菇的贮藏提供了温度依据。
2.2 贮藏温度对总糖含量的影响
如图2所示,在不同贮藏温度下,杏鲍菇总糖含量随着贮藏时间的延长先呈一个低幅度的上升后,再逐渐降低的变化趋势,且0~12 d内总糖含量的下降速度较为平缓,贮藏12 d后下降幅度开始增大。总糖含量的上升可能是由于采后为了满足菇体采后呼吸代谢的需要,所进行的后熟作用,随后随着贮藏时间延长,糖类物质不断被氧化分解。在贮藏第15 d,2、4℃贮藏组的多糖含量极显著(p<0.01)高于其他温度组,6℃贮藏组显著(p<0.05)高于8、10℃,8、10℃贮藏组显著(p<0.05)高于12℃。由此可知,2、4℃可以延缓贮藏过程中果蔬的后熟,有利于保证菇体的贮藏品质并延长贮藏期。
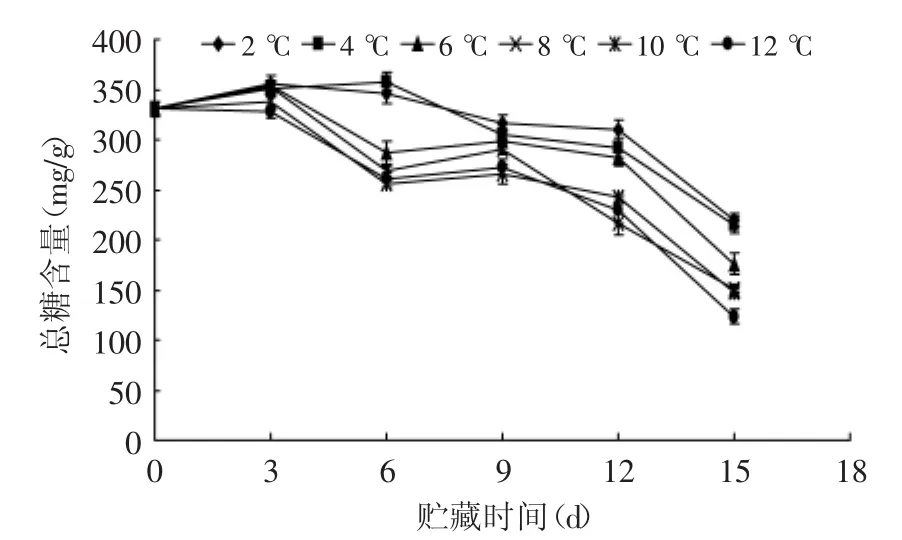
图2 不同贮藏温度对杏鲍菇总糖含量的影响Fig.2 Effect of different storage temperatures on the total sugar content of P.eryngii
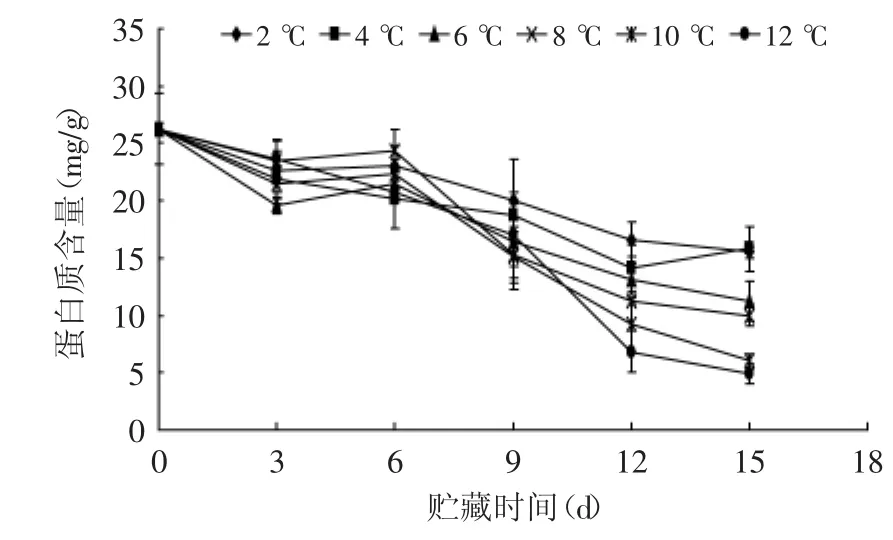
图3 不同贮藏温度对杏鲍菇可溶性蛋白含量的影响Fig.3 Effect of different storage temperatures on protein content of P.eryngii
2.3 贮藏温度对蛋白质含量的影响
在蘑菇的采后贮藏中,可溶性蛋白大部分被分解用以满足代谢需要。由图3可知,不同温度处理组杏鲍菇蛋白质含量呈下降趋势,且随着温度的增高蛋白质含量的降幅会增大。在贮藏第15 d,2、4℃贮藏组的蛋白质含量极显著(p<0.01)高于10、12℃,显著(p<0.05)高于6、8℃,而6、8℃贮藏组的蛋白质含量显著(p<0.05)高于10、12℃。由此可见,2、4℃能有效地抑制杏鲍菇子实体蛋白质的降解,降低其损失。
2.4 贮藏温度对杏鲍菇VC含量的影响
VC是果蔬主要营养成分之一,因其具有还原性,所以极易被氧化生成有色物质。如图4所示,在不同贮藏温度条件下,杏鲍菇VC含量变化均呈逐渐下降的趋势,且在前6 d下降速度较快,随后下降速度稍缓慢。在贮藏第15 d,2、4℃的VC含量极显著(p<0.01)高于其他温度组,而彼此间没有达到显著性差异;6、8℃的VC含量显著高于12℃(p<0.05)。由此可见,2、4℃能有效地保持较高的VC含量。
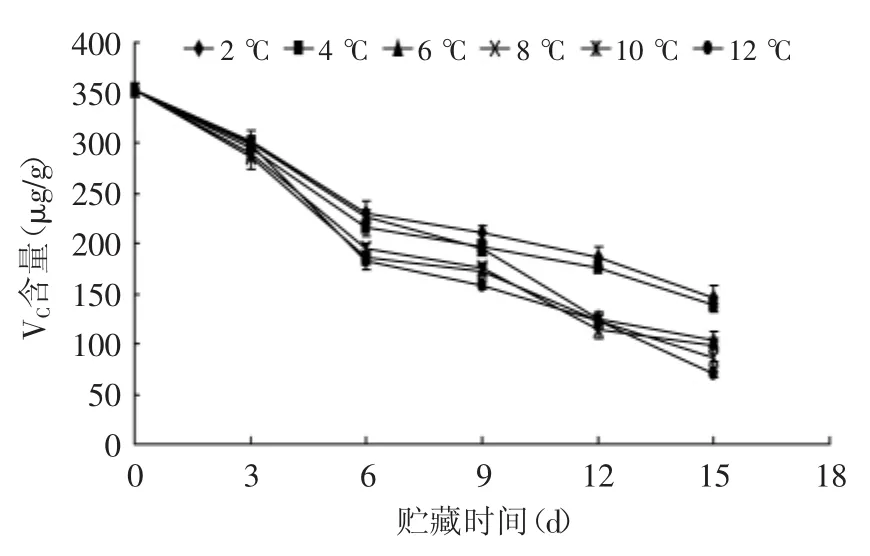
图4 不同贮藏温度对杏鲍菇VC含量的影响Fig.4 Effect of different storage temperatures on VCcontent of P.eryngii
2.5 贮藏温度对丙二醛含量的影响
MDA做为膜脂质氧化的终产物之一,因而被用来衡量脂质氧化程度的指标,其含量说明细胞膜受损伤的程度,MDA含量越大,细胞受损伤程度越大[24-25]。如图5可知,不同温度下贮藏的杏鲍菇MDA含量随着贮藏时间的延长而增加,这说明随着贮藏时间的延长,细胞膜结构的破坏程度逐渐增大,这可能是由于采后自然成熟与衰老所致[25]。在整个贮藏过程中,2、4℃下杏鲍菇MDA含量始终低于其他温度组,而彼此间没有达到显著性差异(p>0.05)。随着温度的升高,MDA含量随着贮藏时间的增加显著增加,在贮藏第15 d,2、4℃与其他温度贮藏组相比,MDA含量极显著(p<0.01)低于其他温度组。因此,2、4℃可以有效抑制杏鲍菇贮藏过程中的膜脂过氧化进程,延缓杏鲍菇的成熟与衰老。
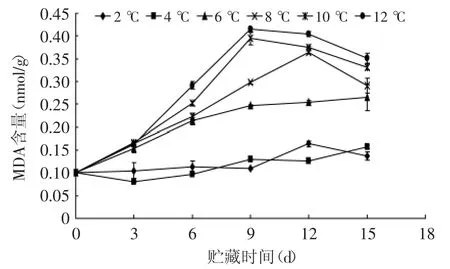
图5 不同贮藏温度对杏鲍菇丙二醛的影响Fig.5 Effect of different storage temperatures on MDA content of P.eryngii
2.6 贮藏温度对SOD活性影响
由图6可以看出,不同贮藏温度下杏鲍菇SOD活性均呈先上升后下降趋势,在贮藏前6 d,贮藏期的SOD活性均急剧上升,其中8、10、12℃SOD活性高峰出现在6 d,分别达到9.453、8.250 U·g-1和8.646 U·g-1,而2、4、6℃下贮藏的活性高峰有所推迟,且峰形相似,在9 d左右出现,其峰值为11.32、10.8 U·g-1和9.8 U·g-1。前期杏鲍菇SOD活性的上升,分析其原因可能是采后外界条件的改变,SOD被激活且活性增大以抵御外界环境对子实体产生的不良影响;SOD活性的下降可能是因为细胞内活性氧自由基的生产速率超出了子实体自身的清除速率,大量的活性氧自由基消耗SOD并抑制了SOD活性的增大。图6还可知,达到峰值后,SOD活性下降,在12~15 d下降速度变得平缓。统计分析表明,在贮藏到15 d,2、4℃杏鲍菇SOD活性显著(p<0.01)高于其他贮藏组,表明2、4℃能够有效推迟杏鲍菇SOD活性高峰,有助于保持较高的SOD活性,延缓衰老进程。
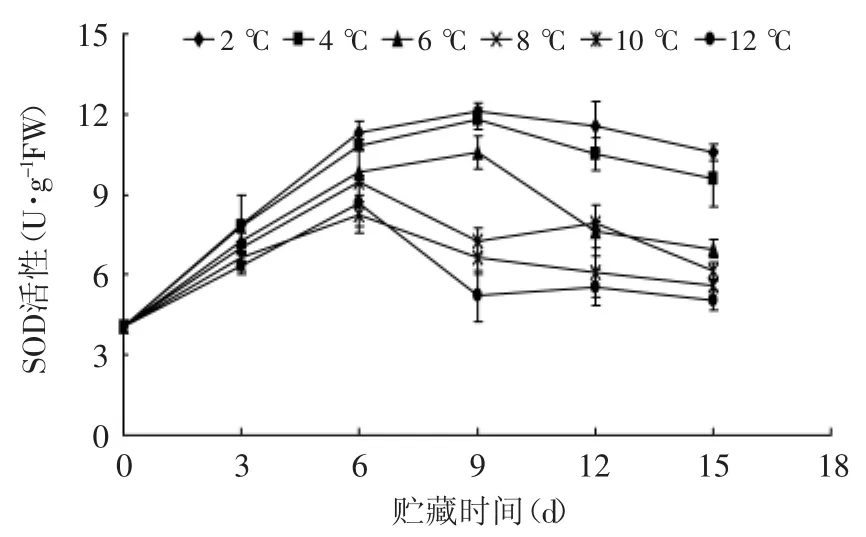
图6 不同贮藏温度对杏鲍菇SOD活性的影响Fig.6 Effect of different storage temperatures on SOD activity of P.eryngii
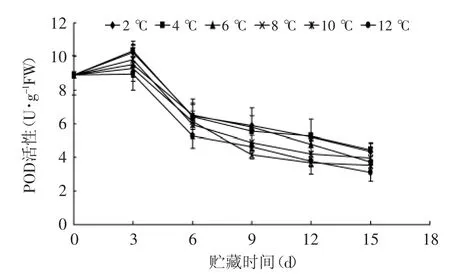
图7 不同贮藏温度对杏鲍菇POD活性的影响Fig.7 Effect of different storage temperatures on POD activity of P.eryngii
2.7 贮藏温度对POD活性的影响
由图7可知,不同贮藏温度下,杏鲍菇POD活性总体变化呈先升高后下降趋势,在贮藏初期,POD活性少量上升,这可能是抗氧化防卫反应的一种机制,POD活性升高来抵制膜结构因活性氧累积而受到的破坏,以调节氧化伤害反应,其后POD活性逐渐降低,说明其清除H2O2和O2·的作用减弱,导致活性氧的积累速率加大,促进褐变的发生。从图7还可看出,在贮藏3~6 d POD活性急剧下降,之后下降较为平缓,在第15 d时,2和4℃贮藏组显著高于12℃(p<0.05),而与6、8、10℃没有达到显著性差异。可见,2和4℃贮藏能延缓POD活性快速下降。
2.8 不同贮藏温度对PPO活性的影响
PPO是生物体内引起酶促褐变的主要酶类,其活性越大,组织的褐变速度越快,褐变程度越严重,严重影响食用菌的感官品质[24-25]。由图8可知,作为采后褐变的主导酶PPO,在不同贮藏温度下,随着贮藏时间的增加,PPO活性逐渐增强。统计分析表明,2、4℃贮藏组的PPO活性显著低于其他温度组,与6、8℃达到显著差异(p<0.05),与10、12℃达到极显著差异(p<0.01),而2℃和4℃没有显著差异。由此可知,2、4℃有效抑制了杏鲍菇的PPO活性,有利于杏鲍菇的保鲜。

图8 不同贮藏温度对杏鲍菇PPO活性的影响Fig.8 Effect of different storage temperatures on PPO activity of P.eryngii
2.9 不同贮藏温度对CAT活性影响
CAT是植物体内清除活性氧的重要保护酶之一,可催化分解组织中高浓度的H2O2,从而使H2O2控制在较低水平,降低H2O2产生的·OH对机体造成的危害,保护膜结构,延缓果蔬褐变[24-25]。如图9所示,贮藏期间不同温度下的杏鲍菇CAT活性变化趋势基本一致,均为先升后降,在贮藏6 d时达到活性高峰,这是由于贮藏初期需要CAT升高来抵制组织受到活性氧的迫害。2、4℃贮藏组CAT活性显著高于10、12℃(p<0.05),而与6、8℃没有达到显著性差异。由此可见,2、4、6、8℃可以有效延缓杏鲍菇CAT活性的降低。
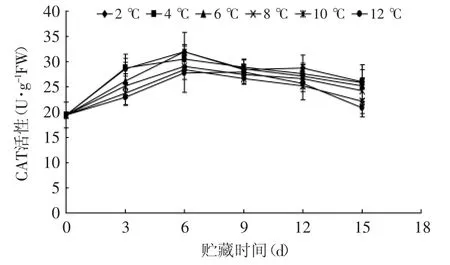
图9 不同贮藏温度对采后杏鲍菇CAT活性的影响Fig.9 Effect of different storage temperatures on CAT activity of P.eryngii
2.10 不同贮藏温度对失重率的影响
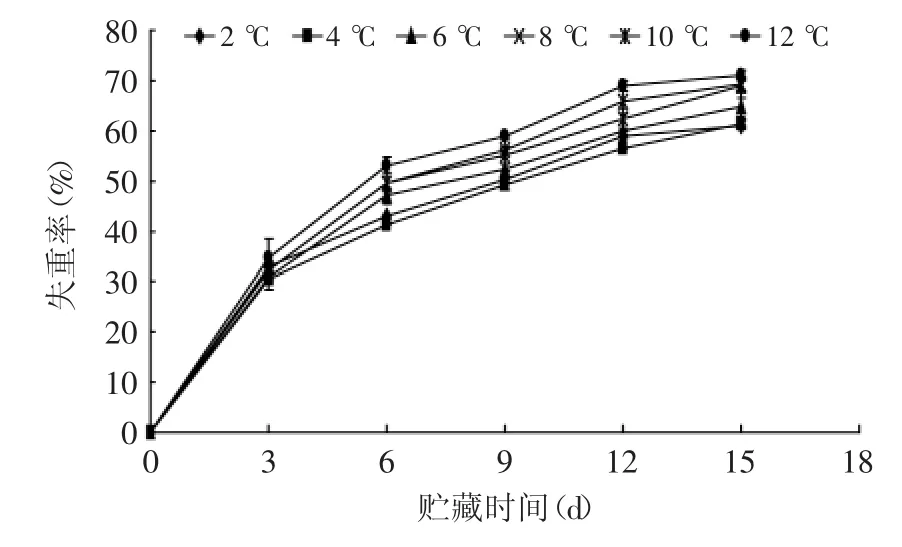
图10 不同贮藏温度对杏鲍菇失重率的影响Fig.10 Effect of different storage temperatures on weight loss of P.eryngii
如图10所示,杏鲍菇在贮藏过程中随着时间的延长各处理的失重率呈上升趋势,并且贮藏温度越高其失重率也越大。其原因是在相同的湿度条件下,水蒸汽压会随着温度的升高而增大,因此,杏鲍菇贮藏温度越高蒸腾作用就越强,失重就越严重;同时温度越高,杏鲍菇由于呼吸作用加强而引起干物质的消耗就越多。在贮藏15 d,2、4℃失重率显著低于6℃(p<0.05),极显著低于8℃(p<0.05),且2和4℃失重率相差不大,没有达到显著性差异。由此可见,2和4℃能够降低水分蒸腾速率,减轻失重率。
3 结论
通过冰点温度测定发现,-0.83℃为杏鲍菇冻害温度。贮藏温度2、4℃可以抑制杏鲍菇呼吸作用,抑制了VC含量、总糖含量、蛋白质含量快速下降和MDA含量的增加,保持较高的杏鲍菇超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性、POD活性,抑制了多酚氧化酶(PPO)活性,减少了杏鲍菇水分散失,减低了失重率,防止贮藏品质下降,延缓子实体成熟、衰老进程,达到贮藏保鲜的效果。且不会出现冻害现象。由此可见,2~4℃为最适贮藏温度。
[1]郭关英.珍稀食用菌杏鲍菇生物学特征的研究[J].福建农业学报,1998,13(3):44-49.
[2]史亚丽,杨立红,蔡德华,等.杏鲍菇多糖对力竭小鼠抗氧化、抗损伤的作用[J].体育学刊,2005,12(1):56-58.
[3]Duhost N J,Ou B,Beelman R B.Quantification of polyphenols and ergothioneine in cultivated mushrooms and correlation to total antioxidant capacity[J].Food Chemistry,2007,105(2):727-735.
[4]Mori K,Kobayashi C,Tomita T,et al.Autiatherosclerotic effect of the edible mushrooms Pleurotus eryragii(Eringi),Grif olafrondosa(Maitake),and Hypsizygus marmoreus(Bunashimeji)in apolipoprotein E-deficient mice[J].Nutrition Research,2008,28(5):335-342.
[5]孙建波,张宇.食用菌及其营养保健功效[J].中国食物与营养,2004(4):42.
[6]Carhonero E B,Gracher A H P,Smiderle F R,et al.A β-glucan from the fruit bodies of edible mushrooms Pleurotus eryragii and Pleurotus ostreatoroseus[J].Carbohydrate Polymers,2006,66(2):252-257.
[7]Ukawa Y,Ito H,Hisamatsu M.Antitumor effects of(1→3)-β-D-glucan and(1→6)-β-D-glucan purified from newly cultivated mushroom,Hatakeshimeji(Lyophyllum decastes Sing.)[J].Journal of Bioscience and Bioengineering,2000,90(1):98-104.
[8]秦俊哲,吕嘉枥.食用菌贮藏保鲜与加工新技术[M].北京:化学工业出版社:55-56.
[9]吕作舟.食用菌保鲜与加工[M].广州:广东科技出版社,2002:11-19.
[10]朱继英,王相友,许英超,等.贮藏温度对双袍蘑菇采后生理和品质的影响[J].农业机械学报,2005,36(11):92-97.
[11]赵春燕,马芳菲,冯叙桥,等.不同浓度1-MCP处理对杏鲍菇采后贮藏品质的影响[J].食品与发酵工业,2012(8):231-234.
[12]胡花丽,李鹏霞,王毓宁.不同薄膜包装对杏鲍菇采后衰老生理的影响[J].食品与发酵工业,2012(7):196-200.
[13]Li P X,Zhang X,Hu H L,et al.High carbon dioxide and low oxygen storage effects on reactive oxygen species metabolism in Pleurotus eryngii[J].Postharvest Biology and Technology,2013,85:141-146.
[14]邢淑婕,刘开华.臭氧保鲜技术在刺芹侧耳低温贮藏中的应用[J].食用菌学报,2011,18(1):53-58.
[15]Akram K,Ahn J J,Yoon S R,et al.Quality attributes of Pleurotus eryngii following gamma irradiation[J].Postharvest Biology and Technology,2012,66:42-47.
[16]陆健东,王丹凤,钱炳俊,等.短波紫外线辐照对杏鲍菇保鲜效果的研究[J].浙江农业科学,2014(3):348-351.
[17]孔芳,薛正莲,杨超英.壳聚糖复合涂膜对杏鲍菇保鲜效果的研究[J].中国农学通报,2013,29(18):215-220.
[18]许英超.双孢蘑菇气调保鲜机理的研究[D].淄博:山东理工大学,2006.
[19]曹建康,姜微波,赵玉梅,等.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[20]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1997,72(2):248-254.
[21]赵连俊,王新.水果中维生素C含量测定的研究[J].甘肃石油和化工,2008(4):47-48.
[22]王学奎.植物生理生化实验原理和技术[M].高等教育出版社,2006:172-173.
[23]黄俊丽,马海燕,陶菲,等.调控处理对3种食用菌特性酶的影响[J].食品与生物技术学报,2011,30(2):200-206.
[24]巩晋龙.杏鲍菇(Pleurotus eryngii)冷藏保鲜技术及自溶机理研究[D].福州:福建农林大学,2013.
[25]李志刚,宋婷,冯翠萍,等.不同温度对杏鲍菇减压贮藏品质的影响[J].农业工程学报,2015,31(3):332-338.
Effect of different temperatures on the storage quality of Pleurotus eryngii
XIE Li-yuan,ZHENG Lin-yong,PENG Wei-hong,TANG Jie,HUANG Zhong-qian,TAN Wei,GAN Bing-cheng*
(Institute of Soil and Fertilizer,Sichuan Academy of Agricultural Sciences,Chengdu 610066,China)
Taking Pleurotus eryngii as the material,the experiment was carried out.In the experiment,P.eryngii was stored in 2,4,6,8,10 and 12℃.The effects of different storage temperatures on postharvest physiology and quality of P.eryngii were studied under different storage temperatures.The results showed that P.eryngii stored at 2 and 4℃preferably maintained the activities of superoxide dismutase(SOD)(p<0.01)and catalase(CAT)(p<0.05),inhibited effectively the rapid erosion of protein,VCand total sugar,and rapid increasing of malondialdehyde(MDA)(p<0.01),reduced effectively the activity of polyphenol oxidase(PPO)(p<0.05),and delayed quality deterioration and aging process.Thus,2~4℃ was suitable for storage of P.eryngii,which provide a theoretical basis for the storage and preservation.
Pleurotus eryngii;storage temperature;postharvest physiology;quality
TS255.3
A
1002-0306(2015)22-0334-06
10.13386/j.issn1002-0306.2015.22.060
2015-03-01
谢丽源(1977-),女,博士,副研究员,研究方向:农产品加工,E-mail:xieliyuan77@163.com。
*通讯作者:甘炳成(1968-),男,硕士,研究员,研究方向:食用菌贮藏加工,E-mail:bgan918@sohu.com。
国家科技支撑计划课题(2013BAD16B00)。
