祁门红茶多酚提取工艺优化及其组成鉴定
2015-04-24安晓婷谢小花肖陆飞
安晓婷,陈 静,谢小花,肖陆飞
(滁州职业技术学院食品与环境工程系,安徽滁州239000)
祁门红茶多酚提取工艺优化及其组成鉴定
安晓婷,陈 静,谢小花,肖陆飞*
(滁州职业技术学院食品与环境工程系,安徽滁州239000)
以祁门红茶为原料,优化了红茶多酚提取的工艺条件。通过单因素实验考察乙醇体积分数、提取温度、提取时间、料液比、pH对红茶多酚提取率的影响,并进一步采用正交实验优化提取工艺,得到最佳工艺为:乙醇体积分数60%,提取温度70℃,提取时间2.5 h,料液比1∶50(g/mL),pH4。在此工艺下,提取两次后红茶多酚提取率为(214.23± 6.29)mg/g。采用UPLC-DAD鉴定祁门红茶的多酚组成,结果表明,祁门红茶多酚的主要成分为没食子酸、没食子儿茶素、表儿茶素、表没食子儿茶素没食子酸酯、表儿茶素没食子酸酯、儿茶素没食子酸酯、茶黄素、茶黄素-3-没食子酸酯、茶黄素-3′-没食子酸酯和茶黄素双没食子酸酯。
祁门红茶,多酚,提取工艺,儿茶素,茶黄素
茶叶中富含茶多酚,茶多酚是天然抗氧化剂,具有重要的生物活性,它赋予了茶叶独特的保健和药用价值[1]。红茶为全发酵茶,发酵度约为80%~90%。红茶在发酵过程中,儿茶素在酶促氧化和非酶促氧化的作用下聚合成一系列有色化合物,如茶黄素、茶红素、茶褐素等[2]。因此,与绿茶相比,红茶的儿茶素含量相对较低。研究证明,作为儿茶素的主要氧化产物,茶黄素和茶红素的生物活性并未降低,其仍然具有良好的抗氧化活性[3]。另有研究指出,茶黄素甚至比儿茶素表现出强的抗肿瘤、抗菌活性[4-5]。因此,除儿茶素外,茶黄素也是红茶中的重要生物活性成分。
随着人们健康观念的增强,作为我国消费量最大的茶类之一,红茶多酚的生物学功能受到越来越广泛的关注。提取是制备红茶多酚的第一步,目前,学者多采用浸提法和超声波辅助提取法提取红茶多酚。刘萍等优化了滇红红茶多酚的浸提工艺,得到最佳工艺参数为固液比1∶50,乙醇体积分数60%,浸提温度50℃,浸提时间30 min,在此条件下,红茶多酚提取率为20.35%[6]。刘慧娟等通过正交实验得到英德红茶茶多酚提取最佳工艺条件为固液比1∶50,pH5.0,浸提温度90℃,浸提时间10 min,此时红茶多酚提取率为13.8%[7]。唐淯桓等通过响应面实验优化了日照红茶多酚的超声提取工艺,得到最佳工艺为超声时间80 min,乙醇体积分数88.99%,静止萃取时间89.97 min,超声温度80℃,在此工艺下,红茶多酚提取率高达73.5%[8]。
作为世界四大红茶品种之一,祁门红茶多酚的提取工艺少见报道。本文通过正交实验优化了祁门红茶多酚的提取工艺,并通过超高液相色谱(UPLC)分析其多酚组成,为开发和利用祁门红茶多酚资源提供理论基础。
1 材料与方法
1.1 材料与仪器
祁门红茶(小种红茶) 于2014年3月底采自安徽省芜湖市三山区峨桥镇茶厂,购自安徽省东吴茶叶有限公司;没食子酸(Gallic acid,GA)、没食子儿茶素((-)-Gallocatechin,GC)、表没食子儿茶素((-)-Epigallocatechin,EGC)、儿茶素((+)-Catechin,C)、表儿茶素((-)-Epicatechin,EC)、表没食子儿茶素没食子酸酯((-)-Epigallocatechin gallate,EGCG)、没食子儿茶素没食子酸酯((-)-Gallocatechin gallate,GCG),表儿茶素没食子酸酯((-)-Epicatechin gallate,ECG)和儿茶素没食子酸酯((-)-Catechin gallate,CG)、茶黄素(Theaflavin,TF1)、茶黄素-3-没食子酸酯(Theaflavin 3-gallate,TF3G)、茶黄素-3′-没食子酸酯(Theaflavin 3’-gallate,TF3′G)和茶黄素双没食子酸酯(Theaflavin 3,3’-digallate,TF33′G)等13种茶多酚标品 均购自美国Sigma-Aldrich;咖啡因(Caffeine)和Folin-Ciocalteu试剂 购自阿拉丁试剂(上海)有限公司;其余试剂 均为国产分析纯。
Agilent 1290 Infinity LC超高液相色谱仪 美国Agilent公司;52S紫外可见分光光度计 上海棱光技术有限公司;THZ-Q台式冷冻恒温振荡器 太仓市华美生化仪器厂;DD-5M湘仪离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 多酚含量的测定 根据Folin-Ciocalteu法[9]测定提取液中的多酚含量。用80%乙醇配制质量浓度分别为0.02、0.04、0.06、0.08、0.1 mg/mL的没食子酸溶液。各取200 μL不同质量浓度没食子酸溶液,加入2 mL Folin-Ciocalteu试剂混匀,静置4 min后,加入2 mL 75 mg/mL的碳酸钠溶液,暗处反应2 h,测定760 nm处吸光度值。得到标准曲线方程为:Y= 6.9779X+0.0237,R2=0.9997,其中X为没食子酸浓度(mg/mL),Y为760 nm处的吸光度。精确移取用80%乙醇适当稀释后的红茶提取液200 μL,按照上述步骤显色,根据标准曲线计算多酚质量浓度,并进一步计算多酚提取率。
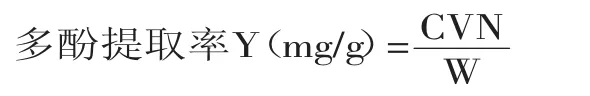
式中:C为根据标准曲线计算出提取液中多酚浓度/(mg/mL);V为提取液液体积/mL;N为稀释倍数;W为红茶质量/g。
1.2.2 单因素实验
1.2.2.1 乙醇体积分数对红茶多酚提取率的影响 称取1.0 g祁门红茶,按料液比1∶30(g/mL)加入pH=4的不同体积分数(40%、50%、60%、70%、80%、90%、100%)的乙醇溶液,60℃下振荡提取1 h,提取液在5000 r/min下离心10 min。取上清液在100 mL棕色容量瓶中定容,适当稀释后取200 μL按照方法1.2.1显色,计算多酚提取率Y。
1.2.2.2 提取温度对红茶多酚提取率的影响 称取1.0 g祁门红茶,按料液比1∶30(g/mL)加入pH=4,体积分数60%的乙醇溶液,分别在不同温度下(30、40、50、60、70、80℃)下振荡提取1 h,提取液在5000 r/min下离心10 min。取上清液在100 mL棕色容量瓶中定容,适当稀释后取200 μL按照方法1.2.1显色,计算多酚提取率Y。
1.2.2.3 提取时间对红茶多酚提取率的影响 称取1.0 g祁门红茶,按料液比1∶30(g/mL)加入pH=4,体积分数60%的乙醇溶液,分别在70℃下振荡提取0.5、1、1.5、2、2.5、3 h,提取液在5000 r/min下离心10 min。取上清液在100 mL棕色容量瓶中定容,适当稀释后取200 μL按照方法1.2.1显色,计算多酚提取率Y。
1.2.2.4 料液比对红茶多酚提取率的影响 称取1.0 g祁门红茶,分别按料液比1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)加入pH=4,体积分数60%的乙醇溶液,在70℃下振荡提取2 h,提取液在5000 r/min下离心10 min。取上清液在100 mL棕色容量瓶中定容,适当稀释后取200 μL按照方法1.2.1显色,计算多酚提取率Y。
1.2.2.5 pH对红茶多酚提取率的影响 称取1.0 g祁门红茶,按料液比1∶40(g/mL)加入不同pH(2、3、4、5、6、7、8)、体积分数60%的乙醇溶液,分别在70℃下振荡提取2 h,提取液在5000 r/min下离心10 min。取上清液在100 mL棕色容量瓶中定容,适当稀释后取200 μL按照方法1.2.1显色,计算多酚提取率Y。
1.2.3 正交实验 根据单因素实验结果,选择乙醇体积分数、提取温度、提取时间、料液比等4个对红茶多酚提取率有显著影响的因素进行L9(34)正交实验,正交实验因素水平见表1。
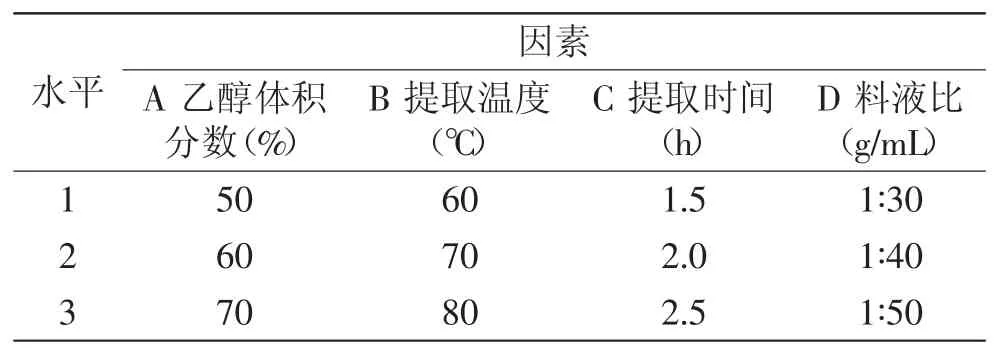
表1 正交实验因素水平Table 1 Factors and levels of orthogonal design
1.2.4 提取次数对红茶多酚提取率的影响 称取1.0 g祁门红茶,按照正交实验优化工艺,分别提取1、2、3、4次,合并提取液在5000 r/min下离心10 min。取上清液在250 mL棕色容量瓶中定容,适当稀释后取200 μL按照方法1.2.1显色,计算多酚提取率Y。
1.2.5 UPLC-DAD条件 采用UPLC-DAD检测祁门红茶多酚提取液中咖啡因、没食子酸、儿茶素和茶黄素。色谱柱:Zorbax SB-C18反相色谱柱(4.6 mm× 250 mm,5 μm),美国Agilent公司。以含0.1%甲酸的水溶液为流动相A,含0.1%甲酸的乙腈溶液为流动相B,流速0.4 mL/min,柱温为30℃,进样量为2.5 μL。按照如下梯度洗脱:0~5 min,2%~10%B;5~8 min,10%~15%B;8~15 min,15%~50%B;15~20 min,50%~70%B;20~25 min,70%~85%B;25~35 min,85%B;Post Run 5 min。采用DAD检测器,检测波长为278 nm。混合标准品Caffeine、GA、GC、EGC、C、EC、EGCG、GCG、ECG、CG、TF1、TF3G、TF3′G、TF33′G和红茶多酚提取液适当稀释后过0.22 μm滤膜后上样检测。
1.2.6 数据处理 使用SPSS 14.0软件,采用ANOVA法进行显著性检验。选取p<0.05为显著水平。
2 结果与分析
2.1 单因素实验
2.1.1 乙醇体积分数对红茶多酚提取率的影响 从图1可以看出,在乙醇体积分数在40%~60%之间时,多酚提取率随着乙醇体积分数的增加而提高,在60%时,红茶多酚提取率达到最高值,为(180.07± 3.51)mg/g。进一步提高乙醇浓度,多酚提取率显著降低。采用纯乙醇为溶剂时提取率最低,为(110.6± 7.57)mg/g。乙醇的体积分数对黄酮、原花青素、花色苷[10-12]等多酚化合物具有重要影响。适当的乙醇体积分数可以改善提取溶剂的极性,有利于多酚的浸出。多酚在植物细胞内经常通过氢键与蛋白质、纤维素等结合在一起,当乙醇体积分数过低,溶剂破坏氢键的能力低,导致提取率下降[13]。而乙醇体积分数过高,提取溶剂极性太小,也不利用多酚化合物的浸出。
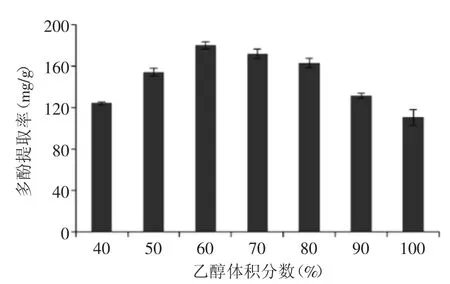
图1 乙醇体积分数对红茶多酚提取率的影响Fig.1 Effect of ethanol concentration on the extraction efficiency of black tea polyphenols
2.1.2 提取温度对红茶多酚提取率的影响 提取温度对红茶多酚提取率的影响由图2所示,当提取温度在30~70℃之间时,多酚提取率随提取温度的升高显著增加,当温度高于70℃时,多酚提取率随提取温度的升高略有下降。适宜的高温可以使分子运动加剧,加快红茶多酚的渗透、溶解和扩散速度[14],而过高的温度会引起多酚化合物一系列的氧化、降解反应,从而降低多酚提取率。因此,选择70℃为最佳提取温度。

图2 提取温度对红茶多酚提取率的影响Fig.2 Effect of temperature on the extraction efficiency of black tea polyphenols
2.1.3 提取时间对红茶多酚提取率的影响 从图3可以看出,在2 h内,多酚提取率随时间增加而增加,在2 h时达到最高值,为(210.80±7.50)mg/g。继续延长提取时间至2.5 h,多酚提取率无明显变化。当提取时间为3 h时,多酚提取率降至(199.81±3.38)mg/g。在提取过程中,茶多酚在高温条件下与氧气的接触,过长的提取时间加剧了茶多酚的氧化、降解[15],反而不利用多酚提取。
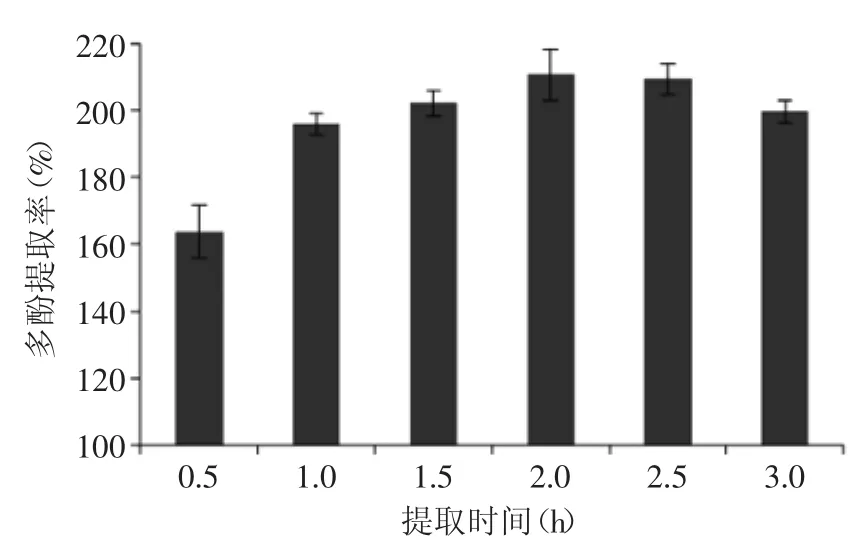
图3 提取时间对红茶多酚提取率的影响Fig.3 Effect of time on the extraction efficiency of black tea polyphenols

图4 料液比对红茶多酚提取率的影响Fig.4 Effect of solid-to-liquid ratio on the extraction efficiency of black tea polyphenols
2.1.4 料液比对红茶多酚提取率的影响 从图4可以看出,当料液比在1∶10~1∶40之间时,多酚提取率随着提取溶剂体积的增加而显著提高。继续增加溶剂的用量对多酚提取率无显著影响,而溶剂用量过多会造成资源浪费且不利用后续的分离纯化工作,因此选择最佳料液比为1∶40(g/mL)。
2.1.5 pH对提取率的影响 儿茶素是红茶多酚的重要组成成分,儿茶素特别是EGCG对碱性条件敏感。在碱性条件下,儿茶素分子中酚羟基电离,易发生氧化反应[16],导致多酚提取率的下降。如图5所示,在酸性提取溶剂(pH2~6)中,红茶多酚提取率均较高且差异不明显,pH4时提取率最高,为(209.23±2.61)mg/g。而在中性(pH7)和碱性提取溶剂(pH8)中,红茶多酚提取率相对于酸性提取溶剂显著下降。因此,选择pH4为提取溶剂最佳pH。

图5 pH对红茶多酚提取率的影响Fig.5 Effect of pH on the extraction efficiency of black tea polyphenols
2.2 正交实验优化红茶多酚提取工艺
在单因素实验的基础上,选取对红茶多酚提取率影响较大的四个因素,即乙醇体积分数、提取温度、提取时间、料液比,按照表1中因素水平,采用L9(34)正交实验优化红茶多酚提取工艺。由表2可知,各因素对实验影响大小的顺序为A(乙醇体积分数)>B(提取温度)>C(提取时间)>D(料液比)。红茶多酚的最佳提取工艺组合为A2B2C3D3,即乙醇体积分数60%,提取温度70℃,提取时间2.5 h,料液比1∶50(g/mL)。方差分析(表3)表明,乙醇体积分数对红茶多酚提取率影响极显著(p<0.01),提取温度和提取时间对红茶多酚提取率影响显著(p<0.05),而料液比对红茶多酚提取率影响不显著。
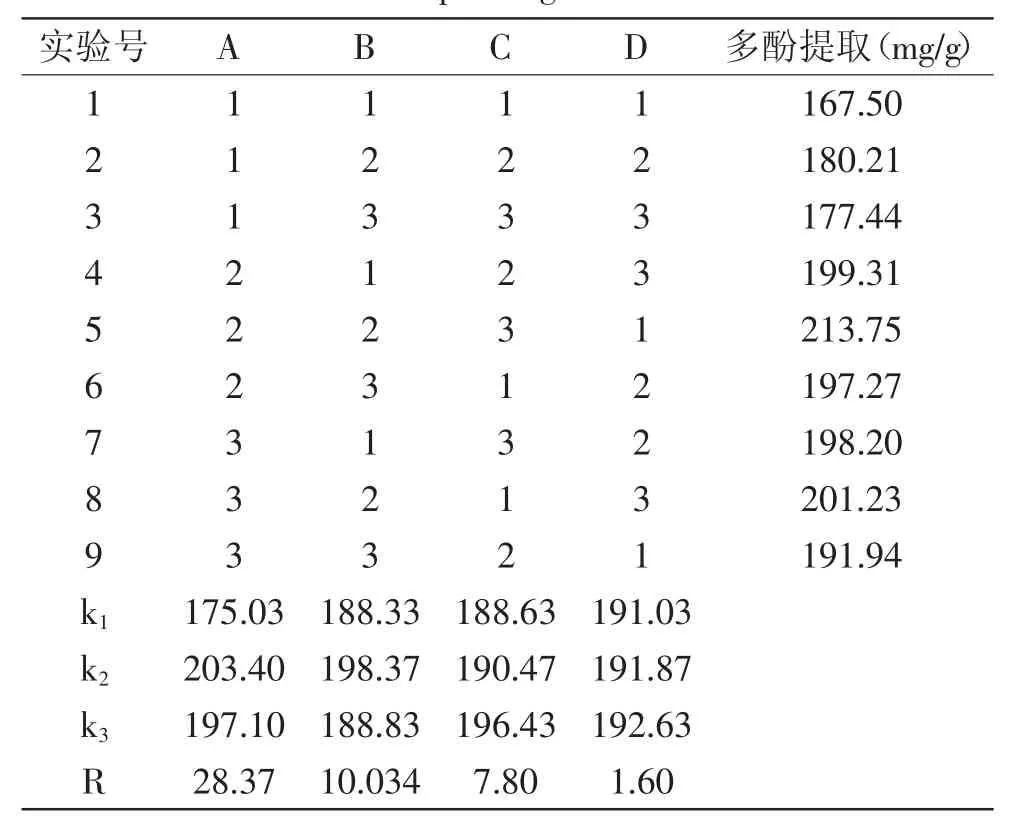
表2 红茶多酚提取工艺正交实验优化设计及结果Table 2 Orthogonal array design arrangement and corresponding results
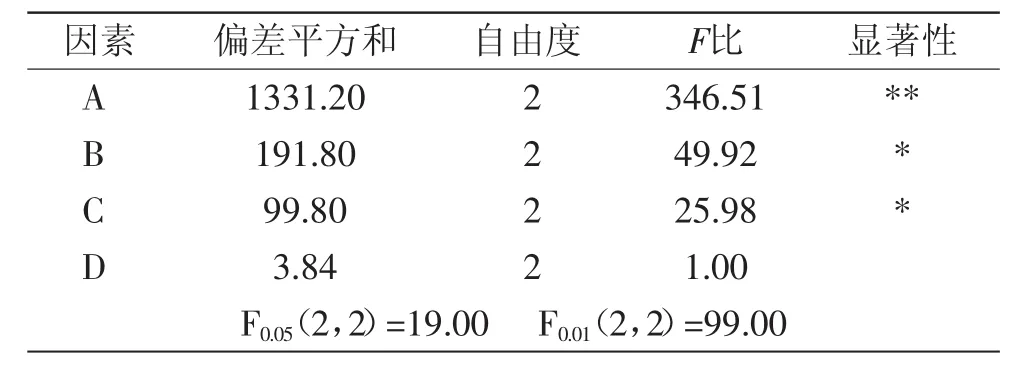
表3 正交实验方差分析Table 3 Variance analysis of orthogonal array design
依照上述优化的工艺条件进行3次平行实验,得到平均多酚提取率为(214.23±6.29)mg/g。结果表明,采用该工艺提取红茶多酚提取率高且稳定性好。
2.3 提取次数对红茶多酚提取率的影响
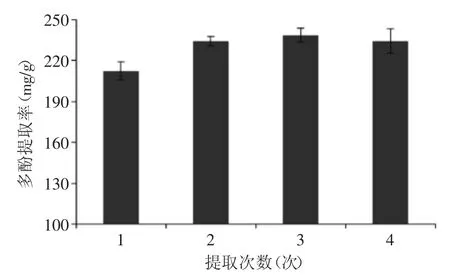
图6 提取次数对红茶多酚提取率的影响Fig.6 Effect of number of extractions on the extraction efficiency of black tea polyphenols
从图6可知,相对于提取1次,提取2次可以显著提高红茶多酚提取率。2次提取后多酚提取率为(234.78±3.36)mg/g,继续增加提取次数,对红茶多酚提取率无显著影响,因此选择最佳提取次数为2次。
2.4 UPLC分析红茶多酚组成
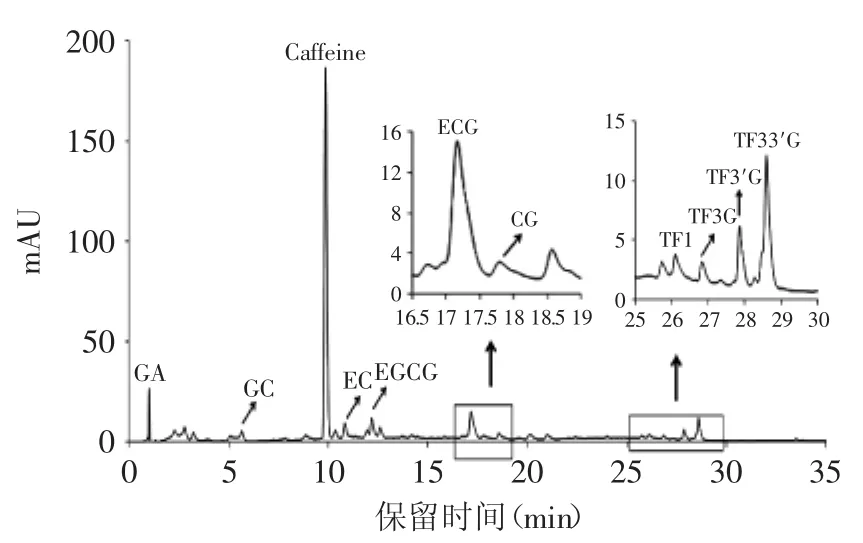
图7 祁门红茶多酚UPLC图谱Fig.7 UPLC chromatograms of keemun black tea polyphenols
如图7所示,祁门红茶多酚在UPLC中得到快速、精确的分离。通过与混合标准品图谱比对,共有11种化合物得到鉴定。按照保留时间顺序,依次为没食子酸(GA)、没食子儿茶素(GC)、咖啡因(Caffeine)、表儿茶素(EC)、表没食子儿儿茶素没食子酸酯(EGCG)、儿茶素没食子酸酯(CG)、茶黄素(TF1)、茶黄素-3-没食子酸酯(TF3G)、茶黄素-3′-没食子酸酯(TF3′G)和茶黄素双没食子酸酯(TF33′G)。
绿茶为未发酵茶,茶黄素含量甚微。而红茶为全发酵茶,在发酵过程中,儿茶素在酶促氧化和非酶促氧化的作用下生成茶黄素等聚合物[17],因此红茶中茶黄素含量显著高于绿茶。如图7所示,祁门红茶中四种茶黄素单体(TF1、TF3G、TF3′、TF33′G)含量较高。发酵同时造成了儿茶素的损失,因此红茶儿茶素含量低于绿茶。祁门红茶中只检测到GC、EC、EGCG、ECG、CG等5种儿茶素单体(图7),而另外3种绿茶中常见的儿茶素单体如C、EGC、GCG等未得到鉴定。
3 结论
在单因素实验的基础之上,通过正交实验优化了祁门红茶多酚提取工艺,得到最佳工艺参数为:乙醇体积分数60%,提取温度70℃,提取时间2.5 h,料液比1∶50(g/mL),pH4,提取2次。在此条件下,红茶多酚的提取率为(214.23±6.29)mg/mL。通过UPLC进一步鉴定了祁门红茶多酚主要组成为没食子酸(GA)、5种儿茶素单体(GC、EC、EGCG、ECG、CG)和4种茶黄素单体(TF1、TF3G、TF3′、TF33′G)。
[1]Higdon J V,Frei B.Tea catechins and polyphenols:health effects,metabolism,and antioxidant functions[J].Critical Reviews in Food Science and Nutrition,2003,43(1):89-143.
[2]屠幼英,杨子银,东方.红茶中多酚类物质的抗氧化机制及其构效关系[J].中草药,2007,38(10):1581-1585.
[3]Łuczaj W,Skrzydlewska E.Antioxidative properties of black tea[J].Preventive Medicine,2005,40(6):910-918.
[4]Tu Y Y,Tang A B,Watanabe N.The theaflavin monomers inhibit the cancer cells growth in vitro[J].Acta Biochimica et Biophysica Sinica,2004,36(7):508-512.
[5]Zhu Y,Huang H,Tu Y.A review of recent studies in China on the possible beneficial health effects of tea[J].International Journal of Food Science&Technology,2006,41(4):333-340.
[6]刘萍.红茶和绿茶中茶多酚提取工艺研究[J].天津农学院学报,2010,17(4):39-43.
[7]刘慧娟,黎海彬,赖键.红茶中茶多酚提取工艺的研究[J].广州城市职业学院学报,2011,5(2):56-59.
[8]唐淯桓,梁青,邹佳佳,等.日照红茶酚类超声波辅助提取工艺的响应面优化[J].安徽农业科学,2013,40(33):16350-16352.
[9]Singleton V L,Orthofer R,Lamuela-Raventos R M,et al. Analysis of total phenols and other oxidation substracts and antioxidants by mean of Folin-Ciocalteu reagent[J].Meth Enaymol,1999,299(8):152-178.
[10]高岐,刘宏文.洋葱中总黄酮的微波提取法[J].食品工业科技,2008,29(1):218-219.
[11]张镜,何洪洛.正交实验优化大叶榕果实原花青素提取工艺[J].食品科学,2015,36(2):41-45.
[12]孟宪军,王冠群,宋德群,等.响应面法优化蓝莓花色苷提取工艺的研究[J].食品工业科技,2010,31(7):226-229.
[13]冯进,曾晓雄,李春阳.响应面法优化蓝莓叶多酚提取工艺[J].食品科学,2013,34(4):59-64.
[14]刘学,邱香,王哲,等.脱脂月见草子中多酚的提取分离及其抗氧化活性研究[J].食品工业科技,2014,35(24):299-303.
[15]安晓婷,王兴娜,周涛,等.响应曲面法优化蓝莓渣多酚提取工艺[J].食品工业科技,2012,33(15):269-273.
[16]Dube A,Ng K,Nicolazzo J A,et al.Effective use of reducing agents and nanoparticle encapsulation in stabilizing catechins in alkaline solution[J].Food Chemistry,2010,122(3):662-667.
[17]Sang S,Lambert J D,Tian S,et al.Enzymatic synthesis of tea theaflavin derivatives and their anti-inflammatory and cytotoxic activities[J].Bioorganic&Medicinal Chemistry,2004,12(2):459-467.
Optimization of extraction technology of keemun black tea polyphenols and its composition identification
AN Xiao-ting,CHEN Jing,XIE Xiao-hua,XIAO Lu-fei*
(Department of Food and Environmental Engineering,Chuzhou Vocational and Technical College,Chuzhou 239000,China)
The extraction technology of black tea polyphenols was optimized using keemun black tea as material. The effect of ethanol concentration,extraction temperature,extraction time,solid-liquid ratio,pH on extraction yield was investigated by single-factor experiment and the extraction technology was further optimized by orthogonal experiment.The optimum extraction parameters were as follows:ethanol concentration 60%,extraction temperature 70℃,extraction time 2.5 h,and solid-liquid ratio 1∶50(g/mL).The extraction yield was(214.23±6.29)mg/g after the second extraction.In addition,UPLC-DAD was applied to identify keemun black tea polyphenols.Results showed that the main components of keemun black tea polyphenols were gallic acid,(-)-Gallocatechin(GC),(-)-Epicatechin(EC),(-)-Catechin gallate(CG),(-)-Epicatechin gallate(ECG),(-)-Epigallocatechin gallate(EGCG),Theaflavin(TF1),Theaflavin 3-gallate(TF3G),Theaflavin 3’-gallate(TF3′G)and Theaflavin 3,3’-digallate(TF33′G).
keemun black tea;polyphenols;extraction technology;catechin;theaflavin
TS207.3
B
1002-0306(2015)22-0231-05
10.13386/j.issn1002-0306.2015.22.040
2015-03-01
安晓婷(1986-),女,硕士,助教,研究方向:营养与功能因子,E-mail:anxiaotin@163.com。
*通讯作者:肖陆飞(1976-),男,博士,副教授,研究方向:有机合成,E-mail:foodjys@126.com。
安徽省卓越人才培养计划(2013zjjh051);安徽省省级示范实验实训中心建设项目(20101427)。
