生物刺激与生物强化联合修复柴油污染土壤
2015-04-24高闯,张全
高 闯,张 全
(1. 辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001;2. 中国石化 抚顺石油化工研究院,辽宁 抚顺 113001)
生物刺激与生物强化联合修复柴油污染土壤
高 闯1,2,张 全2
(1. 辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001;2. 中国石化 抚顺石油化工研究院,辽宁 抚顺 113001)
从柴油污染土壤中筛选分离出一株高效降解柴油的菌株CY-1,考察了自然衰减修复、生物刺激修复、生物强化修复以及生物刺激-生物强化联合修复等4种修复方法对土壤中柴油的降解能力及降解过程中几种土壤微生物酶活性的变化。实验结果表明:该菌为假单胞菌属;采用生物刺激-生物强化联合修复初始柴油质量分数为2.70%的柴油污染土壤,经过31 d的降解,柴油质量分数降至1.09%,柴油去除率达59.6%;经生物刺激-生物强化联合修复,土壤脱氢酶活性和荧光素二乙酸酯水解酶活性最高;通过生物刺激处理可使土壤脲酶活性和磷酸酶活性达到最高。
柴油污染土壤;生物修复;生物刺激;生物强化;酶活性
柴油进入土壤后会影响土壤的生态循环能力[1],暴露于环境中还会对人类身体健康造成危害[2-3]。土壤生物修复技术是美国环境总署推荐的优选土壤修复技术之一。目前,单纯针对柴油开展的生物刺激研究较少,大部分生物刺激的研究是关于石油降解方面的。Diaz-Martinez等[4]研究了生物刺激、生物强化以及植物联合修复柴油污染土壤的过程,实验结果表明,合适的添加剂能刺激接种菌的生长,提高植物修复效率。Dias等[5]对南极洲的柴油污染土壤进行了生物刺激原位修复的研究,45 d内柴油降解率可达49%。Zhang等[6]从原油污染土壤中获得了两株能以柴油为唯一碳源生长的菌株,降解15 d后,柴油降解率达70%。
本工作从柴油污染土壤中筛选、分离出一株高效降解柴油的菌株CY-1,考察了自然衰减修复、生物刺激修复、生物强化修复以及生物刺激与生物强化相结合的联合修复等方法对柴油污染土壤的修复过程,对比了不同修复方法的柴油降解效果及土壤酶活,为修复过程的强化提供了依据。
1 实验部分
1.1 试剂、材料和仪器
丙酮、正己烷:分析纯。
土样:取自某市加油站附近的柴油污染土壤,柴油质量分数为2.70%;0#柴油:购自中国石化加油站。
土壤营养液:以KH2PO4和NH4NO3配制,加入后使土壤中的n(C)∶n(N)∶n(P)= 100∶1.25∶1。
LB培养基:蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g,蒸馏水1 000 mL,pH=7.0,121 ℃灭菌15 min,保存备用。
无机盐培养基:KH2PO41.0 g,K2HPO41.0 g,NH4NO31.0 g,MgSO40.5 g,CaCl20.01 g,FeSO4·7H2O 0.1 g,蒸馏水1 000 mL,pH=7.0,121 ℃灭菌15 min,保存备用。
在上述培养基中分别加入质量分数为2%的琼脂,即得相应的固体培养基。
6010型紫外-可见分光光度计:惠普公司;GC-2010型气相色谱仪:日本岛津公司;CEM型微波萃取仪:美国培安公司。
1.2 柴油降解菌的筛选及鉴定
向10 g柴油污染土壤中加入100 mL灭菌后的生理盐水,在温度为30 ℃、转速为170 r/min的条件下振荡培养24 h。加入经孔径为0.22 μm的微孔滤膜过滤灭菌的柴油3 mL,再放入培养箱中培养。每天加入灭菌柴油并持续培养3 d。将获得的泥浆用灭菌生理盐水逐级稀释,吸取0.1 mL涂布在LB固体培养基平板上,在培养箱内恒温培养24 h,利用平板划线法分离单菌落。
将各纯化后的菌株分别接种于含有质量分数为3%的过滤灭菌柴油的30 mL无机盐培养基中,在温度为30 ℃、转速为170 r/min的条件下振荡培养,观察其生长情况。将生长情况良好的菌株制备成菌悬液。用生理盐水重悬浮并调节菌悬液浓度,使其在600 nm处的吸光度(OD600)为1.0。
在80 cm2×20 cm的桶内装入300 g柴油质量分数为2.70%的污染土壤,控制土床高度约为5 cm。在桶内添加10 mL菌悬液。将加入不同菌液的土壤试样置于培养箱中,在温度为25 ℃的条件下进行培养,10 d后取样测定土壤中柴油含量,观察比较降解效果。
菌株的鉴定工作委托中美泰和生物技术(北京)有限公司完成。
1.3 柴油污染土壤的修复
实验设置自然衰减组、生物刺激组、生物强化组以及生物刺激-生物强化组等4组土壤试样,各组的修复方法见表1。将柴油污染土壤分别按照表1中的4种方法处理后,置于25 ℃培养箱中,过夜后作为实验起始点,每天翻动土壤并加入去离子水使土壤中的水质量分数为20%±2%。

表1 土壤试样的修复方法
1.4 分析方法
1.4.1 菌浓度的测定
以细菌培养液的OD600值表征培养液中的菌浓度。
1.4.2 柴油质量分数的测定
以体积比为1∶1的丙酮和正己烷混合溶液作为萃取剂,采用微波萃取仪萃取土壤中的柴油。用气相色谱仪测定萃取剂中的柴油质量分数,计算得到土壤中的柴油质量分数。气相色谱条件:进样口温度300 ℃,检测器温度300 ℃,色谱柱规格30 m×0.53 mm,柱温40 ℃保持2 min,以15 ℃/ min的速率梯度升温至290 ℃,保持3 min,进样量1 μL。
1.4.3 土壤酶活的测定
1.4.3.1 土壤脱氢酶活性的测定
通过测定土壤中微生物的脱氢酶活性以确定微生物对有机污染物的氧化分解能力,具体方法见文献[7],以反应液于486 nm处的吸光度(OD486)表征土壤的脱氢酶活性。
1.4.3.2 土壤荧光素二乙酸酯水解酶活性的测定
通过荧光素二乙酸酯(FDA)水解酶活性表征微生物活性的方法已逐步应用到植物残体、土壤、河底沉积物、活性污泥以及深海底泥的微生物活性分析中。具体方法见文献[8],以反应液于490 nm处的吸光度(OD490)表征土壤FDA水解酶的活性。
1.4.3.3 土壤脲酶活性的测定
在土壤的氮素循环中,脲酶是唯一的底物为尿素的酶类,属于氮素转化以及循环中最重要的酶类。通过测定脲酶活性可以定量评价土壤肥力的高低。测定方法:将2 g风干土壤置于50 mL离心管中,加入600 μL甲苯,完全润湿土壤,静置15 min。然后加入2 mL质量分数为10%的尿素溶液和4 mL pH=6.7的柠檬酸缓冲液,摇匀。在培养箱中于温度37 ℃、转速145 r/min条件下振荡反应24 h。反应结束后加入38 ℃热水至20 mL,振荡后经孔径为0.45 μm的微孔滤膜过滤。取1 mL滤液至25 mL定容管中,加入少许去离子水,并加入4 mL苯酚钠溶液和3 mL次氯酸钠溶液,充分摇均。静置20 min后,溶液变为靛酚蓝色,加水至刻度,混匀后测定溶液在578 nm处的吸光度(OD578),以此表征土壤脲酶的活性。
1.4.3.4 土壤磷酸酶活性的测定
磷酸酶属于生物界广泛存在的酶类,能参与土壤中无机磷的释放循环,并能催化磷酸单酯键的水解,在磷素循环中发挥着重要作用。具体测定方法见文献[9],以反应液于510 nm处的吸光度(OD510)表征土壤磷酸酶的活性。
2 结果与讨论
2.1 柴油降解菌的筛选及鉴定
经过富集培养,在LB固体培养基平板上得到6株能以柴油为碳源生长的菌株,分别命名为CY-1~6。6株菌的生长曲线见图1。由图1可见,菌株CY-3生长情况最好,而菌株CY-2和CY-6生长情况较差。因此,选择菌株CY-1,CY-3,CY-4,CY-5进行柴油降解实验。

图1 6株菌的生长曲线
加菌10 d后土壤中的柴油质量分数见图2。由图2可见,经过10 d的生物强化处理,添加CY-1菌液的土壤的柴油质量分数最低,为1.56%。结合图1和图2的结果,选择菌株CY-1作为高效柴油降解菌。
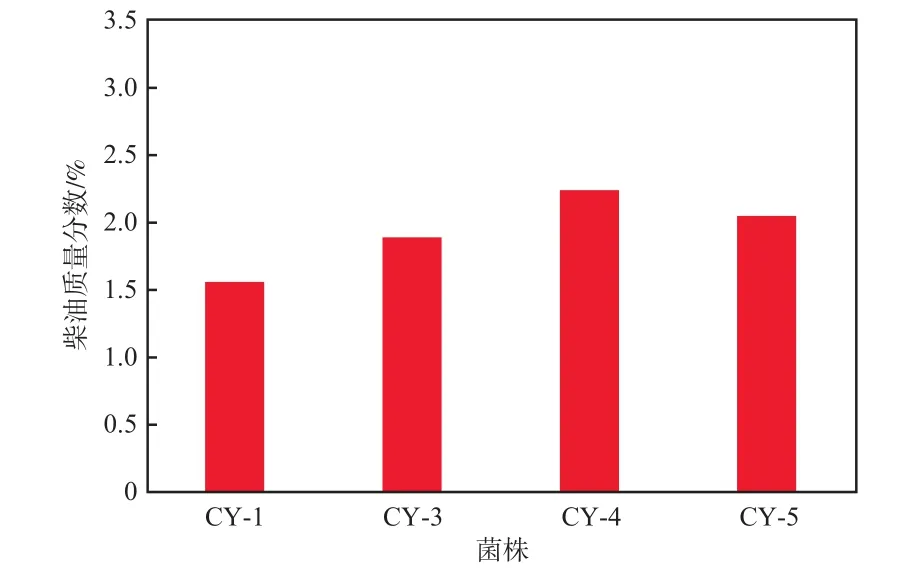
图2 加菌10 d后土壤中的柴油质量分数
经16S rDNA基因序列鉴定CY-1为假单胞菌属。革兰氏染色实验发现该菌为革兰氏阴性菌。
2.2 修复方法对柴油质量分数的影响
修复方法对柴油质量分数的影响见图3。由图3可见:随降解时间的延长,自然衰减组中的柴油质量分数变化不大,基本维持在2.50%左右,这是由于柴油易被土壤表面吸附,不利于自然挥发[10];降解时间为31 d时,经生物强化处理后的柴油质量分数降至1.29%,经生物刺激处理后的柴油质量分数为1.45%,经生物刺激-生物强化联合修复的土壤中的柴油质量分数为1.09%,柴油去除率为59.6%。由此可见,采用生物刺激-生物强化联合修复柴油污染土壤的效果最好。
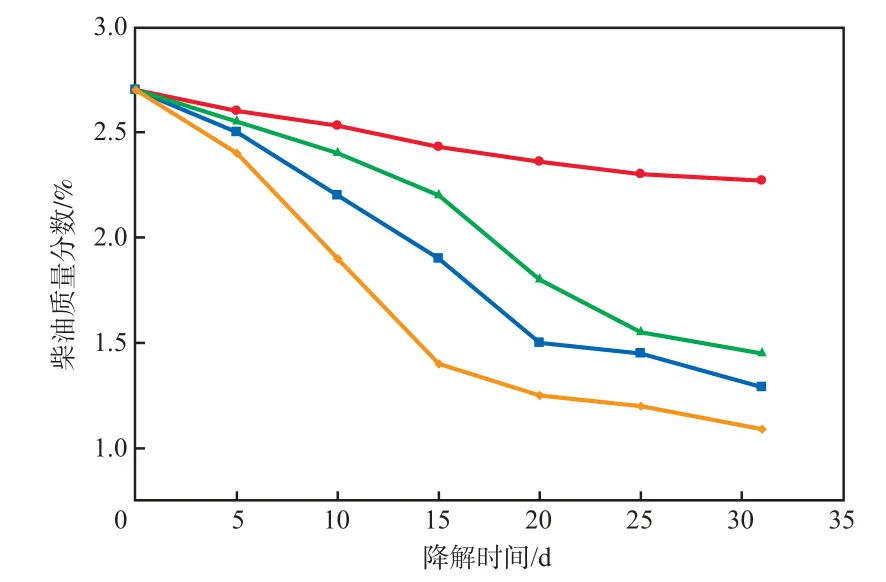
图3 修复方法对柴油质量分数的影响
2.3 修复方法对脱氢酶活性的影响
修复方法对脱氢酶活性的影响见图4。由图4可见:自然衰减组的脱氢酶活性始终保持较低水平;经生物刺激处理后,脱氢酶活性有所增加,但活性低于生物强化处理的酶;经生物刺激-生物强化联合处理后的脱氢酶活性最高。前期对土壤中柴油的降解主要是由加入的降解菌来完成,后期则是土著菌群发挥了降解作用。添加营养源有利于降解菌株以及土壤本身土著微生物的生长,促进了脱氢酶活性的增加。
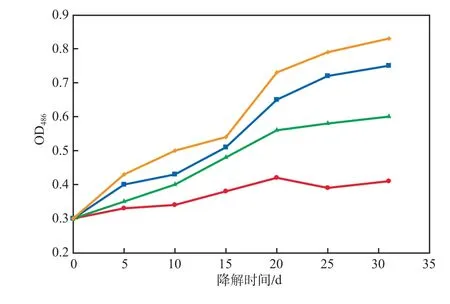
图4 修复方法对脱氢酶活性的影响
2.4 修复方法对FDA水解酶活性的影响
修复方法对FDA水解酶活性的影响见图5。由图5可见:各种修复方法处理的前5 d,FDA水解酶活性均较低,这说明柴油污染物对微生物活性的影响较大;自然衰减组的FDA水解酶一直维持在较低的水平;经生物强化处理后的FDA水解酶活性前期较低,后期随着污染物的降解,土壤微生态得以恢复;随降解时间的延长,经生物刺激处理和生物刺激-生物强化联合处理后的FDA水解酶活性的增长趋势相近,由于降解菌的加入,在降解后期生物刺激-生物强化联合处理后的FDA水解酶活性高于生物刺激处理。
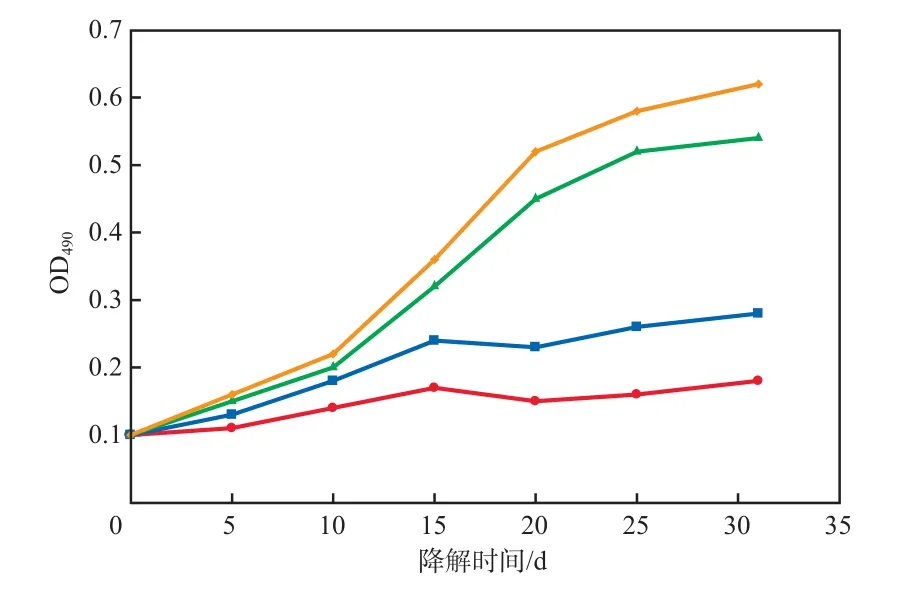
图5 修复方法对FDA水解酶活性的影响
2.5 修复方法对脲酶活性和磷酸酶活性的影响
修复方法对脲酶活性和磷酸酶活性的影响分别见图6和图7。由图6和图7可见:在4种处理方式中,通过生物刺激处理后的脲酶活性和磷酸酶活性最高,说明添加适当比例的养分对于土壤养分循环的恢复作用明显;而只通过生物强化处理,在整个降解过程中,脲酶活性和磷酸酶活性均未得到明显恢复。

图6 修复方法对脲酶活性的影响

图7 修复方法对磷酸酶活性的影响
3 结论
a)从柴油污染土壤中分离出一株高效降解柴油的菌株CY-1,经鉴定为假单胞菌属。
b)采用生物刺激-生物强化联合处理方法修复柴油污染土壤的效果最好。在初始土壤中柴油质量分数为2.70%的条件下,经过31 d的降解,柴油质量分数降至1.09%,柴油去除率59.6%。
c)经生物刺激-生物强化联合修复,土壤脱氢酶活性和FDA水解酶活性最高;通过生物刺激处理可使土壤脲酶活性和磷酸酶活性达到最高。
[1] 陈晓辉. 柴油污染的土壤对早熟禾生长及养分吸收的影响[J]. 宁夏农林科技,2013,54(3):48 - 51.
[2] 任磊,黄廷林. 土壤的石油污染[J]. 农业环境保护,2000,19(16):360 - 363.
[3] Lu M,Zhang Z,Sun S,et al. Enhanced Degradation of Bioremediation Residues in Petroleum-Contaminated Soil Using a Two-Liquid-Phase Bioslurry Reactor[J]. Chemosphere,2009,77(2):161 - 168.
[4] Diaz-Martinez M E,Alarcon A,Ferrera-Cerrato R. Casuarina Equisetifolia (Casuarinaceae) Growth in Soil with Diesel and Application of Biostimulation and Bioaugmentation[J]. Rev Biol Trop,2013,61(3):1039 - 1052.
[5] Dias R L,Ruberto L,Hernandez E. Bioremediation of an Aged Diesel Oil-Contaminated Antarctic Soil:Evaluation of the “on Site” Biostimulation Strategy Using Different Nutrient Sources[J]. Int Biodeterior Biodegrad,2012,75:96 - 103.
[6] Zhang Qiuzhuo,Wang Duanchao,Li Mengmeng,et al. Isolation and Characterization of Diesel Degrading Bacteria,Sphingomonassp. andAcinetobacter Juniifrom Petroleum Contaminated Soil[J]. Front Earth Sci,2014,8(1):58 - 63.
[7] Byun I G,Nam H U,Song S K,et al. Monitoring of Bioventing Process for Diesel-Contaminated Soil by Dehydrogenase Activity,Microbial Counts and the Ratio ofn-Alkane/Isoprenoid[J]. Korean J Chem Eng,2005,22(6):917 - 921.
[8] Adam G,Duncan H. Development of a Sensitive and Rapid Method for the Measurement of Total Microbial Activity Using Fluorescein Diacetate(FDA) in a Range of Soils[J]. Soil Biol Biochem,2001,33(7/8):943 -951.
[9] 李春霞. 环境污染物——萘降解菌的筛选、鉴定及应用[D]. 长春:长春理工大学环境学院,2014.
[10] 李玉瑛,郑西来,李冰. 柴油挥发行为的研究[J].化工环保,2005,25(6):423 - 426.
(编辑 王 馨)
Remediation of Diesel Contaminated Soil by Bio-Stimulation and Bio-Augmentation
Gao Chuang1,2,Zhang Quan2
(1. College of Petrochemical Engineering,Liaoning Shihua University,Fushun Liaoning 113001,China;2. SINOPEC Fushun Petrochemical Research Institute,Fushun Liaoning 113001,China)
A diesel-degrading strain (CY-1) was isolated from the diesel-contaminated soil. 4 different processes were used for bioremediation of diesel-contaminated soil,such as: nature attenuation,bio-stimulation,bio-augmentation,and bio-stimulation-bio-augmentation. The degradation of diesel in soil and the change of enzyme activities of soil microorganism in the 4 degradation processes were studied. The experimental results show that:The strain CY-1 is identified as genusPseudomonas;When the diesel-contaminated soil with 2.70% of initial diesel mass fraction has treated by the bio-stimulation-bio-augmentation combination process for 31 d,the diesel mass fraction is deceased to 1.09%,the diesel removal rate reaches 59.6%;The enzyme activities of soil dehydrogenase and f uorescein diacetate(FDA) hydrolase are the highest in the bio-stimulation-bio-augmentation combination process;While the enzyme activities of soil urease and phosphatase are the highest in the bio-stimulation process.
diesel contaminated soil;bioremediation;bio-stimulation;bio-augmentation;enzyme activity
X172
A
1006 - 1878(2015)02 - 0142 - 05
2014 - 09 - 02;
2014 - 12 - 10。
高闯(1987—),男,辽宁省抚顺市人,硕士生,电话 18741390633,电邮 573088322@qq.com。
