硫氧环蛋白过氧化物酶3对血管紧张素Ⅱ诱导心肌肥大的影响
2015-04-24赵霞梁婷婷裴强王洪波范玉磊魏中秋冯莉孙影
赵霞 梁婷婷 裴强 王洪波范玉磊 魏中秋 冯莉 孙影▲
1.河北联合大学冀唐学:医学实验中心,河北唐山063300;2.河北联合大学基础医学:病理学系,河北唐山063000;3.河北联合大学附属遵化市人民医院心内科,河北唐山064200;4.河北联合大学附属遵化市人民医院外科,河北唐山064200
硫氧环蛋白过氧化物酶3对血管紧张素Ⅱ诱导心肌肥大的影响
赵霞1梁婷婷2裴强3王洪波4范玉磊2魏中秋2冯莉2孙影2▲
1.河北联合大学冀唐学:医学实验中心,河北唐山063300;2.河北联合大学基础医学:病理学系,河北唐山063000;3.河北联合大学附属遵化市人民医院心内科,河北唐山064200;4.河北联合大学附属遵化市人民医院外科,河北唐山064200
目的观察硫氧环蛋白过氧化物酶3(Prdx-3)在血管紧张素Ⅱ(AngⅡ)诱导心肌细胞肥大中的作用,并探讨其作用机制。方法体外培养心肌细胞(H9C2)随机分为对照组、AngⅡ组、AngⅡ+转染对照组和AngⅡ+Prdx-3转染组。脂质体转染法将Prdx-3表达质粒转染心肌细胞,Western blot法检测Prdx-3蛋白表达,Real-time PCR法检测脑钠素(BNP)mRNA表达,二氯荧光素二乙酸(DCFH-DA)检测活性氧(ROS)水平。结果Prdx-3表达质粒转染心肌细胞后,Prdx-3蛋白表达值为(0.88±0.12),高于转染对照组(0.38±0.05),差异有统计学意义(P<0.05)。与对照组比较,AngⅡ组BNP mRNA[(1.00±0.00)比(1.72±0.29)]、ROS[(3473±81)比(4439±111)]及Prdx-3蛋白表达水平[(0.33±0.05)比(0.72±0.14)]均明显增加,差异均有统计学意义(均P<0.05)。AngⅡ+转染对照组和AngⅡ组的BNP mRNA[(1.72±0.29)比(1.94±0.34)]、ROS[(4439±111)比(4285±167)]及Prdx-3蛋白水平[(0.72± 0.14)比(0.75±0.11)]比较,差异无统计学意义(P>0.05)。与AngⅡ组比较,AngⅡ+Prdx-3转染组BNP mRNA [(1.72±0.29)比(1.29±0.15)]和ROS水平[(4439±111)比(3648±254)]明显下降,但Prdx-3蛋白水平[(0.72±0.14)比(1.89±0.37)]显著增高,差异均有统计学意义(均P<0.05)。结论AngⅡ可通过ROS诱导心肌细胞肥大,而Prdx-3通过降低ROS抑制AngⅡ的作用。
硫氧环蛋白过氧化物酶3;活性氧;心肌肥大;血管紧张素Ⅱ
高血压性心脏病主要病理表现是心肌肥大,但持续性心肌肥大会导致心力衰竭。笔者前期研究发现,在血管紧张素Ⅱ(AngⅡ)诱导的高血压模型中,心肌组织中活性氧(ROS)水平明显增高,氧化反应被过度激活;增高的ROS通过参与异常的细胞内信号传导通路或损伤DNA、蛋白质、脂质等物质促进细胞增殖、肥大、凋亡等[1-2]。硫氧环蛋白过氧化物酶3(Peroxiredoxin-3,Prdx-3)是一种新型过氧化物酶,存在于线粒体,与硫氧还蛋白2(thioredoxin-2,Trx-2)一起清除来自于线粒体的ROS[3]。Prdx-3在多种病理过程中均表达上调,以减少组织氧化应激损伤[4]。但在高血压诱导的心肌肥大中,Prdx-3是否可被激活并对心肌肥大进行调控,目前报道较少。本研究利用AngⅡ刺激正常或Prdx-3表达质粒转染的心肌细胞,通过检测脑钠素(BNP)、ROS和Prdx-3等指标的变化,探讨Prdx-3在AngⅡ诱导心肌肥大过程中的作用及机制,为Prdx-3成为靶向治疗新靶点提供实验依据。
1 材料与方法
1.1 材料
H9C2大鼠心肌细胞(中国科学:上海生命科学研究:);血管紧张素Ⅱ(Sigma公司产品);Prdx-3表达质粒(上海吉玛公司合成);BNP上下游引物(上海吉玛公司合成);M-MLV逆转录试剂盒(美国Invitrogen公司);SYBR+Tap混合剂(美国Invitrogen公司);Prdx-3抗体(美国Abcam产品);二氯荧光素二乙酸(Sigma公司)。
1.2 细胞培养及实验分组
心肌细胞在含10%胎牛血清浓度的杜尔伯科改良伊格尔培养基(DMEM)中常规培养,达到70%融合后分为四组。①对照组:以0.4%血清浓度DMEM孵育细胞;②AngⅡ组:0.4%血清浓度DMEM培养条件下,给予AngⅡ(1×10-6mol/L)孵育细胞;③AngⅡ+转染对照组:脂质体Lipo 2000将空质粒载体转染心肌细胞24 h,0.4%血清浓度DMEM培养12 h(同步化)后,给予AngⅡ(1×10-6mol/L)孵育细胞;④AngⅡ+Prdx-3转染组:脂质体Lipo 2000将Prdx-3表达质粒转染心肌细胞24 h,0.4%血清浓度DMEM培养12 h,给予AngⅡ(1×10-6mol/L)孵育细胞。
1.3 Western blot法检测Prdx-3在心肌细胞内的表达
各组细胞同步化后经或未经AngⅡ刺激30 min,PBS漂洗,细胞裂解液冰上震荡裂解30 min后收集裂解细胞,低温高速离心15 min,收集上清。考马斯亮蓝R-250染色测定蛋白浓度,每孔50 μg上样并电泳和转膜。5%牛血清白蛋白封闭1 h,Prdx-3抗体(1∶1000稀释)4℃孵育过夜。次日,二抗(1∶3000稀释)室温孵育2 h后,BCIP/NBT(1∶50稀释)显色3 min。Image J软件对蛋白表达条带进行灰度定量分析,以Prdx-3与GAPDH灰度比值作为Prdx-3表达值。
1.4 Real time PCR法检测BNP mRNA表达[5]
各组细胞同步化后经或未经AngⅡ刺激24 h,Trizol提取细胞总RNA,定量后取0.5 μg RNA行逆转录。1 μL cDNA进行Real-time PCR扩增,扩增体系如下:SYRB+Taq混合剂10 μL、Prx-1或GAPDH上下游引物各0.5 μL、cDNA 1 μL、双蒸水8 μL;扩增条件:95℃变性30 s后,95℃变性5 s、60℃退火30 s、72℃延伸30 s,共40个循环。BNP上游引物序列5'-TGGGCAGAAGATAGACCGGA-3',下游引物5'-ACAA CCTCAGCCCGTCACAG-3';GAPDH上游引物5'-GGC ACAGTCAAGGCTGAGAATG-3',下游引物5'-ATGGTG GTGAAGACGCCAGTAA-3'。GAPDH为内参照,各组BNP mRNA表达量以各样本与对照组的倍数表示。
1.5 二氯荧光素二乙酸(DCFH-DA)检测ROS水平
DCFH-DA没有荧光,能自由穿过细胞膜,进入细胞后被酯酶水解生成还原型二氯荧光素(DCFH),DCFH不能通过细胞膜,但可被细胞内的ROS氧化生成氧化型二氯荧光素(DCF),DCF可发出荧光,因此DCF的荧光量可以反映细胞内ROS水平。本实验细胞同步化后,AngⅡ刺激20 min,经0.25%胰蛋白酶消化制成单细胞悬液,加入DCFH-DA,终浓度为10 μmol/L,37℃孵育20 min,PBS洗3次,计数10 000个细胞,在荧光酶标仪测定激发波长488 nm、发射波长525 nm处的荧光强度。
1.6 统计学方法
采用SPSS 15.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Prdx-3表达质粒转染心肌细胞后Prdx-3蛋白表达
心肌细胞(未经AngⅡ刺激)经空质粒或Prdx-3表达质粒转染24 h后,Western blot检测Prdx-3蛋白表达。结果显示,转染对照组Prdx-3蛋白表达值为(0.38±0.05),Prdx-3表达质粒转染后Prdx-3蛋白表达值为(0.88±0.12),是转染对照组的2.3倍,差异有统计学意义(P<0.05)。见图1。
2.2 BNP mRNA表达
与对照组比较,AngⅡ组BNP mRNA表达增高[(1.72±0.29)比(1.00±0.00)],差异有统计学意义(P<0.05);AngⅡ组与AngⅡ+转染对照组[(1.94±0.34)]比较,BNP mRNA表达差异无统计学意义(P>0.05),但AngⅡ+Prdx-3转染组BNP mRNA表达(1.29±0.15)明显下降,差异有统计学意义(P<0.05)。
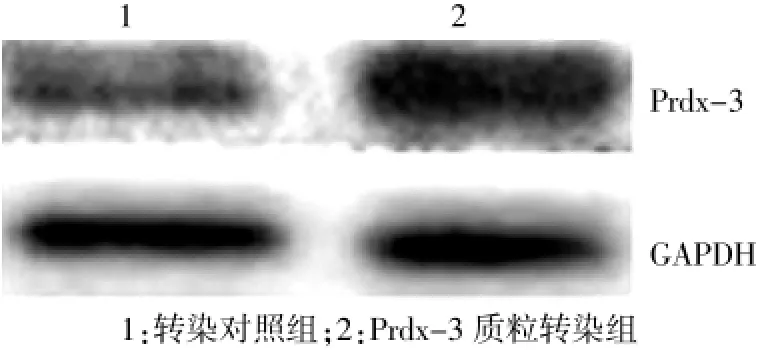
图1 Western blot法检测Prdx-3表达质粒转染心肌细胞后Prdx-3蛋白表达
2.3 ROS水平
对照组荧光强度为(3473±81),AngⅡ组荧光强度为(4439±111),差异有统计学意义(P<0.05)。与AngⅡ组比较,AngⅡ+转染对照组荧光强度为(4285±167),差异无统计学意义(P>0.05),但AngⅡ+Prdx-3转染组荧光强度为(3648±254),差异有统计学意义(P<0.05)。
2.4 Prdx-3蛋白表达
对照组Prdx-3蛋白的表达值为(0.33±0.05),AngⅡ组Prdx-3蛋白表达值为(0.72±0.14),差异有统计学意义(P<0.05)。与AngⅡ组比较,AngⅡ+转染对照组Prdx-3蛋白的表达值为(0.75±0.11),差异无统计学意义(P>0.05),但AngⅡ+Prdx-3转染组的Prdx-3蛋白的表达值为(1.89±0.37),差异有统计学意义(P<0.05)。见图2。
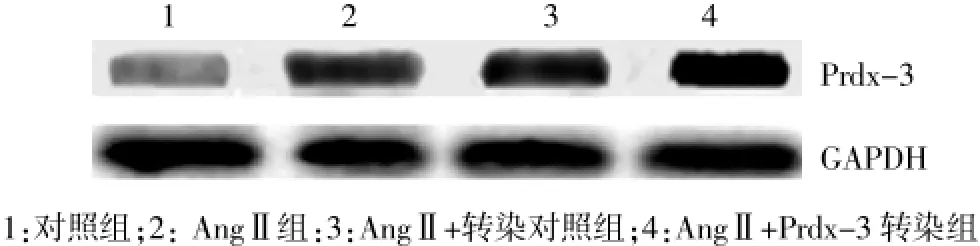
图2 Western blot法检测各组细胞Prdx-3蛋白表达情况
3 讨论
ROS包括氧自由基、过氧化物和激发态氧等,具有很高的化学活性。正常时体内ROS的浓度很低,对机体具有保护作用,但过多的ROS可导致脂质过氧化、DNA链断裂、蛋白质修饰变性,从而导致细胞凋亡和坏死[6]。另外,过多ROS还与心肌细胞肥大密切相关。研究表明,ROS是细胞信号传导通路的重要成员,通过激活细胞外调节蛋白激酶(ERK1/2)、p38丝裂原活化蛋白激酶(p38MAPK)及核因子κB(NF-κB)等途径介导多种细胞因子或活性因子的促心肌细胞肥大作用[7]。线粒体是心肌细胞产生ROS的重要场所,主要通过线粒体呼吸链电子泄漏产生[3]。最近研究显示,心脏微环境内的肾素-血管紧张素-醛固酮系统还可通过诱导ATP±赖的K+离子通道开放来促进线粒体产生更多的ROS,并由此引起Ⅰ型钠氢交换体和碳酸氢钠协同转运蛋白的激活,最终引起心肌细胞肥大[8]。
Peroxiredoxin家族是一种新型的过氧化物酶,Prdx-3是该家族成员中唯一特异性定位于线粒体的酶蛋白,在内质网中合成后经过线粒体定位信号转运到线粒体。Prdx-3、Trx2及硫氧还蛋白还原酶2(TrxR2)一起构成Prdx-3-Trx-TrxR氧化还原体系,催化来自线粒体的H2O2转变成H2O,从而调控线粒体内H2O2浓度水平,保护细胞免于来自线粒体的氧化应激[9-10]。有研究显示,Prdx-3能够保护肝癌细胞免于氧化应激诱导的细胞凋亡[11],高表达Prdx-3在毒物诱导的大鼠海马区神经损伤中发挥保护作用[12]。在本研究中,AngⅡ刺激心肌细胞30 min后Prdx-3蛋白表达明显高于对照组,说明AngⅡ能够上调心肌细胞Prdx-3表达。
本研究利用Prdx-3表达质粒转染心肌细胞使心肌细胞高表达Prdx-3蛋白,并观察高表达Prdx-3对AngⅡ诱导的心肌细胞肥大和ROS的影响。结果发现,AngⅡ使心肌细胞BNP mRNA的水平增加了1.7倍,Prdx-3表达质粒转染后BNP mRNA的水平下降了23.5%(P<0.05),而转染对照无明显变化,提示Prdx-3高表达能抑制AngⅡ诱导心肌细胞肥大。同时,高表达Prdx-3对AngⅡ诱导的ROS也有抑制作用,AngⅡ作用20 min后ROS的表达量较对照组明显增加,Prdx-3表达质粒转染后ROS水平下降,说明Prdx-3可通过抑制ROS来抑制AngⅡ诱导的心肌细胞肥大。
综上所述,AngⅡ可通过ROS诱导心肌细胞肥大,高表达Prdx-3通过降低ROS水平来抑制AngⅡ促心肌细胞肥大作用。因此,Prdx-3有望成为心肌肥大基因治疗的新靶点。
[1]Sun Y,Carretero OA,Xu J,et al.Deletion of Inducible Nitric Oxide Synthase Provides Cardioprotection in Mice With 2-Kidney,1-Clip Hypertension[J].Hypertension,2009,53(1):49-56.
[2]Xuan CL,Yao FR,Guo LR,et al.Comparison of extracts from cooked and raw lentil in antagonizing angiotensinⅡ-induced hypertension and cardiac hypertrophy[J].Eur Rev Med Pharmacol Sci,2013,17(19):2644-2653.
[3]王大宁.PrxⅢ在去甲肾上腺素诱导H9C2细胞凋亡过程中的表达变化[D].石家庄:河北医科大学,2008.
[4]Li L,Zhang YG,Chen CL,et al.Anti-apoptotic role of peroxiredoxinⅢin cervical cancer cells[J].FEBS Open Bio,2012,22(3):51-54.
[5]高卫民,曹志鹏,米丽,等.急性心功能障碍大鼠心肌中BNP的表达[J].法医学杂志,2013,29(2):86-90.
[6]苏丽华,王璇琳,贺敏,等.黑青稞籽皮提取物对心肌细胞缺氧/复氧损伤的保护作用[J].中国医药导报,2014,11(12):21-24.
[7]Chen G,Pan SQ,Shen C,et al.Puerarin inhibits angiotensinⅡ-induced cardiac hypertrophy via the redox-sensitive ERK1/2,p38 and NF-κB pathways[J].Acta Pharmacol Sin,2014,35(4):463-475.
[8]De Giusti VC,Caldiz CI,Ennis IL,et al.Mitochondrial reactive oxygen species(ROS)as signaling molecules of intracellular pathways triggered by the cardiac renin-angiotensinⅡ-aldosterone system(RAAS)[J].Front Physiol,2013,4:126-134.
[9]Li L,Shoji W,Oshima H,et al.Crucial role of peroxiredoxinⅢin placental antioxidant defense of mice[J].FEBS Lett,2008,5(82):2431-2434.
[10]Matsushima S,Ide T,Yamato M,et al.Overexpression of mitochondrial peroxiredoxin-3 prevents left ventricular remodeling and failure after myocardial infarction in mice[J].Circulation,2006,1(13):1779-1786.
[11]Wang YG,Li L,Liu CH,et al.Peroxiredoxin 3 is resistant to oxidation-induced apoptosis of Hep-3b cells[J]. Clin Transl Oncol,2014,16(6):561-566.
[12]Hattori F,Murayama N,Noshita T,et al.Mitochondrial peroxiredoxin-3 protects hippocampal neurons from excitotoxic injury in vivo[J].J Neurochem,2003,86(4):860-868.
Effect of Peroxiredoxin-3 on angiotensinⅡ-induced cardiomyocytes hypertrophy
ZHAO Xia1LIANG Tingting2PEI Qiang3WANG Hongbo4FANG Yulei2WEI Zhongqiu2FENG Li2SUN Ying2▲
1.Medical Research Center,Jitang College,Hebei United University,Hebei Province,Tangshan063300,China;2.Department of Pathology,Primary Medicine College,Hebei United University,Hebei Province,Tangshan063000,China; 3.Department of Cardiology,Zunhua People's Hospital,Hebei United University,Hebei Province,Tangshan064200, China;4.Department of Surgery,Zunhua People's Hospital,Hebei United University,Hebei Province,Tangshan 064200,China
Objective To study the effect of peroxiredoxin-3(Prdx-3,a noval type of peroxidase)on AngiotensinⅡ(AngⅡ)-induced cardiomyocytes hypertrophy and explore the precious mechanism.Methods Cultured cardiomyocytes (H9C2)were randomly divided into four groups:control group,AngⅡgroup,AngⅡ+vehicle(plasmid without prdx-3 gene)group,AngⅡ+Prdx-3 plasmid group.Prdx-3 was transfected into cardiomyocytes using the liposome infection. Western blot was used to evaluate Prdx-3 expression in cardiomyocytes,while levels of brain natriuretic peptide(BNP) mRNA and reactive oxygen species(ROS)were measured by Real-time PCR and DCFH-DA.Results The expression of Prdx-3 protein in transfected cardiomyocytes(0.88±0.12)was significantly higher than vehicle(0.38±0.05,P<0.05). Compared with control group,expressions of BNP mRNA,ROS and Prdx-3 in AngⅡgroup all increased[(1.00±0.00) vs(1.72±0.29),(3473±81)vs(4439±111),(0.33±0.05)vs(0.72±0.14),P<0.05].The difference of expressions of BNP mRNA[(1.72±0.29)vs(1.94±0.34)],ROS[(4439±111)vs(4285±167)]and Prdx-3[(0.72±0.14)vs(0.75±0.11)]between AngⅡand AngⅡ+vehicle groups were not statistically significant(P>0.05).Compared with AngⅡ,expressions of BNP mRNA and ROS in AngⅡ+Prdx-3 plasmid group were lower[(1.72±0.29)vs(1.29±0.15),(4439±111)vs(3648± 254),P<0.05],while Prdx-3 level was further higher[(0.72±0.14)vs(1.89±0.37),P<0.05].Conclusion AngⅡinduced cardiomyocytes to generate ROS,which contributes to cell hypertrophy;however,Prdx-3 over-expression inhibits these changes by decreasing ROS level.
Peroxiredoxin-3;Reactive oxygen species; Cardiomyocytes hypertrophy;AngiotensinⅡ
R542.2
A
1673-7210(2015)07(c)-0018-04
2015-02-14本文编辑:程铭)
河北省引进留学人员科技活动项目(D2012003028)。
▲通讯作者
