响应面法优化羊肚菌深层发酵条件
2015-04-24徐丹丹陈显化金朝霞张宗申张孟夏王培忠
徐丹丹,陈显化,金朝霞,张宗申,3*,张孟夏,王培忠
羊肚菌(Morchella esculenta)属羊肚菌科羊肚菌属,是珍贵食药用真菌,因其外观极似羊肚又称“羊肚蘑”[1].羊肚菌营养丰富,含有多糖、氨基酸、脂肪酸、吡喃酮、抗生素类等[2],其中多糖是主要的活性成分,具有增强免疫力[3]、抗疲劳[4]、预防动脉硬化[5]、抑制肿瘤[6,7]等功效.由于羊肚菌生境特殊的原因,野生菌极少,再加上人工栽培极其困难,导致其市场供应严重不足.继1958年J.Sguest[8]首次在发酵罐中培养羊肚菌菌丝后,通过发酵技术高效培养羊肚菌及其活性物质,是解决羊肚菌资源短缺问题的手段之一.欧超等[9]对羊肚菌发酵过程中碳源、氮源、无机盐及培养条件进行了研究.贾建会等[10]以深层发酵的羊肚菌菌丝和发酵液为主要原料进行多糖提取,并对多糖进行了纯化及组分鉴定.魏芸等[11]对羊肚菌多糖的分离纯化及组成结构进行了分析,为羊肚菌多糖的深入研究奠定了基础.
利用合理的试验设计获得实验数据,采用多元方程拟合因素和响应值间的函数关系,经回归分析寻找最佳条件,是解决多变量的一种统计学常用方法[12].本研究以天然谷物作为碳源和氮源,不添加任何化学试剂,应用响应面法优化羊肚菌液体发酵过程中菌丝体生物量和胞外多糖积累条件,为规模化生产羊肚菌及其多糖提供依据.
1 材料与方法
1.1 材料
羊肚菌(Morchella esculenta),大连工业大学菌种保藏中心保藏.
1.2 方法
1.2.1 菌种活化
将于4℃下保藏的菌种接种于PDA斜面上,25℃恒温培养箱中培养.
1.2.2 液体种子制备
挑取3个0.5 cm2的菌丝块接入液体种子培养基中,在25℃和150 r/min下震荡培养5 d.
1.2.3 种子培养基的制备
称取葡萄糖2 g、蛋白胨1 g、MgSO40.1 g、KH2PO40.046 g、(NH4)2SO40.1 g,用水定容至100 m L,120℃、0.1 MPa灭菌30 min.
1.2.4 最佳培养基的确定
用玉米粉和黄豆粉配置三种比例的培养基分别为1号:玉米粉7.5 g+黄豆粉5 g;2号:玉米粉10 g+黄豆粉5 g;3号:玉米粉12.5 g+黄豆粉5 g.分别配制成100 m L培养基,分装在250 m L锥形瓶中,经120℃灭菌30 min.在灭菌后的培养基中接入10%的液体种子,于25℃、150 r/min条件下发酵培养7 d.
1.2.5 生长曲线的测定
在优化培养条件下,每隔12 h测定一次菌丝体干重和胞外多糖浓度.以培养时间为横坐标,菌丝体生物量和胞外多糖浓度为纵坐标,绘制生长曲线.
1.2.6 菌丝体生物量的测定
发酵液过滤后,菌丝体用去离子水冲洗3次,然后用抽滤机抽干,于60℃烘箱中烘干至恒重,用分析天平称重.
1.2.7 胞外多糖的测定
1.2.7.1 胞外多糖的提取与分离
去菌丝的发酵液于4000 r/min下离心20 min,取上清液,加入3倍体积95% 乙醇,调节p H至7.3,于4℃冰箱中静置24 h,4000 r/min下离心30 min,弃去上清液[13].沉淀溶解于15 m L去离子水中,移入20 m L容量瓶中定容.取0.1 m L溶液用苯酚-硫酸法测定多糖含量.
1.2.7.2 标准曲线的测定
以葡萄糖为标准品,标准曲线测定方法参考Sawabe[14].获得的标准曲线方程为:y=0.007x+0.027 3,R2=0.999 3.
还原糖标准曲线方程为:y=0.002 4x-0.009 3,R2=0.997 4.
以上试验结果均重复3次,取平均值.
1.2.8 实验设计
本试验应用响应面分析法对羊肚菌发酵条件进行优化综合单因素试验结果,根据Boxbenhnken的中心组合试验设计原理[15],选取温度、起始p H、摇床转速三个因素,采用三因素三水平的响应面分析方法进行试验设计(表1).

表1 响应面因素与水平
2 结果与讨论
2.1 羊肚菌液体发酵最佳培养基的确定
由图1可知,羊肚菌在1、2、3号培养基中均能较好地生长,说明玉米粉和黄豆粉能满足羊肚菌生长的基本营养需要,但是在不同配比的培养基中,羊肚菌菌丝体的生长情况和胞外多糖浓度有所变化.其中以2号培养基中菌丝体生长量和胞外多糖浓度达到最大,菌丝球大小比较均匀且比较小,所以以2号培养基作为羊肚菌液体发酵的基础培养基.
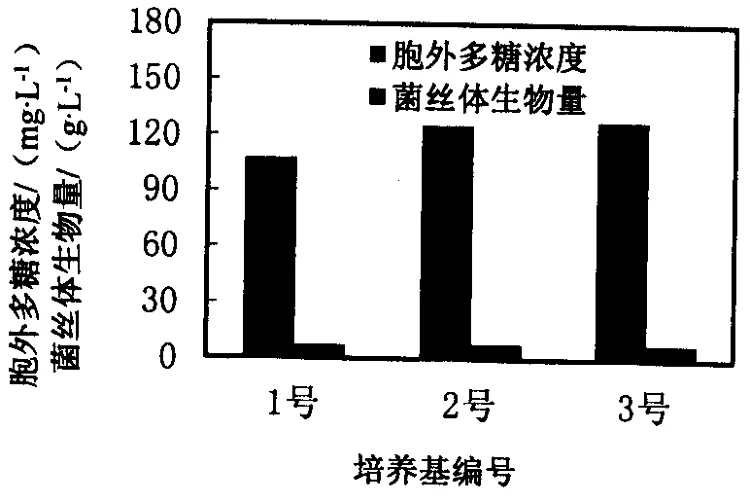
图1 羊肚菌液体发酵培养基的筛选
2.2 单因素试验结果
2.2.1 发酵温度对羊肚菌菌丝体生物量和胞外多糖浓度的影响
由图2可知,温度从21~25℃递变时,羊肚菌的菌丝生物量和胞外多糖浓度显著增加,温度从25~31℃时,菌丝体生物量和胞外多糖浓度显著下降,因此选择25℃为发酵温度.
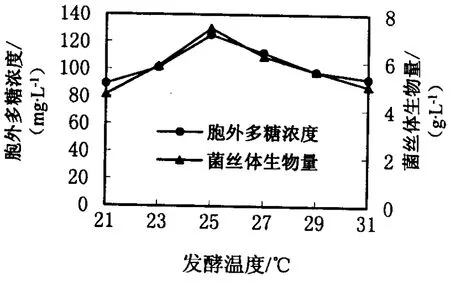
图2 发酵温度对羊肚菌液体发酵的影响
2.2.2 培养基起始p H对羊肚菌菌丝体生物量和胞外多糖浓度的影响
图3结果表明,培养基p H为6时,羊肚菌的菌丝生物量和胞外多糖浓度达到最大,分别达到7 g/L和130 mg/L,故而选择起始p H为6.
2.2.3 摇床转速对羊肚菌菌丝体生物量和胞外多糖浓度的影响
在160 r/min之前,随着摇床转速的增加,羊肚菌菌丝生物量和胞外多糖浓度不断增加.在160~200 r/min时,菌丝生物量和胞外多糖浓度随着摇床转速的增大而降低(见图4),所以选择160 r/min作为羊肚菌液体培养的转速.

图3 起始p H对羊肚菌液体发酵的影响
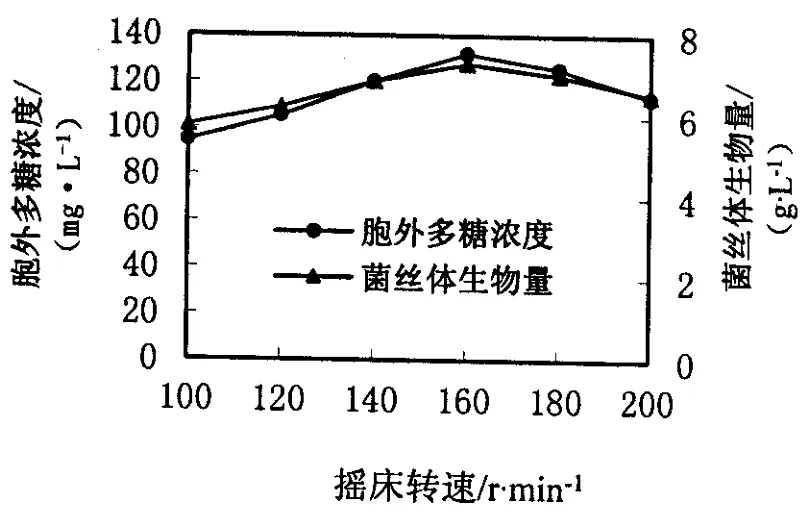
图4 摇床转速对羊肚菌液体发酵的影响
2.3 羊肚菌的生长曲线
羊肚菌菌丝体生物量和胞外多糖浓度与培养时间的关系如图5所示.羊肚菌生长周期为144 h,0~48 h为延滞期,48~120 h为旺盛生长期,此后逐渐进入稳定期和衰亡期.在培养144 h时菌丝体生物量和胞外多糖浓度达到顶峰,分别为7.75 g/L和131.7 mg/L.

图5 羊肚菌液体发酵的生长曲线
2.4 响应面法对羊肚菌液体发酵条件优化的试验结果
2.4.1 Box-Behnken中心组试验
在单因素试验基础上,按中心组合试验设计,共进行19组试验,试验结果见表2.
利用Design-Expert软件,通过对羊肚菌菌丝体生物量试验数据进行多元回归拟合,获得菌丝体生物量对编码自变量发酵温度(A)、p H(B)及摇床转速(C)的二次多项回归方程:
菌丝体生物量=7.73+0.24A+0.20B-0.065C-5.000E-003AB+0.030AC+0.015BC-0.70A2-0.71B2-0.10C2
P<0.001,表明试验所采用的二次模型是极显著的,在统计学上是有意义的.本试验P为0.050 4>0.05,对模型是有利的,无失拟因素存在,因此可用该回归方程代替试验真实点对试验结果进行分析.模型中一次项A、B对菌丝体生物量的影响极显著(P<0.01);二次项A2、B2对菌丝体生物量的影响极显著(P<0.01);C2对菌丝体生物量的影响显著(P<0.05).表明试验因素对响应值不是简单的线性关系,因素间的交互作用对菌丝体生物量有影响.交互项AB、AC、BC的P均大于0.05,所以交互项对菌丝体生物量没有显著性影响.模型的调整确定系数R2=0.990 7,即该模型能解释99.07%的响应值变化,说明该模型拟合程度良好,可以用此模型对菌丝体生物量进行分析和预测.

表2 羊肚菌菌丝体生物量和胞外多糖浓度的Box-Behnken试验设计结果
2.4.2 各因素间的交互作用
图6~8是根据回归方程,利用Design-Expert软件做出的各个因子交互作用的响应面的3D和等值线分析图.经软件分析计算得到羊肚菌液体发酵的最佳条件:25.33℃、p H 6.13、154.33 r/min,预测值分别为:菌丝体生物量7.78 g/L、胞外多糖浓度130.97 mg/L.
为检验响应面法的可行性,以最佳发酵条件对实验结果进行了5次验证试验,试验结果表明:菌丝体平均生物量为7.75 g/L、胞外多糖浓度为130.68 mg/L,与实验的理论预测值吻合,这表明该模型是合理有效的,且优化的羊肚菌液体发酵条件具有实际应用意义.

表3 拟合二次多项式模型的方差分析

图6 温度和起始p H交互作用影响菌丝体生物量和胞外多糖浓度的等高线

图7 温度和摇床转速交互作用影响菌丝体生物量和胞外多糖浓度的等高线

图8 起始p H和摇床转速交互作用影响菌丝体生物量和胞外多糖浓度的等高线
3 结论
本实验以羊肚菌(Morchella)为材料,以单因素试验和响应面试验,研究了培养基组分和发酵条件对羊肚菌菌丝体生物量和胞外多糖浓度的影响,筛选出了最佳发酵培养基配比,优化了羊肚菌液体发酵条件.单因素试验表明液体发酵培养基玉米粉和黄豆粉的最佳比例是10∶5.响应面法优化了羊肚菌液体发酵的最佳条件为温度25.33℃、起始p H 6.13、摇床转速154.33 r/min,羊肚菌菌丝生物量和胞外多糖浓度可达到最大,分别为7.78 g/L和130.97 mg/L.该试验用玉米粉和黄豆粉作为培养基,大大降低了生产成本,并且获得的发酵产物也更加绿色健康,为大规模地工业化食用生产提供可靠的理论依据.
参考文献:
[1]林晓民,李振歧,侯军,等.中国菌物[M].北京:中国农业出版社,2007:107-108.
[2]雷艳,曾阳,唐勋,等.羊肚菌化学成分及药理作用研究进展[J].青海大学学报,2013(2):59-64.
[3]张利平,陈彦,王子尧,等.羊肚菌胞外多糖免疫活性研究[J].食品科学,2009,28(3):47-49.
[4]万春艳.羊肚菌的药用研究近况[J].中国林副特产,2008(4):91-92.
[5]Wasser S P.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].Applied Microbiology and Biotechnology,2002(60):258-274.
[6]任丹,郑林用,余梦瑶,等.羊肚菌的药用价值及开发利用[J].中国食用菌,2009,28(5):7-9.
[7]吕晓莲,郭宏,贾建会,等.羊肚菌发酵产物功能性研究[J].食品科学,2013,34(1):311-314.
[8]金若忠.羊肚菌研究进展综述[J].科技简报,1997,4(1):21-24.
[9]欧超.羊肚菌液体深层发酵[J].食品与生物技术学报,2007,26(2):80-86.
[10]贾建会,吕晓莲,樊利青.深层发酵羊肚菌多糖的提取、分离及纯化研究[J].食品科学,2002,23(4):5964.
[11]魏芸,张天佑,张姝,等.羊肚菌多糖的分离纯化及组成结构[J].植物资源与环境学报,2000,9(2):14-17.
[12]杨昆,詹晓北,陈蕴,等.响应面法优化产琥珀酸[J].安徽农业科学,2008,36(16):6611-6614.
[13]武秋立,安家彦.羊肚菌多糖提取、分离条件的选择[J].食品科学,2005,6(1):116-120.
[14]Sawabe T,Ezuray T.Characterization of an alginolytic marine bacterium from decaying rishiri kombu Laminaria japonica varochotensis[J].Bull Jap Soc Sci Fish,1992,58(1):141-144.
[15]Box G E P,Hunter W G.Statistics for experiments:an introduction to design,data analysis and model building[M].New York:Wiley,1900.
