血清游离脂肪酸的评价与研究
2015-04-23关柏芳陈阳
关柏芳,陈阳
(1. 北京市医药集中采购服务中心,北京 100053;2. 北京九强生物技术股份有限公司,北京 100191)
游离脂肪酸(free fatty acid, FFA),也称非酯化脂肪酸(nonesteri fi ed fatty acid, NEFA),临床上一般是指C10以上的脂肪酸,是脂肪代谢的中间产物,同时也是合成细胞膜脂质结构和前列腺素的供体以及机体能量代谢的重要能源物质之一[1,2]。当肌肉活动所需能源——肝醣耗尽时,脂肪组织会分解中性脂肪成为游离脂肪酸来充当能源使用。所以,游离脂肪酸可说是进行持久活动所需的物质。正常血清中的游离脂肪酸主要包括油酸(oleic acid,占54%)、软脂酸(palmitic acid,占34%)、硬脂酸(stearic acid,占6%)等[3],其与清蛋白结合在血液中运输。
游离脂肪酸是反映脂质代谢、糖代谢、内分泌机能等的非常灵敏的指标。目前,血中游离脂肪酸可反映人体脂肪代谢情况及血脂水平。FFA增高[4]多见于肥胖,糖尿病,甲状腺机能亢进,心肌梗塞,肢端肥大症,严重肝病和饥饿;FFA降低见于甲状腺机能减退,脑垂体功能不全,阿狄森氏病。餐后可引起生理性降低。由于FFA在糖尿病(diabetes mellitus,DM)、心血管病(angiocardiopathy,CD)等疾病的发病机理及作用方面的重要意义,对人体血清中游离脂肪酸含量进行检测,能够尽早发现患者血清中游离脂肪酸的异常情况,最终起到预防及尽早对相关疾病进行治疗的目的[5]。因此,针对FFA作用的研究已经成为临床医学领域的研究热点。
随着血清游离脂肪酸测定方法的发展,临床上酶法测定血清游离脂肪酸也得到了临床医学领域各方面的关注,各厂家的同类产品也被寄予更高、更新的要求,为此,本文通过评价国内外试剂在全自动生化分析仪上的检测限、线性、精密度、抗干扰、以及相关性,并在评价过程中,将国际标准程序形成为国内可通用的中文标准及其数学操作程序,同时从统计学不同的角度,综合评价试剂盒质量,确定出符合临床需要的游离脂肪酸测定试剂盒。
1 游离脂肪酸临床意义及测定方法的介绍
1.1 游离脂肪酸的临床意义
脂质物质是细胞膜的主要组成,具有多种重要的生物学功能。存在于人体内的脂质,大致可以分为胆固醇、中性脂肪(三酸甘油脂)、磷脂质、游离脂肪酸等4种[6]。游离脂肪酸的功能:热量的直接来源:游离脂肪酸是中性脂肪分解成的物质。当肌肉活动所需能源——肝醣耗尽时,脂肪组织会分解中性脂肪成为游离脂肪酸来充当能源使用。所以,游离脂肪酸可说是进行持久活动所需的物质。例如:马拉松赛跑。通过检测血浆中的脂肪酸水平,可以研究某些重要疾病与脂质及脂肪酸的关系。特别是长链不饱和脂肪酸,由于它们是合成前列腺素的原料,而且还能促使胆固醇的转变和排泄,从而降低血中胆固醇的浓度,因此更具有重要的意义。
脂肪酸是脂肪水解的产物,测定血清脂肪酸可以了解脂肪代谢的情况,升高代表脂肪分解增加。正常时血清游离脂肪酸含量极微,饥饿、运动及情绪激动可以升高游离脂肪酸,但受内分泌机能的影响,在甲状腺功能亢进、注射肾上腺素或去甲肾上腺素及生长激素后升高。任何疾病影响血中激素水平者均对游离脂肪酸有影响,未治糖尿病人血清游离脂肪酸水平升高。一些药物如咖啡因、磺胺丁脲、乙醇、肝素、烟碱、避孕药等可使血清游离脂肪酸升高;而乙酰水杨酸(阿司匹林)可促进脂肪氧化,氯贝丁酯(安妥明)、尼克酸及普萘洛尔(心得安)则有降低游离脂肪酸作用。
游离脂肪酸是反映脂质代谢、糖代谢、内分泌机能等的非常灵敏的指标。目前,血中游离脂肪酸可反映人体脂肪代谢情况及血脂水平。
1.1.1游离脂肪酸含量与糖尿病的关系
FFA使肝糖异生和糖原分解增加,在骨骼肌中抑制葡萄糖的摄取和氧化,并可通过调节微血管功能促进胰岛素抵抗(insulin resistance,IR)、高血压及微血管病变的发生和发展[7]。FFA持续升高不仅会造成胰岛素分泌量的减少,也会抑制胰岛素对靶组织如肝脏和肌肉的生物学效应[8]。K.Fujimoto等提出2型糖尿病的主要特征之一就是慢性高脂血症,可能是经由FFA引起胰腺十二指肠同源异型盒(PDX-1)表达的下降致使β细胞功能损伤[9,10],胰岛素合成下降。生理状态下,胰岛β细胞分泌胰岛素受葡萄糖及脂肪酸等营养物质的精确调节,它们的作用部位分为改变胞内第二信使浓度的近端调节步骤(钙依赖性)和直接作用与胞吐分子构件的末端调节步骤(钙非依赖性)[11]。在体和离体实验均表明,β细胞短期暴露于FFA中促进其胰岛素的分泌,但高浓度FFA长期刺激则损伤β细胞的葡萄糖刺激下的胰岛素分泌(GSIS)功能,其发生的机制可能是脂肪酸的氧化降低了关键酶与蛋白的表达阻碍了葡萄糖的氧化,ATP/ADP降低,胰岛素释放减少;葡萄糖氧化的障碍又损伤线粒体的功能,ATP生成减少,胰岛素释放变少;同时长期高脂损伤G蛋白偶联受体40的功能,胰岛素的胞吐作用减弱[12]。长期高FFA刺激可使胰岛β细胞表面葡萄糖转运子2(GLUT2)与葡萄糖激酶(GK)的表达减少,造成葡萄糖转运和活化障碍,引起β细胞的功能缺陷。
胰岛素抵抗(insulin resistance, IR)是2型糖尿病(type 2diabetes mellitus, T2DM)发生关键环节之一,老年T2DM患者常存在脂代谢紊乱及IR,脂毒性是其作用机制之一[13]。长期处于高浓度的FFA状态,可诱导β细胞凋亡,称脂性凋亡(lipoapoptosis),使正常β细胞数量减少,胰岛素分泌不足[14]实验发现,分别将棕榈酸、油酸及单不饱和脂肪酸作用于MIN6细胞,测凋亡和TG水平,棕榈酸诱导凋亡增加,FFA酯化相关基因(SCD1、DGAT1、DGAT2和FAS)表达增加,油酸和单不饱和脂肪酸凋亡不明显,且只有DGAT2表达上调,但是却观察到细胞受到FFA的刺激后TG的水平升高,尤以油酸最为显著。有报导提出人的胰腺及INS-1细胞株长期经FFA作用后发现大量的不正常形态自噬体的堆积,溶酶体基因表达受抑制,可能会影响β细胞自噬功能[15]。Masini M等将β细胞暴露于高浓度的FFA,发现胞内空泡明显的聚集,细胞死亡率增加,同时溶酶体相关膜蛋白2(LAMP2)表达降低,提示β细胞内自噬功能的改变,使细胞内正常的新陈代谢受到干扰,死亡细胞数目增多,最终发展成为T2DM[16]。
FFA不仅可以干扰葡萄糖代谢的不同环节,重要的是在胰岛素受体及受体后的信号转导方面发挥作用,降低胰岛素刺激的葡萄糖转运。同时可诱导胰岛β 细胞功能性凋亡。一般而言FFA 加重胰岛素抵抗, 后者进一步升高FFA , 两者形成恶性循环, 促进DM的发展[17]。综上,FFA对于糖尿病的诊断、预后跟踪控制、机理研究等方面具有重要的意义。
1.1.2游离脂肪酸含量与肥胖的关系
1997年,世界卫生组织将肥胖明确定义为一种疾病,指体内脂肪堆积过多和(或)分布异常,体重增加。2000年肥胖发病率为5%,全国第一,2002年发病率8%,2008年发病率11.2%,到目前还有上升的趋势[18]。肥胖不仅严重影响生活质量,而且还是糖尿病、冠心病、心脑血管疾病等的潜在危险因素,肥胖及其诱发导致的相关疾病已成为社会医学的大课题[19]。高浓度的FFA可促使人体糖、脂代谢发生紊乱,肥胖者体内的FFA摄取和氧化增加可抑制胰岛素肌肉及肝脏的作用导致胰岛素抵抗,大量血脂尤其FFA沉积于外周组织影响胰岛素效应引起血糖高,机体代偿性胰岛素分泌增加导致高胰岛素血症[20]。目前研究表明,肥胖患者体内异常增多的空腹血清游离脂肪酸可能是肥胖病和胰岛素抵抗/高胰岛素血症联系的重要环节。高游离脂肪酸刺激的后果是高活性反应分子性氧簇(ROS)和活性氮簇(RNS)生成增多,从而启动了氧化应激机制(高活性反应分子产生和抗氧化作用之间长期失衡而引起组织损伤)。这些活性分子可直接氧化和损伤DNA、蛋白质、脂类,还可作为功能性分子信号,激活细胞内多种应激敏感信号通路,这些信号通路与胰岛素抵抗和β细胞功能受损密切相关,从而致机体产生胰岛素抵抗,影响血糖代谢[21]。多项研究表明肥胖病人较健康人群更易伴发糖代谢紊乱。本课题主要通过研究肥胖人群血清游离脂肪酸和糖代谢相关指标和试验(空腹血糖、空腹胰岛素、口服葡萄糖耐量试验、胰岛素释放试验、胰岛素敏感指数、胰岛素抵抗指数、胰岛素分泌功能等)的变化特点,发现肥胖病人血清游离脂肪酸水平和糖代谢变化,了解肥胖病人血清游离脂肪酸与糖代谢的关系,进而探讨血清游离脂肪酸在预测肥胖病人发生糖代谢紊乱中的作用。
1.1.3游离脂肪酸含量与心脑血管疾病的关系
心脑血管疾病是严重威胁人类生命健康的疾病,是发达国家的主要疾病和死亡原因。在我国,随着中国人群饮食结构和生活方式的改变慢性疾病谱发生了变化,冠状动脉疾病和脑血管疾病已成为城市人群的主要疾病和死亡原因之一。
目前倍受关注的代谢综合征(metabolic syndrome, MS)的核心问题在于胰岛素抵抗和高胰岛素血症,二者可通过如诱发高血压,引起糖代谢紊乱,脂代谢紊乱等多种途径导致并加速动脉粥样硬化,最终导致心血管疾病的发生。有专家提出毒性心脏病学,认为高游离脂肪酸血症引起心肌异位脂质沉积,可导致脂毒性心脏疾病。研究已经发现MS患者冠心病和脑血管的患病风险是非MS患者的3倍,死亡率则增加5~6倍[22]。Nikclas等的研究也显示,非冠心病人慢性心力衰竭的发病率与代表肥胖的一些指标呈明显正相关,提示肥胖是慢性心衰的高危因素。动物研究也显示,采用高脂饲料喂养造成的肥胖SD大鼠,在未合并有高血压、糖尿病等并发症的情况下,也出现了心功能损害。所以高MS患病率,预示着心血管病的发生率、致死和致残率也会相应增高,人群的健康状况令人担忧[23]。
不过,所幸的是MS可以为某些环境因素及人为的因素所控制,现有的研究发现,通过比如降低血脂等单项的干预措施可以减低心血管事件的发生。许多心脏疾病在发病早期,尚无临床表现时就己经发生心肌损伤的病理变化。而且不同程度的心肌损伤,对心脏疾病的诊断及预后的判断有较大影响。所以及早对肥胖及其伴随的高游离脂肪酸血症与冠心病心肌损伤程度的相关性进行研究势在必行,对有效地提高国民医疗健康水平有着深远的意义。
1.2 游离脂肪酸的测定方法
血清FFA的测定方法主要有滴定法、比色法、化学发光法、气相色谱和酶法,如表一所示。由于前两种方法准确性差,操作繁琐,除个别小医院以外已不再使用。另外,虽然目前有个别公司对比色法进行了改进,但是依然要手工操作,接触氯仿甲醇等有毒有机溶剂。而由于高效液相色谱仪和气相色谱法仪太昂贵,不便于批量操作。相对而言,酶法测定不但结果准确可靠快速,并且易于批量检测,因此目前一般多以酶法测定,可分别测定产物乙酰CoA、AMP或辅酶A(CoA),进行定量。
2 游离脂肪酸测定试剂盒的评价与检测
试剂盒的评价参考NCCLS制定的EP文件进行。主要对以下几个方面进行评价。
2.1 精密度
不精密度指在规定条件下获得的独立测量结果之间的接近程度。不精密度按条件不同可进一步分为:重复性、中间精密度、重现性。不精密度常用标准差或变异系数表示,精密度的内容包括了:批内不精密度,批间不精密度,日内不精密度,日间不精密度,总不精密度。
参照EP5A2[24],制定方案,给出了对定量测量方法的精密度性能进行系统评估的方法。
重复性评价:对两个浓度水平血清样品进行测定,连续测定20次。计算测定值的平均值( )和标准差(S批内)。按以下公式计算变异系数(CV批内),应CV批内≤10%。
室内不精密度评价:选择两个浓度水平的质控血清,每天测定两批(run),一批平行测定两次(replicate),持续20天(day),实验结束时,每个浓度水平,应收集80个数据。进行数据处理,计算得到批内标准偏差、室内标准偏差、R值、T值、重复性的卡方值,及室内不精密度的卡方值。
2.2 线性
参照EP6-A[25],制定方案,给出对定量测定方法的线性进行系统评估的方法。用超出线性范围上限活性的样品和超出或等于线性范围下限活性的样品,按比例精确配成等间距的不同浓度样本,混合成至少7~9个稀释浓度(xi)。分别测试试剂盒,每个稀释浓度测试3次,分别求出测定结果的均值(yi)。以稀释浓度(xi)为自变量,以测定结果均值(yi)为因变量求出线性回归方程。按公式计算线性回归的相关系数(r)。

2.3 检测限
参照EP17-A[26],制定方案,详细说明临床实验室测定空白限(LoB)、检测限(LoD)和定量限(LoQ)的方法。
空白限:即选择无分析物的样品为空白样本,重复多次作空白检测,以均值和标准差表示这些空白响应量的平均水平和所有的空白响应量对于空白均值的离散程度的指标。其计算公式为:
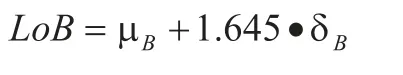
其中:
LoB:空白检测限。
μB:空白样品实测平均值。
σB:空白样品的实测标准差。
检测限:配制梯度稀释的低值浓度样本。对同一个总体的低值样本所有数据进行数据描述。根据图表判断其是否近似正态分布。如果不是正态分布,需要对数据进行转换,直至呈正态分布。
检测限需要进行以下运算:

其中:
f:SDS的自由度。
NS:样品测定的总数。
K:样品的梯度组数。
SDS:低值样本实测值的标准差。
定量限:检测系统能够得到可靠结果的北侧物最低浓度,其总误差符合实验室的要求。
推荐最少40个重复测量,对3~5个不同样本至少各作5批检测。如果使用一个样本,那么差异的均数和可接受的参考值之间的差异是偏差的估计,如果在同一水平使用多个样本,那么差异的均数是正确度的估计,一个样本40个重复测量的总标准差或多个样本的混合标准差(SDs)是精密度估计。综合这些估计值即可获得该水平下的总误差(TE)的估计值=偏差±2SDS,如果这个估计值小于设定的总误差目标,则LoD=LoQ。
2.4 相关性
参照EP-09A2[27],制定方案,给出临床生化诊断试剂盒相关性实验的方案。
相关性实验的样品来源于健康人或患者,无干扰,尽量避免储存;测定物浓度范围应在医学决定水平范围内均匀分布;样本数至少40例,以增加数量能提高可信性。
相关性实验中的对照方法应是厂家要求的实验室常规方法或公认的参考方法。方法本身应具有好的精密度,没有已知的干扰物,相对国家标准或参考方法的偏差是已知的,与实验方法有相同的单位。
每天分别用两种方法进行测定,每个浓度测定两遍,测定顺序如:1-n,n-1。测定次数:至少测定5天,至少40个样本。
对数据进行散点图和偏差图分析,剔除偏差超标的数据,并补充实验,以保障足够的例数。
对数据进行回归,回归系数R≥ 0.975(或R2≥ 0.95)。如果R2< 0.95,则必须试验加大样本量以扩大数据范围。
在医学决定水平(Xc)下,实验方法系统误差的置信区间与允许误差进行比较,如果95%的置信区间在允许误差内,则系统误差符合临床要求;如果95%的置信区间在允许误差外,则系统误差不符合临床要求。
3 结束语
尽管已有多种FFA检测试剂盒上市,但检测原理及方法各有不同,对疾病预测的灵敏度、特异度等指标不尽相同,尚缺乏对各种检测方法和不同试剂间的系统的方法学和诊断效能的评价。通过建立新的实验方法,并对FFA试剂盒进行测定,根据NCCLS相关文件,对方法进行精密度,线性,方法学比较的相关性等评价。
[1] 王顺.高游离脂肪酸血症是胰岛素抵抗在高血压发病机制中的作用环节之一[J]. 心血管病学进展, 2003, 3(23): 201.
[2] Plaisance V, Perret V, Favre D,et al.Role of the transcriptional factor C/EBPbeta in free fatty acid-elicited beta-cell failure[J].Mol Cell Endocrinol, 2009, 305(1-2): 47-55.
[3] 周新, 涂植光. 临床生物化学和生物化学检验[M]. 北京: 人民卫生出版社, 2006.
[4] 陈康, 母义明. 游离脂肪酸和代谢综合症[J]. 中华老年多器官疾病杂志, 2005, 4(1): 9-11.
[5] Yoshikawa H, Tajiri Y, Sako Y,et al.Effects of free fatty acids on β2cell functionsa possible involvement of peroxisome proliferators activated receptors α or pancreatic P duodenal homeobox[J].Metabolism, 2001, 50: 613-618.
[6] Mu Y M, Yanase T, Nishi Y,et al.Saturated FFAs,palmiticacid and stearic acid,induce apoptosis in human granulosacells[J].Endocrinology, 2001, 142: 3590-3597.
[7] 刘长锁, 申竹芳. 游离脂肪酸与胰岛素抵抗[J]. 中国药理学通报,2005, 21(2): 145-149.
[8] 李静, 邵亮. 2型糖尿病与血清游离脂肪酸水平的关系[J]. 实用临床医学, 2011, 12(2): 31-33.
[9] Diehl A M. Nonalcoholic steatohepatitis[J]. Semin Liver Dis, 1999,19: 221-229.
[10] Mc G J D. Dysregulation of fatty acid metabolism in the etiology of type 2 diabetes. Diabetes, 2002, 51(1): 7218.
[11] 孙虹云. 调脂治疗对改善胰岛β细胞功能的临床观察[J]. 实用全科医学, 2006, 4(2): 174-175.
[12] Boden G. Role of fatty acid in the pathogenesis of insulin resistance Mistmee and NIDDM [J]. Diabetes, 1997, 46: 3.
[13] 李翰卿, 宋微微. 游离脂肪酸与胰岛素抵抗关系的研究进展[J].医学研究生学报, 2012, 25(9): 981-983.
[14] Arner P.Insulin resistance in type 2 diabetes: role of fatty acids[J].Diabetes Metab Res Rev. 2002, 18 Suppl 2: S5-S9.
[15] Zhang Y, Xiao M, Niu G,et al.Mechanisms of oleic acid deterioration in insulin secretion: role in the pathogenesis of type 2 diabetes[J]. Life Sci, 2005, 77(17): 2071-2081.
[16] Boden G, Shulman G I. Free fatty acids in obesity and type 2 diabetes: de fi ning their role in the development of insulin resistance and beta-cell dysfunction.Eur J Clin Invest. 2002 , 32 (Suppl 3):14-23.
[17] 杨刚毅, 邱鸿鑫, 邓华聪, 等. NIDDM患者血浆游离脂肪酸含量及其于体重指数的关系[J]. 中国糖尿病杂志, 1997, 5 (2): 115.
[18] 沙国英. 肥胖与糖代谢. 临床合理用药[J]. 2010, 3(5): 18.
[19] 张奕, 刘戈力, 穆青, 等. 肥胖代谢综合征儿童游离脂肪酸与血糖代谢分析[J]. 天津医科大学学报, 2009(15), 2: 268-270.
[20] Bodenl G, Chen X, Ruf J,et a1.mechanisms of fatty acids induced inhibi.tion of glucose uptake[J]. J Clin EndocfinolMetab, 2001,86: 2153.
[21] Blaak E E. Fatty acid metabolism in obesity and type 2 diabetes mellitus[J]. Proc Nutr Soc, 2003, 62: 753-760.
[22] Oliver M F. Sudden cardiac death: the lost fatty acid hypothesis[J].QJM, 2006, 99: 701-709.
[23] Mozaffarian D. Free fatty acids,cardiovascular mortality, and cardiometabolic stress[J]. Eur Heart J,November 2, 2007, 28(22):2699-2700.
[24] EP5-A2. Vol. 24 No. 25. Evaluation of Precision Performance of Quantitative Measurement Methods[S], Approved Guideline-Second Edition.
[25] EP6-A. Vol. 23 No. 16. Evaluation of the Linearity of Quantitative Measurement Procedures: A Statistical Approach[S], Approved Guideline.
[26] EP17-A.Vol. 24 No. 34. Protocols for Determination of Limits of Detection and Limits of Quantitation[S], Approved Guideline.
[27] EP9-A2.Vol. 22 No. 19. Method Comparison and Bias Estimation Using Patient Samples[S], Approved Guideline-Second Edition.
