混合溶剂提取亚临界花生饼粕中蛋白及其性质的研究
2015-04-23张国治黄纪念
白 歌,张国治,黄纪念,芦 鑫
(1.河南工业大学 粮油食品学院,河南 郑州 450001;2.河南省农科院 农副产品加工研究所,河南 郑州 450002)
0 引言
花生一般含粗脂肪46%~53%、粗蛋白25%~30%,不仅是重要的油料资源,也是重要的蛋白资源[1].目前,我国花生消费的利用比例大致为:榨油50%~60%,直接作为原料加工成食品占15%~25%,而用于花生深加工的只占10%左右[2].制油过程中会产生大量的花生饼粕,主要用作饲料、肥料,其中的蛋白资源未得到充分利用.花生蛋白质具有较高的营养价值,是一种完全蛋白,含有人体必需的8 种氨基酸,而且其功能性与大豆蛋白接近,但比大豆蛋白质更易于吸收[2].
制备花生蛋白的方法有:碱溶酸沉、水酶法和醇洗等.但由于现有的制油工艺中存在高温、高压处理,花生蛋白会发生一定程度的变性,水溶性降低,限制了花生蛋白的提取和后续利用.新兴的亚临界萃取制油技术为制备低变性花生蛋白奠定了基础.亚临界流体萃取相比其他分离方法的最大优点是非热加工,对热敏性物质破坏小.作者以亚临界萃取花生油的副产品花生粕为原料,用混合溶剂洗脱掉小分子可溶性糖和残油,通过优化混合溶剂制备蛋白的工艺,得到高纯度的蛋白产品,并分析混合溶剂制备亚临界花生蛋白和碱溶酸沉法制备花生蛋白的功能性差异.
1 材料和方法
1.1 主要材料和试剂
亚临界花生粕:由河南省农业科学院亚临界设备制得,以液化气为萃取剂,在亚临界状态下,固定萃取次数3 次,萃取条件为:压力1.0 MPa,温度50 ℃,料液比1∶3,萃取时间2 h,固液分离后得到亚临界花生粕,组成见表1.

表1 亚临界花生粕的化学组分Table 1 Chemical composition of subcritical peanut meal
高温花生分离蛋白(High temperature peanut protein,HTPP):以高温花生粕为原料,加入水使料液比为1 ∶9,调节pH 为9.0,采用 60 ℃水浴1 200 r/min 搅拌90 min 后,5 000 r/min 离心30 min,弃去沉淀.在上清液中加入2 mol/L HCl 溶液至pH值稳定在4.5,磁力搅拌1 200 r/min 至混合均匀,5 000 r/min 离心30 min,回收沉淀,冷冻干燥,样品低温密封保存.样品中粗蛋白含量为85.56%,残油率4.89%.
天然花生分离蛋白(Natural peanut protein,NPP):以脱脂后的天然花生为原料,料液比1∶9,60℃水浴,加入2 mol/L NaOH 溶液使pH 值稳定在9.0,1 200 r/min 搅拌90 min 后,5 000 r/min 离心30 min,留取上层溶液.在上层溶液中加入2 mol/L HCl 溶液至pH 值稳定在4.5,磁力搅拌1 200 r/min 至混合均匀,5 000 r/min 离心30 min,倒掉上层溶液,冷冻沉淀,冻干后备用.粗蛋白含量84.69%,残油率5.78%.
亚临界花生粕二次醇洗蛋白 (Peanut protein prepared by double ethanol washing,PPEW):以亚临界花生粕为原料,料液比1∶16,水浴40 ℃,1 200 r/min 搅拌30 min,以V正己烷:V乙醇∶V水=5∶16∶4 为混合溶剂浸提两次,然后5 000 r/min 离心30 min,上层溶液回收备用,挥发下层沉淀中残留的有机溶剂,经过冻干备用.粗蛋白含量为65.39%,残油率0.45%.
无水乙醇、正己烷、硫酸、硫酸钾、硫酸铜、硼酸、盐酸等试剂均为分析纯:天津市致远化学试剂有限公司.
1.2 主要试验设备和仪器
全自动凯氏定氮仪:上海晟声仪器有限公司;DF-101S 集热磁力加热搅拌器:金坛市医疗仪器厂;DGX-9243 型鼓风干燥箱:上海福玛实验设备有限公司;DL-5-B 离心机:上海安亭科学仪器厂;XS205 电子天平:瑞士梅特勒-托利多公司.
1.3 方法
1.3.1 混合有机溶剂提取制备花生蛋白
称取一定量经粉碎过80 目的亚临界花生粕置于圆底烧瓶中,配比定量的正己烷-水-乙醇溶液进行洗脱并进行1 200 r/min 磁力搅拌30 min,经过5 000 r/min 离心30 min 后,弃去上清液,固体通过真空干燥机60 ℃干燥得到浓缩花生蛋白,密封低温保存.根据相关研究和前提试验已知,料液比、提取液组成、提取温度和时间是影响蛋白提取效果的重要因素[3],所以以花生蛋白的纯度和提取率为评价指标,将以上4 个因素采用二水平试验设计,分析不同条件对花生蛋白的纯度和提取效果的影响.样品中蛋白含量和提取率的计算见公式(1)和(2).

四因素二水平试验的结果表明,液料比为显著因素,为此对液料比进行单因素试验:选取提取温度40 ℃,提取液组分比(正己烷∶80%乙醇)2.13,提取时间30 min 时,考察当选用不同液料比10∶1、12∶1、14∶1、16∶1、18∶1、20∶1 时,花生蛋白的纯度和提取率.
为了分析提取液组成对花生蛋白提取的影响,采用正己烷(X1)、乙醇(X2)和水(X3)组分0~100%的全范围混料试验.
1.3.2 花生饼粕成分测定方法
粗蛋白测定参照GB/T 14489.2—2008,转换系数为5.46;粗脂肪测定参照GB/T 14772—2008;水分测定参照GB 5009.3—2010;灰分测定参照GB 5009.4—2010;NSI 测定参照AACC International Method 46—23;非氮化合物测定采用还原法,非氮化合物=(1-水分-灰分-粗蛋白-粗脂肪)×100%.
1.3.3 吸水性的测定
分别准确称取含0.5 g 花生蛋白的HTPP、NPP、PPEW,加入10 mL 蒸馏水,搅拌均匀,室温下放置30 min,2 000 r/min 离心10 min,去除澄清水,称质量.吸水性为每克蛋白结合水的克数[5].
1.3.4 吸油性的测定
分别准确称取含2.0 g 花生蛋白的HTPP、NPP、PPEW,加入8 mL 一级大豆油,搅拌5 min,3 000 r/min 下离心20 min,弃去上层未吸附油,称质量.吸油性为每克蛋白吸附油脂的克数[5].
1.3.5 乳化性及乳化稳定性的测定
分别准确称取含3.0 g 花生蛋白的HTPP、NPP、PPEW,溶解于50 mL 蒸馏水中,调节pH 至7.0,加入50 mL 一级大豆油,以10 000~12 000 r/min均质2 min,移入50 mL 离心管中,在1 500 r/min下离心5 min,根据乳化层高度计算乳化性,见公式(3).然后置于50 ℃水浴中静置30 min,用自来水冷却至室温,在1 500 r/min 下离心5 min,记录乳化层高度和总体高度,计算乳化层稳定性[5-6],见公式(4).


1.3.6 起泡性及起泡稳定性的测定
分别准确称取含1.0 g 花生蛋白的HTPP、NPP、PPAW 溶于50 mL、pH 7.0 磷酸缓冲液,搅拌10 min,用组织捣碎器10 000 r/min 搅打2 min,立刻倾入150 mL 量筒,记录其总体积,按公式(5)计算膨胀率.间隔30 min 后再记录其总体积以及泡沫体积[7-8],按公式(6)计算泡沫稳定性.


1.3.7 试验数据处理
无特殊说明,试验平行测定3 次.采用MINITAB 16 和SAS 9.2 进行数据处理,显著水平为0.1,高度显著水平为0.05.
2 结果与分析
2.1 提取条件对花生蛋白提取效果的影响
以液料比、提取液组成、提取时间和提取温度为考察因素,花生蛋白纯度和提取率为评价指标的四因素二水平试验设计和结果见表2,方差分析见表3.
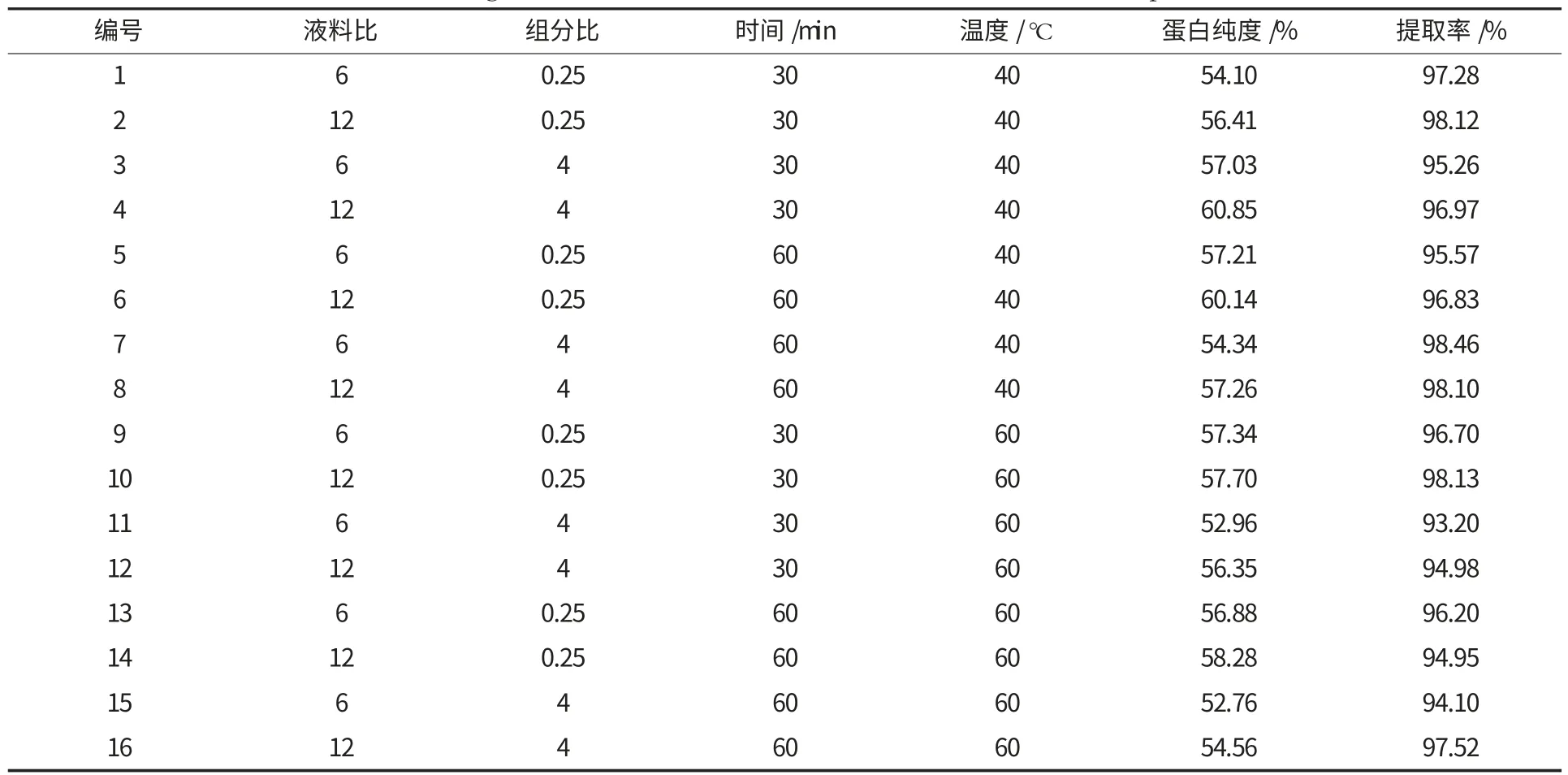
表2 四因素二水平试验的设计及结果Table 2 Design and results of the four factors and two levels experiment
由表3 可知,蛋白纯度模型显著(p=0.071<0.1),这表明四因素二水平试验的结果可以真实客观反映实际结果.当分析因素影响时,发现液料比和组分比为显著影响因素,且液料比的影响(p=0.016)要强于组分比的影响(p=0.076),而提取时间和提取温度为非显著影响因素.同时,蛋白提取率模型显著(p=0.085<0.1),说明四因素二水平试验的结果可以真实客观反映蛋白提取率的变化情况.分析因素影响时,发现液料比和温度为显著影响因素,并且温度的影响(p=0.049)要强于液料比的影响(p=0.072),提取时间和组分比为非显著影响因素.
液料比和组分比对花生蛋白纯度的影响见图1(a),固定液料比,单独增加提取液中正己烷的比重会降低花生蛋白的纯度,这是由于正己烷浓度过高不利于花生饼粕在提取液中的分散,从而削弱脱脂效果,且高正己烷组成会使提取液极性太弱,导致花生饼粕中糖类等极性物质不溶于提取液中,从而降低了花生蛋白的纯度.固定组分比,增加液料比可以提高花生蛋白的纯度,显然这是由于高的液料比意味着提取液体积更大,有利于形成更大的浓度梯度,促进油脂、糖类进入提取液中,从而提高花生蛋白的纯度.液料比和提取温度对花生蛋白提取率的影响见图1(b),固定液料比,提高提取温度降低了花生蛋白的提取率,由于提高温度有利于蛋白溶解,导致更多的蛋白质进入提取液中,所以降低了花生蛋白提取率.固定提取温度,增加料液比可以提高花生蛋白的提取率,因为增加液料比可以洗掉更多的残油和小分子糖,所以提高了花生蛋白的提取率.

表3 四因素二水平试验的方差分析Table 3 Variance analysis of the four factors and two levels experiment
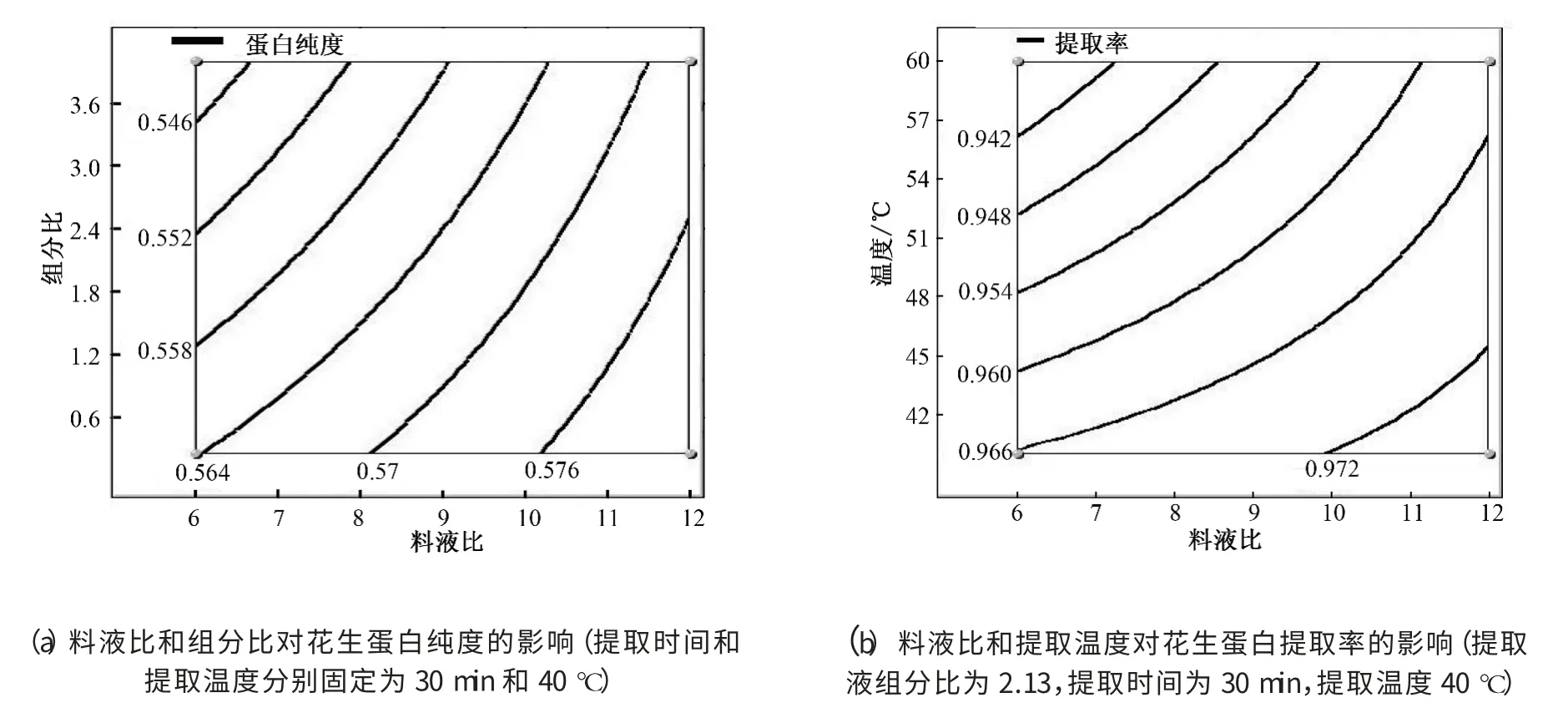
图1 料液比、组分比和温度对醇提亚临界花生饼粕中蛋白的影响Fig.1 Effect of liquid to material ratio,component ratio and temperature on protein extraction from subcritical peanut meal by the mixed solvent
2.2 液料比单因素试验
四因素二水平试验的结果表明,液料比从6到12 过程中,增加液料比有利于提高蛋白纯度,因此在液料比单因素试验中,考察更大液料比对花生蛋白提取的影响,即液料比取10∶1、12∶1、14∶1、16∶1、18∶1、20∶1,结果见图2.

图2 液料比对花生蛋白纯度和提取率的影响Fig.2 Effect of liquid to material ratio on peanut protein purity and extraction rate
由图2 可知,当液料比从10 增加到14 的过程中,花生蛋白纯度上升;随后继续增加液料比,蛋白纯度虽然也在增加,但增加幅度趋于平缓.通过单因素方差分析发现,液料比大于14 以后无显著性差异.随着液料比的增加,提取率先增大后减小,方差分析发现液料比为12、16 与14 时无显著性差异.因此,兼顾蛋白提取率和纯度,液料比选取1∶16,粗蛋白含量为59.25%,提取率为98.34%.
2.3 提取液组成对花生蛋白提取的影响
因为四因素二水平试验中,组分比不够全面,所以考察提取液中正已烷、乙醇、水所占比重分别从0~100%的混料回归试验.试验设计及结果见表4,方差分析见表5、表6.
由表4 可知,本试验中影响因素是3 个组分含量,蛋白纯度的相关系数R2=0.894,蛋白纯度的回归方程高度显著(p<0.05),表明可以客观反映出3 个组分对花生蛋白纯度的影响.花生蛋白纯度的回归方程式如下:

表4 混料回归试验设计与结果Table 4 Regression experiment design and results
Y1=53.29X1+51.68X2+14.85X3-14.42X1X2-12.18X1X3+67.19X2X3+380.24X1X2X3.
花生蛋白提取率的相关系数R2=0.964,提取率的回归方程高度显著(p<0.05),说明这3 个组分可以反映出对花生蛋白提取率的影响,花生蛋白提取率的回归方程如下:
Y2=96.2X1+92.2X2+10.8X3-17.6X1X2-127.9X1X3+520.5X1X2X3.
从表5 可知,线性部分和二次项、立方项分布高度显著(p<0.05),表明混合溶剂组成会对花生蛋白纯度有显著影响.在交互作用中乙醇×水和正己烷×乙醇×水为高度显著,正己烷×乙醇和正己烷×水不显著.这表明水和乙醇的交互影响较大.
由表6 可知,线性和二次项分布高度显著,说明3 个组分对花生蛋白的提取率有显著影响.二次项中除了正己烷×乙醇以外均为高度显著.
为了得到更高的蛋白纯度,利用MINITAB 响应优化器,最佳组分比为正己烷∶乙醇∶水为0.25∶0.49∶0.26,花生蛋白纯度60.62%,提取率97.05%.再进行验证试验,花生蛋白纯度为(60.34±0.29)%,提取率(96.89±0.31)%,由此可见采用混料试验优化得到的醇洗提取蛋白工艺准确可靠,具有实用价值.
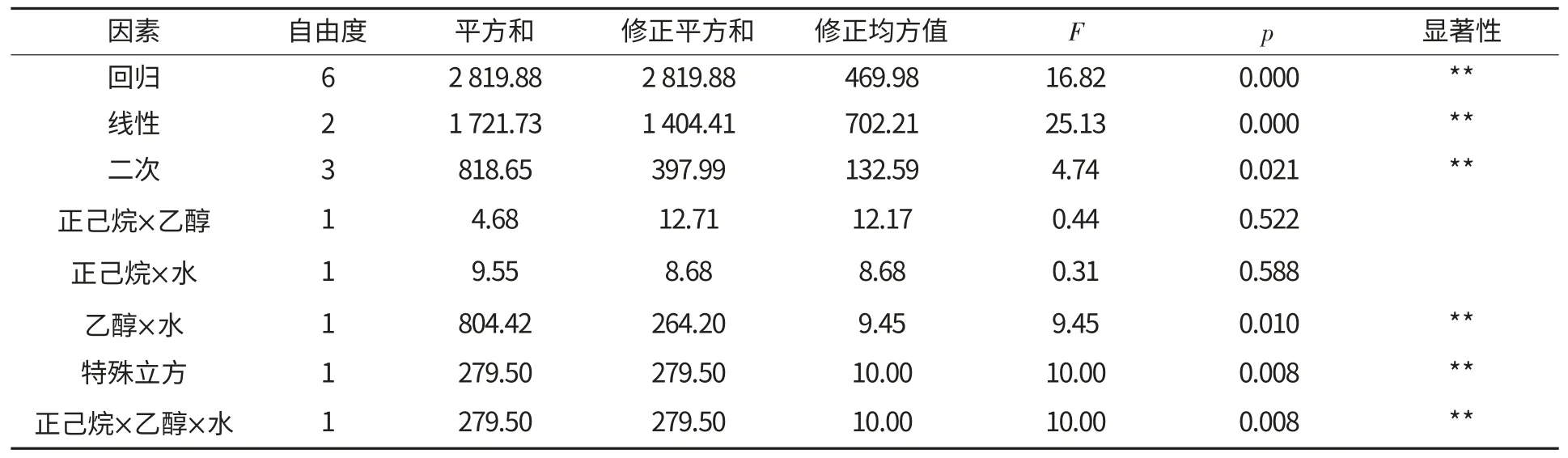
表5 花生蛋白纯度的回归方程的方差分析Table 5 Variance analysis of regression equation of peanut protein purity
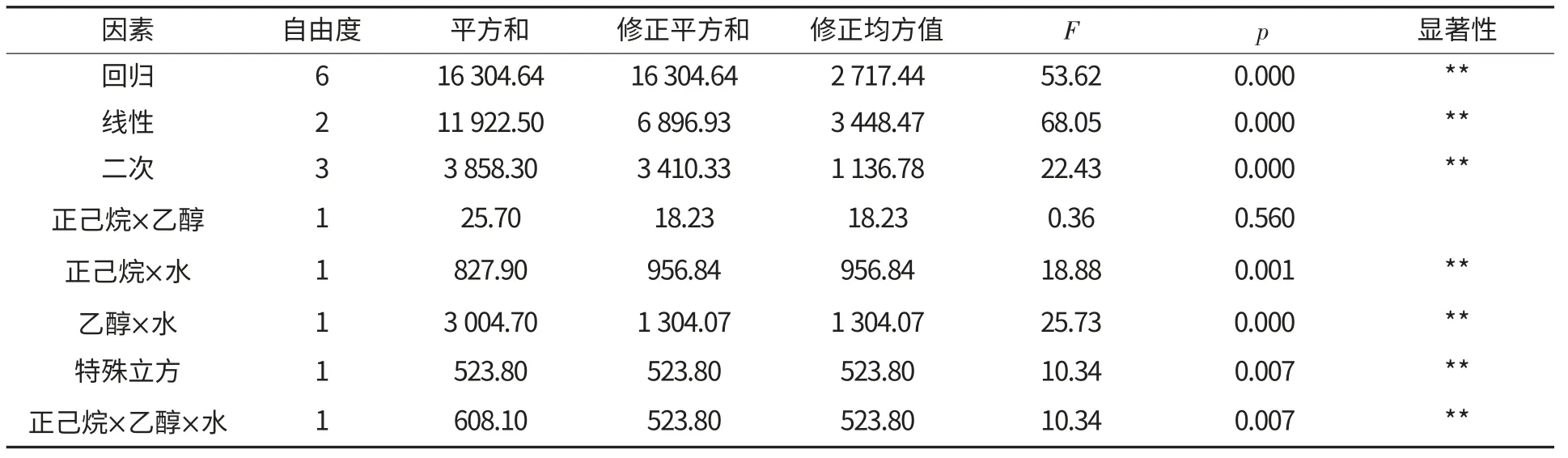
表6 花生蛋白提取率的回归方程的方差分析Table 6 Variance analysis of regression equation of peanut protein extraction rate
本试验一次醇洗就能达到与刘玉兰等[9]相似的结果,表明适宜的三元混合溶剂提高了除去花生蛋白中杂质的效率.本试验减少了混合溶液的使用量,缩短了提取时间,简化了提取工艺,降低了生产成本,有利于推动醇洗花生蛋白产业的发展.
2.4 不同蛋白的功能性的比较
分析高温花生粕碱溶酸沉提蛋白、天然花生碱溶酸沉提蛋白和亚临界花生粕醇洗制备蛋白的功能性质差异,试验结果见表7.
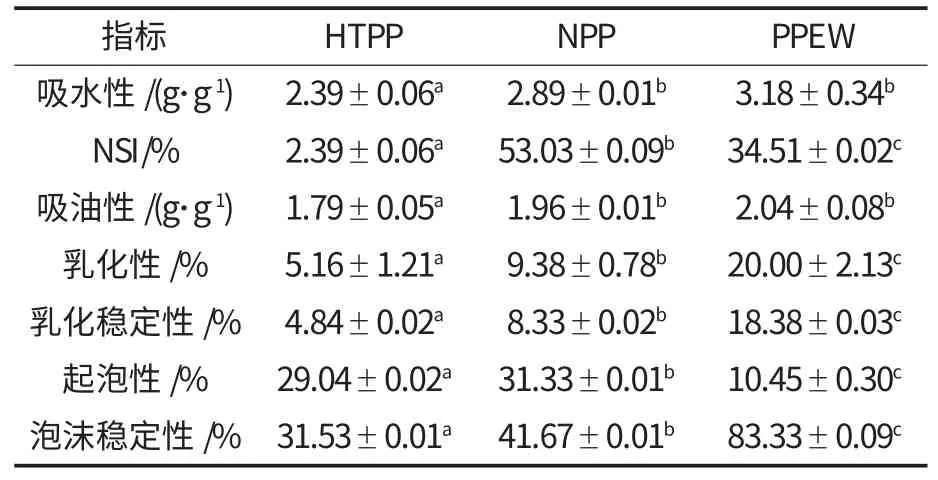
表7 不同蛋白的功能性比较Table 7 Functions comparison of different proteins
从表7 可知,在吸水性的检测中,HTPP 的吸水性最弱,这是因为高温会导致疏水基团的暴露,导致HTPP 的吸水性最弱;NPP 和PPEW 经过方差分析无明显差异.在NSI 的检测中,HTPP 的NSI 较低,是因为经过高温处理,花生蛋白变性程度较大,水溶性下降,造成NSI 较低,同时高温能促成二硫键的断裂,形成疏水性的巯基.PPEW 的NSI低,可能是因为高浓度乙醇改变了PPEW 的次级结构,破坏了PPEW 中原有的氢键,导致NSI 降低[10].
在吸油性的检测中,HTPP 的吸油性最弱,可能因为在高温过程中蛋白不可逆转的变性,破坏了疏水基团,使HTPP 的吸油性最弱;NPP 和PPEW 经过方差分析无明显差异.在乳化性及其稳定性的检测中,HTPP 的乳化性最弱,是因为在高温过程中亲水基团和疏水基团被破坏,降低了其在油相和水相中形成乳化液的能力;PPEW 的乳化性及其稳定性优于NPP.起泡性及泡沫稳定性的检测中,NPP 的起泡性好,PPEW 的起泡性最弱,泡沫稳定性与其负相关.
3 结论
以亚临界萃取制油的副产品花生粕为原料,用混合溶剂制备蛋白,混合溶剂组分最佳配比为正己烷∶乙醇∶水=0.25∶0.49∶0.26,液料比16∶1,温度为40 ℃,浸提时间30 min,在此条件下一次醇洗的蛋白纯度为60.62%(干基),提取率97.05%,比较多次醇洗的方法,本试验优化得出的一次醇洗工艺,有节约成本、减少对环境破坏的优点,而且更加适合产业化生产.
亚临界花生粕混合溶剂制备的蛋白在功能性上与碱溶酸沉法制备的蛋白进行比较,结果为:两者有着相同能力的吸水性和吸油性,亚临界花生粕混合溶剂制备的蛋白有较强的乳化性,但溶解度较低.
[1]王瑞元.2007 年的中国油脂工业及油脂市场[J].中国油脂,2008,33(3):1-3.
[2]裴剑慧,王强,周素梅.我国花生蛋白资源的开发与利用[J].粮油加工与食品机械,2005(12):53-55.
[3]刘玉兰,高经梁,马宇翔,等.花生饼粕制取醇洗蛋白的品质的比较[J].粮油食品科技,2013,21(3):57-61.
[4]刘大川,张维农,胡小泓.花生蛋白制备工艺和功能性的研究[J].武汉工业学院学报,2001(4):1-3.
[5]刘玉兰,王莎莎,汪学德,等.混合溶剂醇洗芝麻浓缩蛋白的加热改性研究[J].中国油脂,2014,39(1):15-18.
[6]郭兴凤,慕运动,阮诗丰,等.不同测定方法对大豆分离蛋白乳化性测定结果的影响[J].食品研究与开发,2007,28(2):129-131.
[7]李秀凉,王璋.酶解对芝麻蛋白功能性质的影响[J].黑龙江大学自然科学学报,2005,22(1):130-133,137.
[8]王璋,许时婴,汤坚.食品化学[M].北京:中国轻工业出版社,2011:163-164.
[9]刘玉兰,张晓丽,杜蘅.冷榨花生饼混合溶剂萃取生产浓缩蛋白工艺条件的研究[J].粮油加工,2009(12):83-86.
[10]Yu Jianmei,Mohamed Ahmedna,Ipek Goktepe.Peanut protein concentrate:Production and functional properties as affected by processing[J].Food Chenmistry,2007,107(1):121 -129.
