挤压超声联用提取的米糠多糖分离纯化研究
2015-04-21肖志刚
肖志刚, 李 杰, 王 鹏, 李 哲
(1.沈阳师范大学 粮食学院, 沈阳 110034; 2.东北农业大学 食品学院, 哈尔滨 150030;3.中粮肉食(山东)有限公司, 山东 潍坊 261000)
挤压超声联用提取的米糠多糖分离纯化研究
肖志刚1,2, 李 杰3, 王 鹏1,2, 李 哲2
(1.沈阳师范大学 粮食学院, 沈阳 110034; 2.东北农业大学 食品学院, 哈尔滨 150030;3.中粮肉食(山东)有限公司, 山东 潍坊 261000)
以米糠多糖粗液为原料,采用乙酸锌-亚铁氰化钾法、TCA法和Sevag法3种方法脱除米糠多糖中的蛋白质。试验结果表明:采用乙酸锌-亚铁氰化钾法除蛋白的效果要好于Sevag法和三氯乙酸法,蛋白脱除率为87.9%,多糖损失率为17.5%。采用超滤技术分离纯化得到不同组分米糠多糖,并分别命名为RBS-Ⅰ、RBS-Ⅱ、RBS-Ⅲ,3个组分得率分别为:43.1、38.5、18.7。对3种多糖组分进行抗氧化活性筛选,RBS-Ⅱ最为显著,超氧自由基清除率为25.7%,羟基自由基清除率为47.6%,总抗氧化能力为81.4 U/mL。
米糠多糖; 脱蛋白; 超滤技术; 抗氧化性
0 引 言
我国是以大米为主食的国家,年产稻谷约2亿吨,如以6%的出糠率计算,则我国年产米糠将达到1 200万吨左右,居世界之首。但是米糠是一种产量大、综合利用价值还不高的农副产品[1],所以对米糠进行深加工,提高其附加值具有重要意义。
米糠中存在着多种类型的多糖,其组分和结构也各不相同,具有广泛的生物活性[2],在抗肿瘤、增强免疫力以及降脂效应等方面有显著的功效,可用作制药原料或保健营养品的开发[3-5]。用水提取多糖,常含有一定量的蛋白质[6],因此脱除米糠多糖中的蛋白质是多糖分离纯化的重要步骤,可以有效提高多糖的生物活性。米糠中存在多种分子量的多糖,其组分和活性也各不相同,依据分子量的不同对其进行分离,可以获得高活性的米糠多糖。
本研究在前期团队的实验基础上,以挤压超声联用提取的米糠多糖粗液为原料[7],分别采用Sevag法、三氯乙酸法、亚铁氰化钾-乙酸锌法3种方法进行米糠多糖脱蛋白研究,并对比研究这几种方法的脱除蛋白效果和多糖损失情况,从而筛选出米糠多糖的最佳脱蛋白方法,然后利用超滤分离方法实现不同分子量米糠多糖的分离,通过体外抗氧化活性实验,从分级纯化后的多糖组分中筛选出活性最强组分,并对其进行纯度鉴定和理化性质研究。本研究从分子量大小角度筛选活性多糖是多糖分离纯化的重要方法,为米糠多糖实现产业化提供理论支撑和基础数据,并为后续米糠多糖结构研究提供重要依据。
1 材料与方法
1.1 材料、试剂与仪器
米糠多糖粗液:采用本课题组已经研究的“挤压超声联用提取米糠多糖”最佳工艺参数制得的米糠多糖粗液[7],米糠多糖得率7.18%。
试剂与仪器:氯仿,北京化学试剂公司;正丁醇,武汉江北化学试剂厂;三氯乙酸,成都科龙化学试剂厂;ABTS自由基清除能力检测试剂盒,南京建成生物工程研究所;大孔树脂AB-8,上海摩速科学器材有限公司;咔唑,上海化学试剂总厂;葡萄糖醛酸,上海伯奥生物科技有限公司;亚铁氰化钾,上海瑞齐生物科技有限公司;乙酸锌,武汉江北化学试剂厂;VFD-2000真空冷冻干燥机,上海比郎仪器有限公司;流变仪,英国马尔文仪器公司;K-360凯氏定氮仪,江瑞士buchi;Labscale TTF System小型切向超滤系统,美国Millipore公司;Biomax Polyethersulfone小型超滤膜包,美国Millipore公司; TU-1800紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 米糠多糖脱蛋白研究
以多糖损失率和蛋白脱除率(%)为衡量指标,并比较几种脱蛋白方法对米糠多糖的作用效果:1)Sevag 法[8];2)三氯乙酸法[9];3)亚铁氰化钾-乙酸锌法。
1.2.2 米糠多糖的超滤分离[10-11]
选用截留分子量为10万、3万和1万的超滤膜对多糖提取液进行截留,分别获得大于10万、3~10万、1~3万的3份多糖样品液,舍弃1万以下的样品液,再分别将3分样液冷冻干燥,重复浓缩循环操作。
1.2.3 体外抗氧化活性实验筛选活性多糖组分[12]
对超滤分离的3个样品,进行体外抗氧化活性实验,对比筛选出活性最强的一组样品进一步分离纯化,继续后续试验。
1) 米糠多糖对超氧阴离子自由基清除能力的测定。
2) 米糠多糖清除羟自由基活性能力测定。
3) 总抗氧化能力的测定。
1.2.4 米糠多糖纯度鉴定
将米糠多糖配置一定浓度的多糖样品溶液,再用微孔过滤膜过滤,去2 mL样品溶液过Sephadex G-100柱,然后用水溶液洗脱,每管10 mL,用硫酸-苯酚法跟踪检测,在490 nm波长下测得的吸光值对洗脱管数作图,得到洗脱曲线。
1.2.5 米糠多糖组成成分及理化性质分析
1) 中性糖含量测定,见文献[13]。
2) 糖醛酸含量测定,以葡萄糖醛酸为标准样品制作标准曲线,采用硫酸咔唑法测糖醛酸的含量。
3) 蛋白质含量测定,见文献[14]。
4) 米糠多糖理化性质分析[15-18]。
2 米糠多糖分离纯化研究
2.1 米糠多糖脱蛋白研究
2.1.1 Sevag法
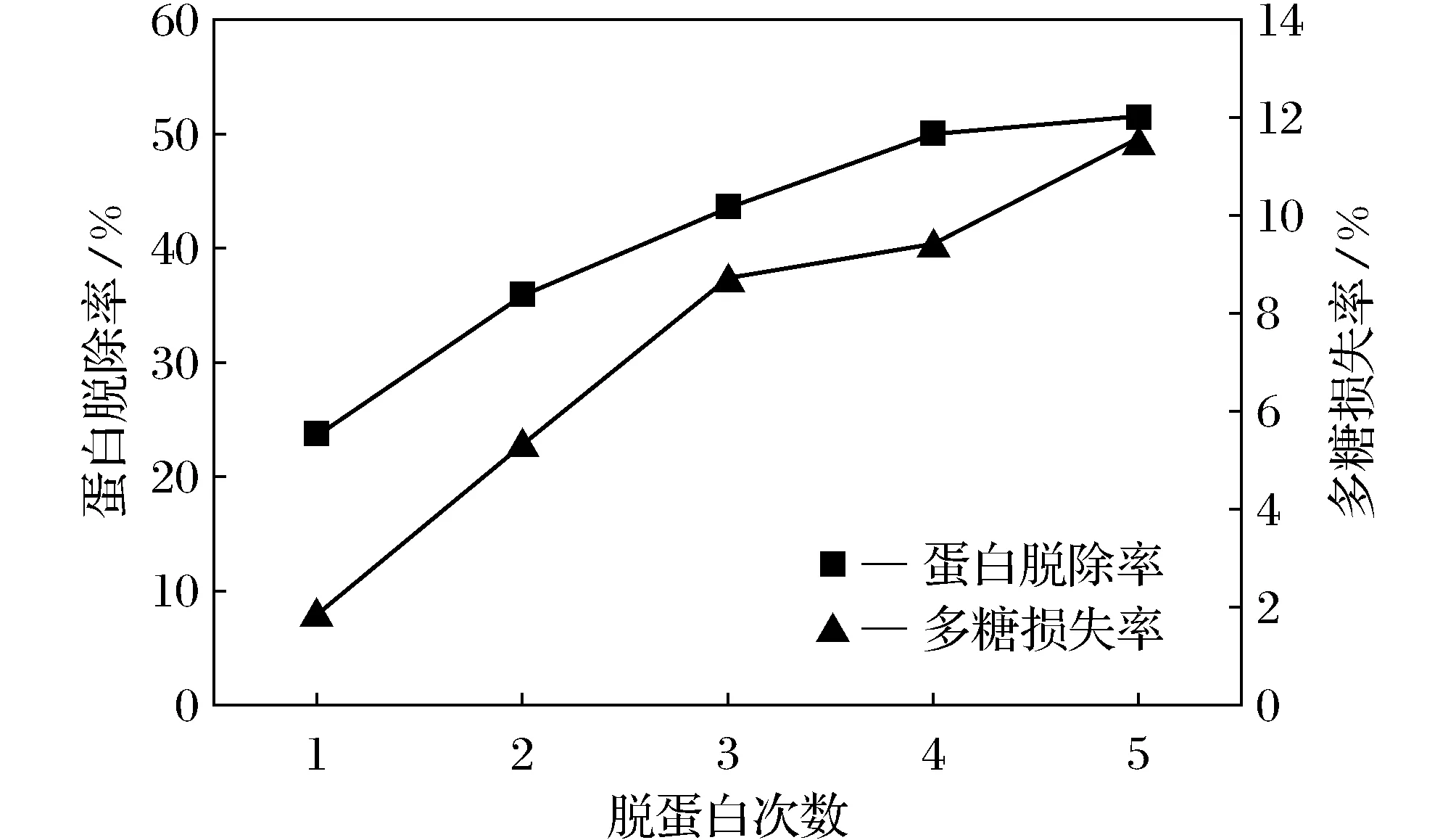
图1 Sevag 法脱蛋白效果
由图1可见,蛋白脱除率随操作次数的增加而增加,4次脱蛋白操作后脱除率即可达到50%左右,但多糖损失率也会相应增加,分析原因可能是由于试验中每次去除蛋白质的变性胶状物时,不可避免地携带了部分多糖。董英等人、王升平等人的研究也得出这样的结论[19-20],另外还有一些与蛋白质相结合的糖蛋白与蛋白聚糖在处理过程中有可能会沉淀下来,这些都是有可能造成多糖损失的原因。同时,重复操作都会在试验器壁上存在挂壁损失,所以操作步骤越多最终的损失就会越大,这也是一方面的原因。
2.1.2 三氯乙酸法
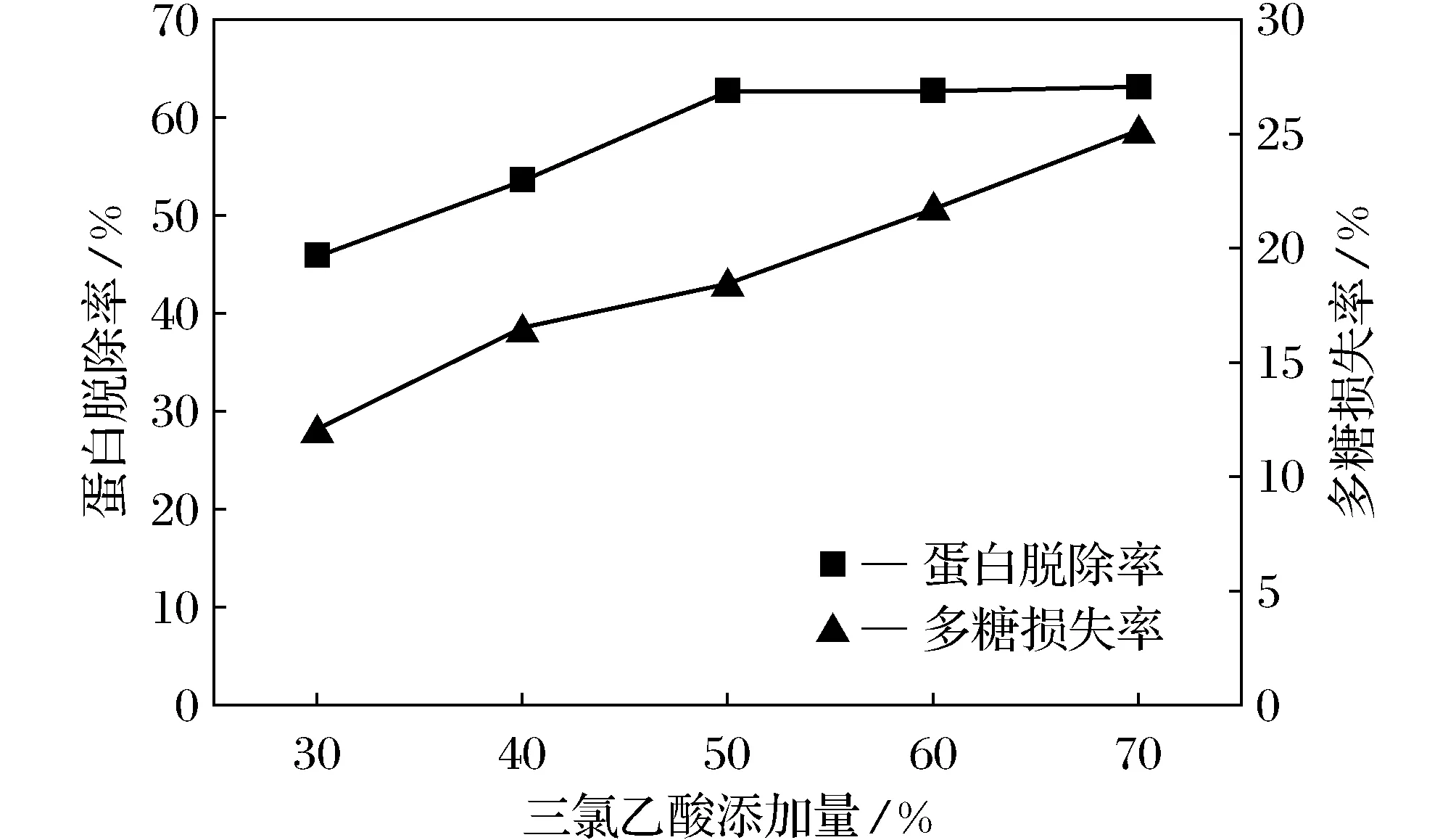
图2 三氯乙酸法脱蛋白效果
如图2所示,随着多糖提取液中三氯乙酸浓度的增加,蛋白质脱除率呈现先增加后减小的趋势,而多糖损失率则逐渐增大。当三氯乙酸添加量达到糖液体积50%时,糖液中蛋白去除率达到62.8%,多糖损失率达到18.4%。这是因为多糖在酸性环境中,糖苷键容易被破坏断裂,多糖发生降解呈小分子片段,因此,随三氯乙酸浓度的增加,多糖提取液中多糖得率较少、损失较严重。综合考虑蛋白脱除率和多糖损失率,确定选用等体积添加浓度为50%的三氯乙酸溶液。此结果和他人的研究结果相吻合[21-23],可以作为脱蛋白的一种常用方法。
2.1.3 亚铁氰化钾-乙酸锌法

图3 亚铁氰化钾-乙酸锌法脱蛋白效果
如图3所示,随亚铁氰化钾-乙酸锌添加量的增多,蛋白质去除率呈现先增加后减小的趋势,而多糖损失率则逐渐增大。蛋白去除试剂浓度为0.6%时,糖液中蛋白脱除率达到87.9%,多糖损失率达到17.5%。这是因为随亚铁氰化钾-乙酸锌添加量的不断增加,蛋白质与试剂结合发生沉淀的速度会加快,从而会发生沉淀不完全现象,导致蛋白的脱除率反而下降。而多糖在浓度较大的有机溶剂里会发生结构降解,所以随亚铁氰化钾-乙酸锌添加量的不断增加,多糖的损失率加大。综合考虑蛋白脱除率和多糖损失率,选择0.6%的亚铁氰化钾-乙酸锌添加量,此时蛋白质的脱除效果较好,而多糖的损失率也很低。亚铁氰化钾-乙酸锌是一种比较温和的试剂,对多糖结构的破坏不太严重。
2.1.4 3种脱蛋白方法的比较

图4 3种脱蛋白方法对比
由图4可见,3种方法都能在一定程度上达到脱除蛋白的效果,但3种方法也都会导致多糖有一定程度上的损失。单从蛋白脱除率上看,亚铁氰化钾-乙酸锌法的蛋白脱除效果较好,从多糖损失率上分析,Sevag法的多糖损失率较低。从试剂方面选择,三氯乙酸在操作过程中存在一定的危险性,对皮肤腐蚀较严重,对眼睛也具有一定危害,同时试剂使用量较大,从而提取成本就会增加。而亚铁氰化钾和乙酸锌试剂的危险性小,使用量也很小,提取成本较低。Sevag法操作较复杂,蛋白脱除率低于另外2个方法,同时会增加蛋白脱除实验时间。从综合角度考虑,选择亚铁氰化钾-乙酸锌法对米糠多糖提取液进行脱蛋白处理效果最好。
2.2 米糠多糖超滤分离
超滤分离,是指以压力差作为动力,超滤膜会对组分物质进行过滤,组分中分子量大的物质就会被截留,而溶剂和小分子物质则很容易透过。
超滤得到分子量为1万~3万、3万~10万和10万以上3种米糠多糖样品,分别命名为RBS-Ⅰ、RBS-Ⅱ、RBS-Ⅲ。本实验对比了挤压联合超声提取和热水浸提2种米糠多糖提取工艺所得米糠多糖的超滤分离结果(热水浸提多糖简称为WRBS,挤压超声提取多糖简称为URBS)。

图5 2种提取方法多糖所占比例
如图5所示,WRBS中分子量大于10万的占多糖总量的24.8%,分子量在3万~10万的多糖占36.4%,而URBS中分子量大于10万的占多糖总量的18.7%,分子量在3万~10万的多糖占38.2%。URBS中分子量大于10万的多糖要比WRBS有所减少,而分子量在10万以下的有所增加。这可能因为挤压、超声处理对多糖结构的物理破碎作用[24],使得多糖降解成较小分子量的多糖。但对于有些分子量高其活性就高的多糖,则不宜采用超声提取。所以多糖的提取是个很复杂的工艺,提取工艺决定最终的多糖样品品质。
2.3 米糠多糖的体外抗氧化活性实验
2.3.1 米糠多糖对超氧阴离子自由基清除能力的测定
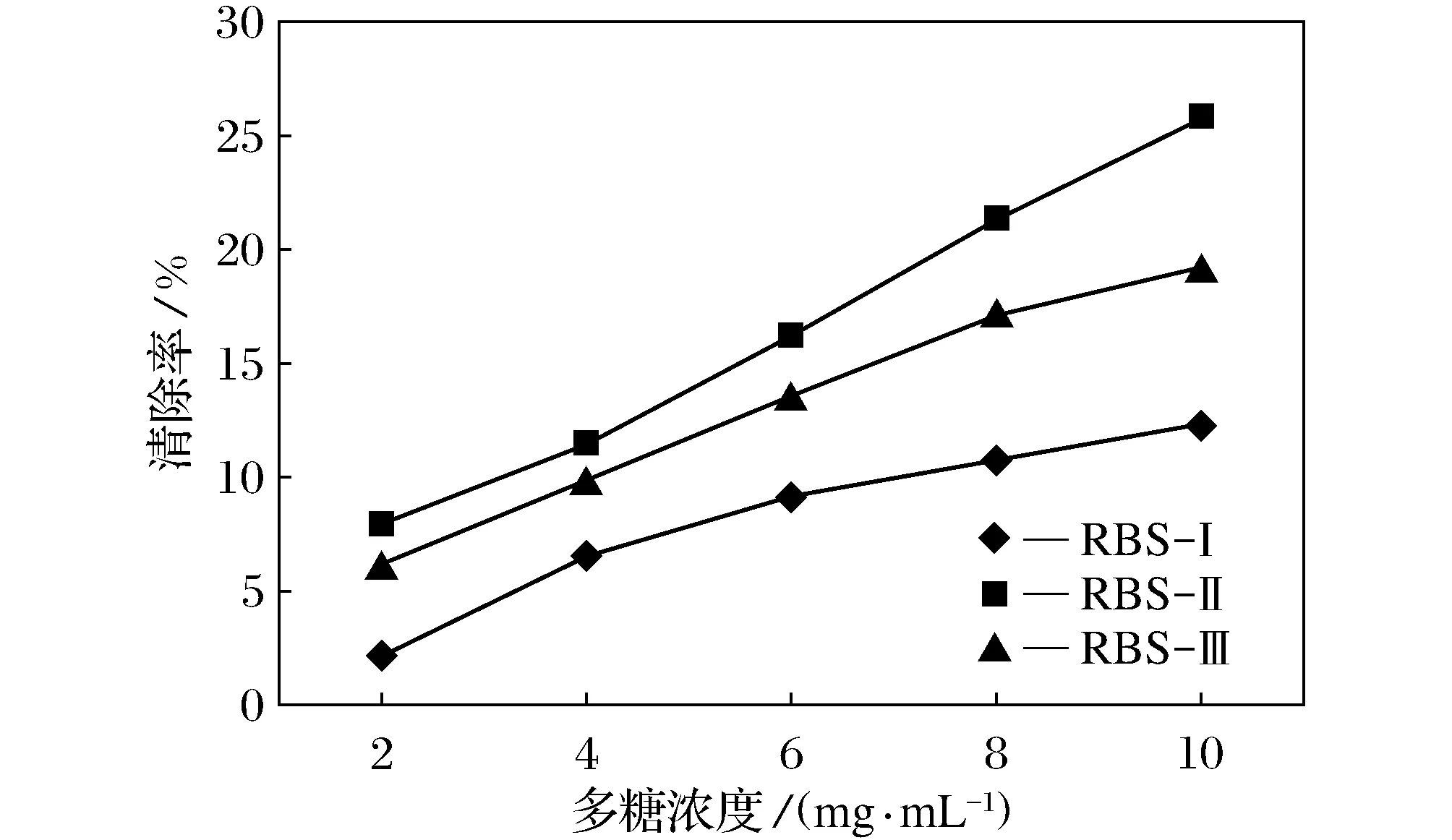
图6 米糠多糖对超氧自由基的清除能力
图6给出了不同分子量的米糠多糖对超氧阴离子自由基清除能力的结果。3种分子量大小的米糠多糖都对超氧自由基具有一定的清除能力,因此本实验是一种择优的过程。随着多糖浓度的升高,对超氧阴离子自由基的清除能力也在明显提高。在多糖浓度为10 mg/mL时不同分子量的米糠多糖的清除率都达到最大,其中RBS-Ⅰ对超氧自由基的清除率为12.4%,RBS-Ⅱ对超氧自由基的清除率为25.7%,RBS-Ⅲ对超氧自由基的清除率为19.3%,可见,RBS-Ⅱ的清除能力最强,RBS-Ⅲ次之。对超氧自由基的清除率随多糖溶液浓度的增加而增加,这是因为多糖浓度越大,单位体积内清除自由基的有效因子就会越多,分子与分子之间的碰撞可能性就越大,最终的活性也越高,这有些类似于酶的作用原理。而多糖浓度太高,则会造成多糖的浪费,因此需要选择合适的多糖浓度进行研究。
2.3.2 米糠多糖清除羟自由基活性能力测定
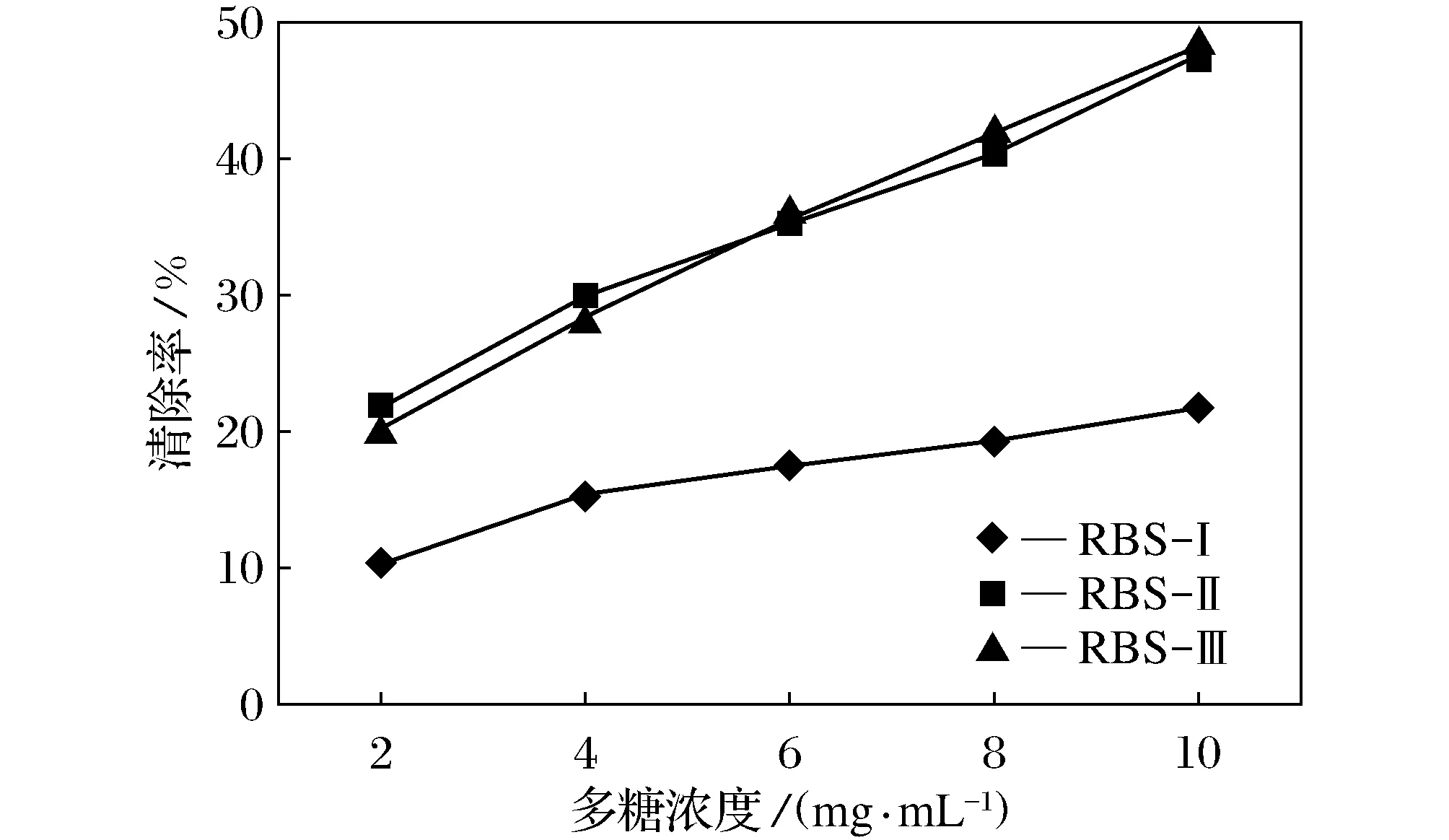
图7 米糠多糖对羟自由基清除能力
如图7所示,3种不同分子量大小的米糠多糖对羟基自由基均具有一定的清除能力,研究结果表明,随着多糖浓度的增大,3种多糖的清除能力随之增大,呈现一种线性关系,质量浓度在10 mg/mL时3个多糖样品对羟基自由基的清除率都达到最高,RBS-Ⅱ与RBS-Ⅲ对羟自由基清除能力相当,分别为47.6%和48.3%,RBS-Ⅰ对羟自由基清除能力较低为21.7%。
2.3.3 米糠多糖总抗氧化能力的测定
如图8所示,3种不同分子量大小的米糠多糖均具有一定的总抗氧化能力作用,研究结果表明,随着多糖浓度的增加,3种多糖的总抗氧化能力也增大,呈现一种线性关系,总抗氧化能力有显著差异[26]。质量浓度在10 mg/mL时3个多糖样品的抗氧化能力都达到最高,RBS-Ⅱ与RBS-Ⅲ的抗氧化能力相当,分别为79.8 U/mL和81.4 U/mL,RBS-Ⅰ的总抗氧化能力较低为58.9 U/mL。
2.3.4 3种米糠多糖样品筛选
RBS-Ⅰ、RBS-Ⅱ、RBS-Ⅲ 3种多糖样品在质量浓度为10 mg/mL时的体外抗氧化值进行对比分析,结果见图9。
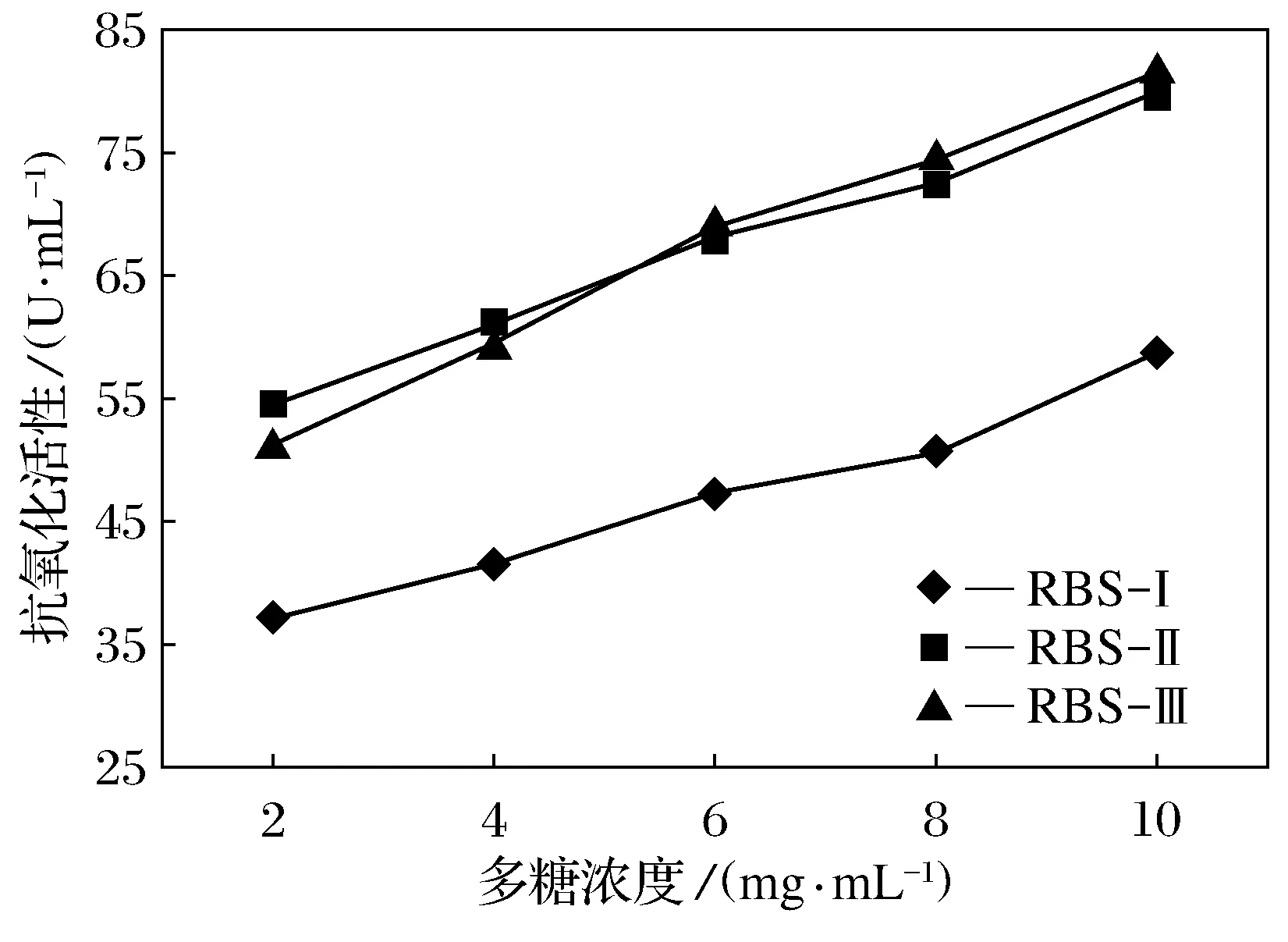
图8 总抗氧化能力试验结果

图9 3种多糖样品的抗氧化活性对比
如图9所示,3种多糖溶液中,RBS-Ⅱ清除超氧阴离子的能力较强,可达25.7%,强于其他2种分子量多糖的清除能力;RBS-Ⅱ与RBS-Ⅲ清除羟自由基的能力相当,但均强于RBS-Ⅰ的清除能力;总抗氧化活性试验表明,分子量较大的多糖溶液比分子量小的活性高;米糠多糖清除羟自由基的能力要比清除超氧阴离子的能力强;本实验侧重于对米糠多糖的一种抗氧化活性进行研究,这将为米糠多糖作为生理活性物质在保健食品领域的开发利用提供了理论依据。
从超滤分离结果和体外抗氧化试验结果显示,3种不同分子量的米糠多糖所占的比例不同,其体外抗氧化活性也有较大的差异。因此,仅从所占比例或抗氧化活性角度考察对米糠多糖活性的成分开发,可能会存在一定的缺陷。故本研究采用“所占比例×抗氧化活性”作为米糠多糖组份筛选的依据,该成绩越大,开发利用价值越大。所得结果如表1所示。
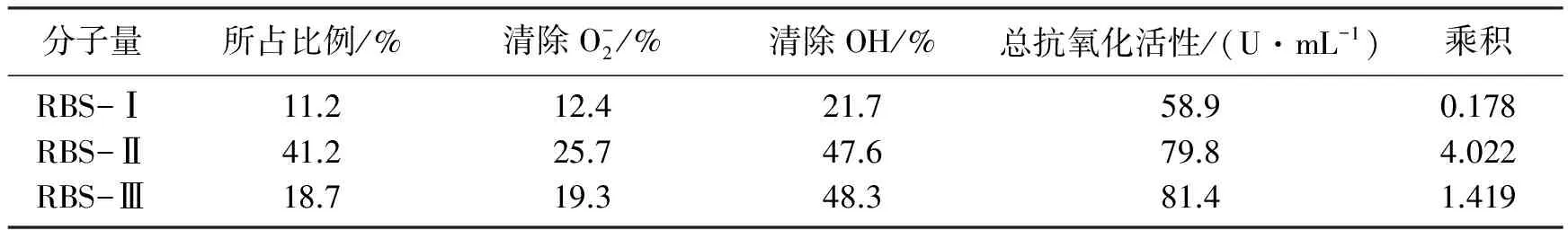
表1 不同分子量米糠多糖的开发利用价值

图10 RBS-Ⅱ在Sephadex G-100层析柱上的色谱图
由表1可得:RBS-Ⅱ的最终成绩结果明显高于其他2种米糠多糖,所以选择RBS-Ⅱ多糖样品进行后续试验。
2.4 纯度鉴定
如图10所示,米糠多糖RBS-Ⅱ经Sephadex G-100凝胶柱层析,洗脱曲线并非为单一对称峰,证明米糠多糖RBS-Ⅱ不是是单一组份。但是也有一个相对主峰,纯度相对较高。
2.5 米糠多糖RBS-Ⅱ组成成分及理化性质分析

表2 米糠多糖RBS-Ⅱ的组成成分 %
多糖RBS-Ⅱ为黄宗色粉末状固体,易溶于水,不溶于乙醇、乙醚、丙酮等有机溶剂。RBS-Ⅱ多糖的基本理化性质如表2所示:碘反应为阴性,说明多糖中没有有力的淀粉颗粒。但是不排除有淀粉包裹粒。硫酸-咔唑反应程阳性,说明含有一定量的糖醛酸残基,为后续试验提供了一个证明。菲林试剂和三氯化铁反应为阳性说明不含有还原糖,因为在试验过程中有很多的降解反应,会产生大量的还原糖,所以这项指标的检测很重要,也是一个纯度的验证。三氯化铁反应为阳性说明不含有多芬类物质坏。考马斯亮蓝反应为阴性,说明不含有游离的蛋白质成分,但是不能排除有没有糖蛋白结合物。在后续试验中会验证这一疑虑。

表3 米糠多糖RBS-Ⅱ的理化性质
将米糠多糖RBS-Ⅰ、RBS-Ⅱ、RBS-Ⅲ配成20%的多糖溶液,用流变仪测定3个多糖样品的表观粘度;并参照文献方法,测定其溶解度。测定结果见表4。

表4 3种多糖组份的粘度和溶解度
多糖的粘度主要是由多糖分子间的氢键相互作用和多糖分子量大小共同决定的,它与溶解度在一定程度上程负相关。多糖粘度也是临床药效发挥的关键因素,如果粘度过高,不利于药物的扩散与吸收。有些药物多糖因粘度过高,无法进行临床使用,后经部分降解,粘性减小,但仍保持原有活性,已供临床使用。
一般认为,多糖溶于水是发挥其功能活性的基本条件。大量试验证明:通过适当的溶剂处理,可使不溶于水的茯苓多糖变成易溶于水的活性多糖,同时其抗肿瘤活性也增强。
多糖的粘度和溶解度共同说明了多糖分子量过大或过小,其功能活性都较低,本实验从分子量大小来筛选活性多糖是多糖分离纯化的重要方法,为米糠多糖实现产业化提供理论支撑和基础数据。
3 结 论
对比Sevag法、三氯乙酸法和乙酸锌-亚铁氰化钾3种脱蛋白的方法,研究得出:乙酸锌-亚铁氰化钾法蛋白脱除率高达87.9%。综合考虑选择乙酸锌-亚铁氰化钾法进行脱蛋白。通过对米糠多糖的纯化分离和体外抗氧化试验筛选得出:RBS-Ⅱ的活性比其他2个较高一些,开发利用价值较大,可作为后续结构探究对象。由于超滤截留只是对多糖的初步纯化,所得多糖的纯度不是太高,纯度鉴定时含有2个较大波峰,通过紫外扫描含有蛋白质波峰,但考马斯亮蓝反应为阴性,所以判定存在糖蛋白。
[1]王丽英,王立,姚惠源.米糠多糖提取与纯化的研究[J].粮油加工, 2006(12):65-68.
[2]张潇艳.米糠多糖的提取、纯化及结构研究[D].无锡:江南大学, 2008.
[3]TANIGAMI Y.Partial degradation and biological activities of ananti-tumor polysaccharide from rice bran[J].Chem Pharm Bull, 1991,39(7):1782-1787.
[4]YAMAGISHI T, TSUBOI T, KIKUCHI K, et al.Potent naturalimmunomodulator, rice water-soluble polysaccharide fractions with anti-comp lementary activity[J].Cereal Chem, 2003,80(1):5-81.
[5]毕晋明,王永军.米糠多糖的生物学活性研究及应用前景[J].兽药与饲料添加剂, 2006,11(1):21-22.
[6]张潇艳,陈正行,王莉.米糠多糖的脱蛋白研究[J].食品工业科技, 2008,29(3):163-165.
[7]李杰,罗志刚,肖志刚,等.挤压超声联用提取米糠多糖工艺优化[J].农业机械学报, 2013,44(3):174-179.
[8]HUANG Chun, GAO Xiangdong, PANG Xiubing, et al.Isolation, purification, composition and activity of Ganoderma Lucidum polysaccharide[J].Europe PubMed Central, 2005,26(4):221-223.
[9]GAN Lu, ZHANG Shenghua, YANG Xiangliang, et al.Immunomodulation and antitumor activity by a polysaccharide-protein complex from Lycium barbarum[J].Int Immunopharmacol, 2004,4(4): 563-569.
[10]叶红,周春宏,曾晓雄,等.马尾藻多糖的膜分离纯化[J].湖北农业科学, 2011,50(2):375-377.
[11]陈淑华,张淑平,杜秀秀,等.褐藻糖胶脱蛋白及脱色方法研究[J].湖南农业科学, 2011(7):92-95.
[12]XIE Zhengjun, HUANG Junrong, XU Xueming, et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chem, 2008,111(2):370-376.
[13]DUBOIS M, GILLES K A, HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem, 1956,28:350-356.
[14]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem, 1976,72:248-254.
[15]KLEEREBEZEM M, KRANENBURG R van, TUINIER R, et al.ExoPolysaccharides produced by Lactococcus lactis: From genetic engineering to in proved rheological properties[J].Antonie Van Leeuwenhoek, 1999,76(1/4):357-365.
[16]汪海波,徐群英.水溶性米糠多糖的溶液流变学性能研究[J].粮食与饲料工业, 2007(11):27-29.
[17]奚光兴.苦瓜藤多糖的分离纯化及理化性质和单糖组成研究[D].南昌:南昌大学, 2013.
[18]莫开菊,程超,彭浩.葛仙米多糖溶解性和流变特性的研究[J].中国酿造, 2009(3):39-42.
[19]董英,张艳芳,孙艳辉.水飞蓟粗多糖脱蛋白方法的比较[J].食品科学, 2007,28(12):82-84.
[20]方升平,王维香,雒小龙.川芎多糖除蛋白方法研究[J].时珍国医国药, 2009,20(9):2176-2177.
[21]刘志刚,颜仁梁,罗佳波.白花蛇舌草多糖除蛋白工艺研究[J].中华中医药学刊, 2008,26(10):2283-2284.
[22]陈红,张波,刘秀奇,等.超声波辅助提取水溶性大豆多糖及纯化工艺[J].食品科学, 2011,32(6):139-142.
[23]马利华,秦卫东,陈学红,等.膜技术分离纯化牛蒡多糖的研究[J].食品工业科技, 2009,30(1):231-233.
[24]王世清,于丽娜,杨庆利,等.超滤膜分离纯化花生壳中水溶性膳食纤维[J].农业工程学报, 2012,28(3):278-282.
[25]RIVAL S G, BOERIU C G ,WICHERS H J.Casein and casein hydrolysates.2.Antioxidative properties and relevance to lipoxygenase inhibition[J].J Agric Food Chem, 2001,49:295-302.
[26]韩飞,周孟良,钱健亚,等.抗氧化剂抗氧化活性测定方法及其评价[J].粮油食品科技, 2009,17(6):54-55.
Research on separation and purification of rice bran polysaccharide extracted by extrusion in conjunction with ultrasound
XIAOZhigang1,2,LIJie3,WANGPeng1,2,LIZhe2
(1.College of Grain Science and Technology, Shenyang Normal University, Shenyang 110034, China;2.College of Food Science, Northeast Agricultural University, Harbin 150030, China;3.COFCO carnivorous (Shandong) Co.Ltd., Weifang 261000, China)
In this paper, the crude rice bran polysaccharides as the material was studied that the removal of the rice bran polysaccharides protein in it by the mothed of Sevag, Trichloroacetic acid and Zinc acetate-Potassium ferrocyanide.The results indicated that the effect of removal protein by zinc acetate-the potassium ferrocyanide is better than the Sevag and trichloroacetic acid method, most of the protein is removed and protein removal rate is 87.9%, polysaccharides loss rate is 17.5% by zinc acetate-the potassium ferrocyanide.Ultrafiltration technology was used to separate and purify Polysaccharide into three components.The three components were respectively named RBS-Ⅰ, RBS-Ⅱ, RBS-Ⅲ, and their polysaccharides yield were 43.1, 38.5, 18.7.The anti-oxidation of the three fraction polysaccharide was Screened, the result indicated that RBS-Ⅱ and RBS-Ⅲ activity are higher, and RBS-Ⅱ is the most significant.scavenging rate of superoxide radical was 25.7%, hydroxyl radical scavenging rate is 47.6, and the total antioxidant capacity is 81.4 U/mL.
rice bran polysaccharides; removal of protein; ultrafiltration technology; antioxidant ability
2014-10-20。
“十二五”农村领域国家科技支撑计划项目(2012BAD34B02); 黑龙江省教育厅科学技术研究重点项目(12511z006); 哈尔滨市优秀学科带头人基金资助项目(2012RFXXN107)。
肖志刚(1972-),男,黑龙江庆安人,沈阳师范大学教授,博士,东北农业大学博士研究生导师。
1673-5862(2015)01-0047-07
TS210.9
A
10.3969/ j.issn.1673-5862.2015.01.011
