达乌尔黄鼠白色脂肪组织中多不饱和脂肪酸合成基因表达
2015-04-21门丽媛宋士一
门丽媛, 刘 帅, 于 超, 宋士一, 彭 霞, 杨 明
(1. 沈阳师范大学 化学与生命科学学院, 沈阳 110034;2. 沈阳师范大学 实验教学中心, 沈阳 110034)
达乌尔黄鼠白色脂肪组织中多不饱和脂肪酸合成基因表达
门丽媛1, 刘 帅1, 于 超1, 宋士一1, 彭 霞2, 杨 明1
(1. 沈阳师范大学 化学与生命科学学院, 沈阳 110034;2. 沈阳师范大学 实验教学中心, 沈阳 110034)
多不饱和脂肪酸对哺乳动物细胞膜的结构和功能、免疫能力、脂肪代谢等具有重要的调控作用。为研究其在冬眠动物体内合成受基因表达调控的情况,使用第2代转录组测序技术,对达乌尔黄鼠(Spermophilus dauricuricus)的白色脂肪组织进行转录组测序,得到羟酰基辅酶A还原酶、烯酰辅酶A脱氢酶、Δ-5去饱和酶和Δ-6去饱和酶的碱基序列,并测得它们在起始育肥期、快速育肥期、育肥完成期和冬眠期4个阶段的差异表达情况。结果显示:羟酰基辅酶A还原酶在冬眠期表达上调,与起始育肥期差异显著;烯酰辅酶A脱氢酶在冬眠期的表达量也显著高于起始育肥期和快速育肥期;Δ-5去饱和酶和Δ-6去饱和酶在起始育肥期高表达。表明达乌尔黄鼠体内多不饱和脂肪酸的合成存在着基因表达的调控,可能以此来实现在不同生理时期对细胞膜流动性和免疫能力的调节。
达乌尔黄鼠; 多不饱和脂肪酸; 基因表达
0 引 言
多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)是指含有2个或更多个双键的长链脂肪酸。根据第1个不饱和键位置不同,PUFA可分为ω-3、ω-6、ω-7、ω-9等系列,如距羧基最远端的双键是在倒数第3个碳原子上的称为ω-3多不饱和脂肪酸。哺乳动物细胞内缺乏能够在脂肪酸碳链第9个碳之后引入双键的酶,所以,动物体内所需的不饱和脂肪酸需要从食物中摄取α-亚麻酸(α-Linolenic acid, ALA)和亚油酸(linoleic acid, LA)合成。ALA和LA是在体内合成其他PUFA的前体物质,通过一系列的延长酶与脱氢酶的作用合成二十碳五烯酸(eicosapentaenoic acid, EPA)、二十二碳六烯酸(docosahexaenoic acid, DHA)、三烯前列腺素等其他多不饱和脂肪酸[8-9],在此合成过程中细胞内质网上的Δ-5去饱和酶和Δ-6去饱和酶扮演着重要的作用[10]。
PUFA是细胞膜磷脂的重要组成成分,决定了细胞膜的流动性和变形性[1],在维护细胞膜的结构和功能方面有着重要的作用[2], 因此也对免疫细胞的免疫能力产生影响[3-5]。同时,PUFA与其代谢物能在细胞水平上通过与核受体或转录因子结合来对机体的不同组织进行基因表达的调控[6],从而发挥其广泛的生物学功能,包括细胞内信号传导通路[7]、细胞凋亡的调控、脂肪酸的代谢等。以往关于多不饱和脂肪酸功能的研究多采用在动物的日粮中添加饲喂的方法,例如对啮齿动物的实验发现,日粮添加PUFA 4天后脂肪酸合成酶(fatty acid synthetase, FAS)和6-磷酸葡萄糖脱氢酶(glucose-6-phosphogluconate dehydrogenase, G-6-PD)的活性明显降低[11],并且硬脂酰辅酶A去饱和酶1(stearly CoA desaturase 1, SCD1)、乙酰辅酶A羧化酶(acetyl CoA carboxylase, ACC)、L-型丙酮酸激酶(Ltype pyruvate kinase, L-PK)、Δ-5去饱和酶、Δ-6去饱和酶、G-6-PD、肝脏中胰岛素敏感性葡萄糖载体GLUT-4等基因的表达受到抑制[12]。给大鼠饲喂共轭亚油酸(conjugated linoleic acid, CLA),发现能够增强其腹膜巨噬细胞的吞噬能力[13]和杀伤能力[14]。低剂量短期喂食DHA或EPA可以改变小鼠脾淋巴细胞的膜脂质成分和细胞功能[15]。用多不饱和脂肪酸含量较高的鱼油饲喂的大鼠与其他组相比,母鼠和幼鼠的淋巴细胞表面的抗原分子CD25、CD54、CD28、CD56明显增加[16]。免疫细胞膜上这些分子的表达增加,增强了T细胞和NK细胞的活性,提高了机体的免疫能力。
然而,目前关于动物体内自身的多不饱和脂肪酸合成情况的研究却鲜有报道,本研究使用冬眠动物达乌尔黄鼠 (Spermophilus dauricus)为实验动物,达乌尔黄鼠隶属松鼠科黄鼠属,是典型的贮脂类冬眠动物,目前已经是研究冬眠的优良模式动物。本研究组使用转录组测序的方法,检测其多不饱和脂肪酸合成相关基因的编码序列及在动物体重年周期变化的不同阶段的基因差异表达情况,初步探索多不饱和脂肪酸在动物体内受主动调控的合成情况及对贮脂类冬眠动物在冬眠前的育肥准备阶段和冬眠阶段可能产生的影响。
1 材料和方法
1.1 实验动物
达乌尔黄鼠20只(♀)于2012年5月捕自内蒙古通辽(43.37°N, 122.16°E),在沈阳师范大学动物房内单笼饲养,饲养笼大小48 cm×35 cm×20 cm,用碎刨花做巢材,自然温度和光照,入眠后,放入5±2 ℃低温房内。动物喂以标准鼠饲料(沈阳市于洪区前民动物饲料厂),水、食自取。
1.2 体重测量
使用精度为0.01 g电子天平每周称量一次动物的体重。
1.3 取材与保存
根据动物体重的变化,分为起始育肥期(initial-fattening, I-F)(6月)、快速育肥期(rapid-fattening, R-F)(7月)、育肥完成期(finished-fattening, F-F)(8~9月)和冬眠期(hibernation, H)(10月~次年3月)4个阶段进行取材,每阶段5只动物(♀)。动物用CO2麻醉,然后断颈处死(冬眠组动物直接处死),取腹腔内白色脂肪组织(white adipose tissue, WAT)置于离心管中,液氮速冻,低温冰箱(-80 ℃)保存。
1.4 基因差异表达分析
1.4.1 转录组测序
将4个阶段的所有样本的WAT分别提取总RNA,同阶段个体的RNA等量混合后,加热使之打开二级结构后用带有Oligo(dT)的磁珠富集mRNA。向得到的mRNA中加入适量打断试剂,高温条件下使其片断化,再以片断后的mRNA为模板,合成cDNA,经过磁珠纯化、末端修复、3′末端加碱基A、加测序接头后,进行PCR扩增, 从而完成该物种WAT转录组文库的构建。构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System进行质量和产量检测,文库质控合格后使用Illumina HiSeqTM2000进行测序。
1.4.2 基因表达量与差异表达分析
对原始数据进行筛选,去除adaptor和低质量序列(质量值Q≤5的碱基数占整个read的50%以上)得到Clean reads。对Clean reads做测序评估,统计基因表达量(RPKM值),得到差异检验的FDR值(假阳性率),并根据基因的表达量计算该基因在不同组样本间的差异表达倍数。差异表达基因定义为FDR≤0.001且倍数差异在2倍以上(|log2Ratio|≥1)的基因。基因表达量的计算公式为
其中:RPKM为基因A的表达量;C为唯一比对到基因A的reads数;N为唯一比对到参考基因的总reads数;L为基因A的碱基数。
1.4.3 序列比对与功能分析
将差异表达基因比对到NCBI上做GO功能分析并作KEGG Pathway分析。
2 实验结果
2.1 延长酶基因表达变化
达乌尔黄鼠WAT中羟酰基辅酶A脱氢酶的基因表达量在起始育肥期、快速育肥期、育肥完成期及冬眠期分别为24、30、41、66。冬眠期明显高于起始育肥期,差异显著(图1)。烯酰辅酶A还原酶在4个时期的表达量为31、33、77、111。起始育肥期与快速育肥期无差异,但显著低于冬眠期(图2)。
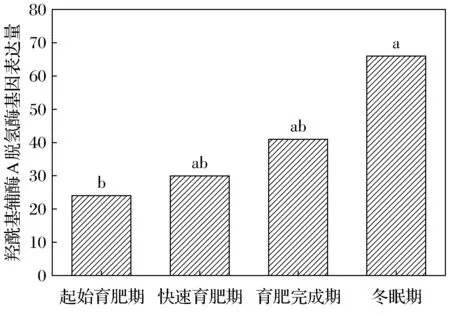
不同字母表示差异显著,FDR≤0.001, |log2Ratio|≥1。
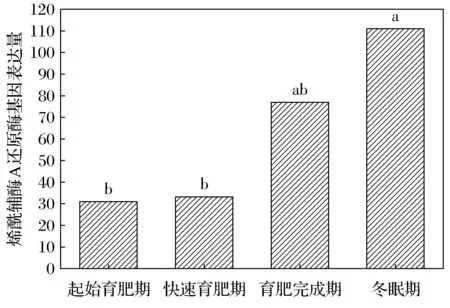
不同字母表示差异显著,FDR≤0.001, |log2Ratio|≥1。
2.2 去饱和酶基因表达变化
达乌尔黄鼠WAT中Δ-5脱氢酶的基因表达量在起始育肥期、快速育肥期、育肥完成期及冬眠期分别为87、71、34、42。起始育肥期与快速育肥期无明显差异,但显著高于育肥完成期和冬眠期(图3)。Δ-6脱氢酶的基因表达量分别为383、193、199、233。起始育肥期显著高于快速育肥期和育肥完成期(图4)。
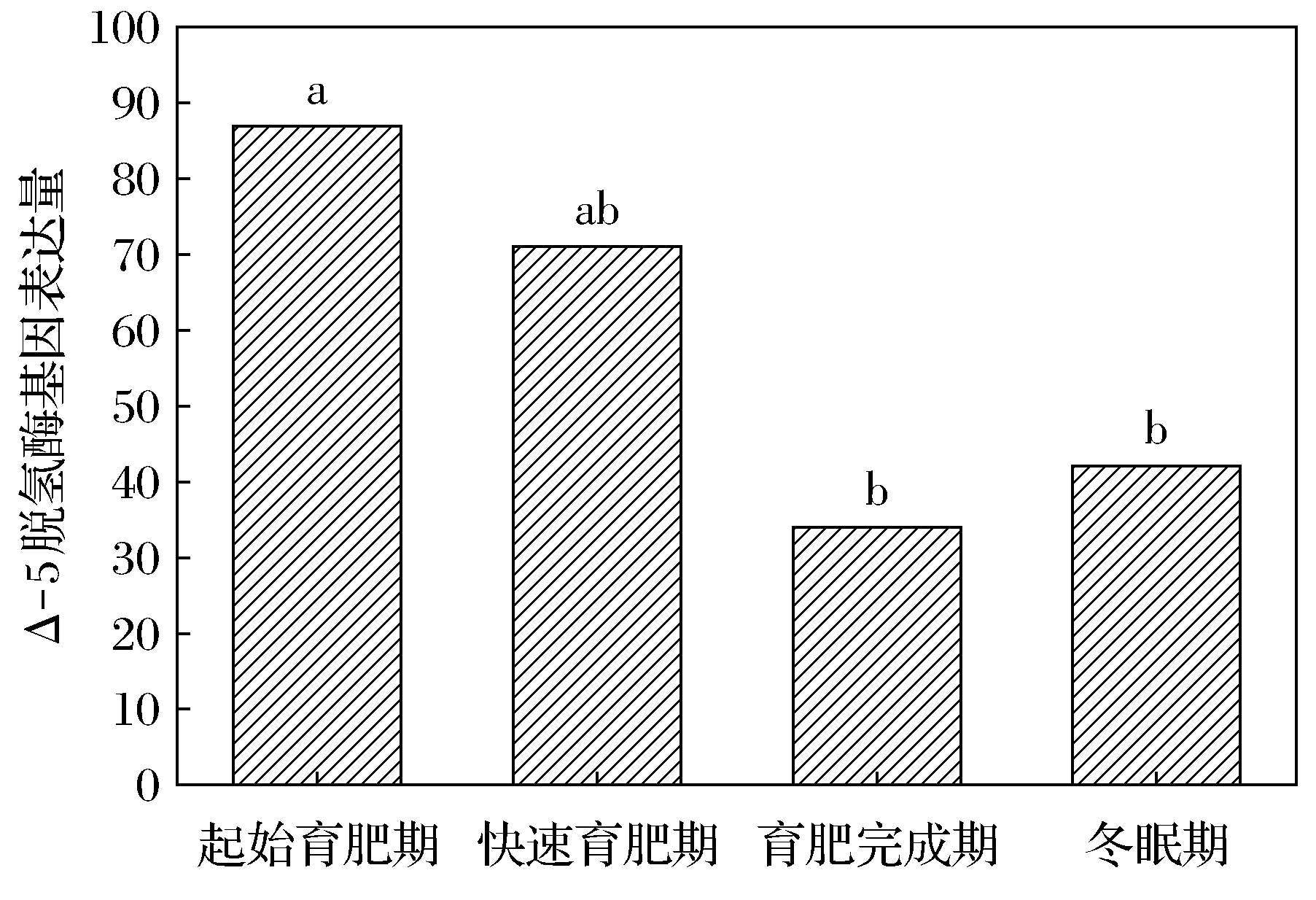
不同字母表示差异显著,FDR≤0.001, |log2Ratio|≥1。
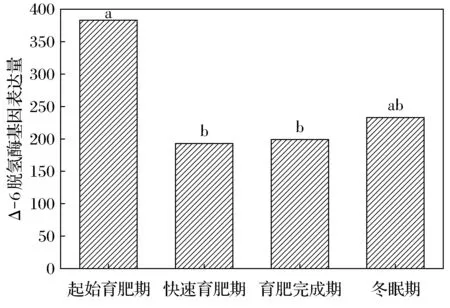
不同字母表示差异显著,FDR≤0.001, |log2Ratio|≥1。
3 讨 论
PUFA在生物体内的代谢是一个复杂的过程(图5)[17],ω-6系和ω-3系2个系列PUFAs在体内有各自的代谢途径,在相同的代谢步骤中所需的酶为同一酶系,共用相同的去饱和酶和链延长酶。脂肪酸链的延长是一个四步骤的反应,首先有不饱和脂肪酸与丙二酰辅酶A在3-酮脂酰-CoA合成酶作用下释放一个CO2分子,生成3-酮脂酰辅酶A,随后在NADPH和3-酮脂酰-CoA还原酶的共同作用下生成羟酰基辅酶A,并由羟酰基辅酶A脱氢酶脱水生成烯酰辅酶A,在烯酰辅酶A还原酶以及NADPH作为辅助因子的作用下形成烯酰基,由此碳链延长2个碳原子。达乌尔黄鼠的羟酰基辅酶A脱氢酶与烯酰辅酶A还原酶的表达量自起始育肥期至冬眠期呈现逐渐增加的趋势,说明动物的低体温、低代谢[8-19]的冬眠状态并没有抑制其体内PUFA形成过程的脂肪酸链延长反应。机体可能通过加强羟酰基辅酶A脱氢酶与烯酰辅酶A还原酶的转录来维持多不饱和脂肪酸的合成能力,以维持一定的细胞膜流动性和血液流动性[20-21]。
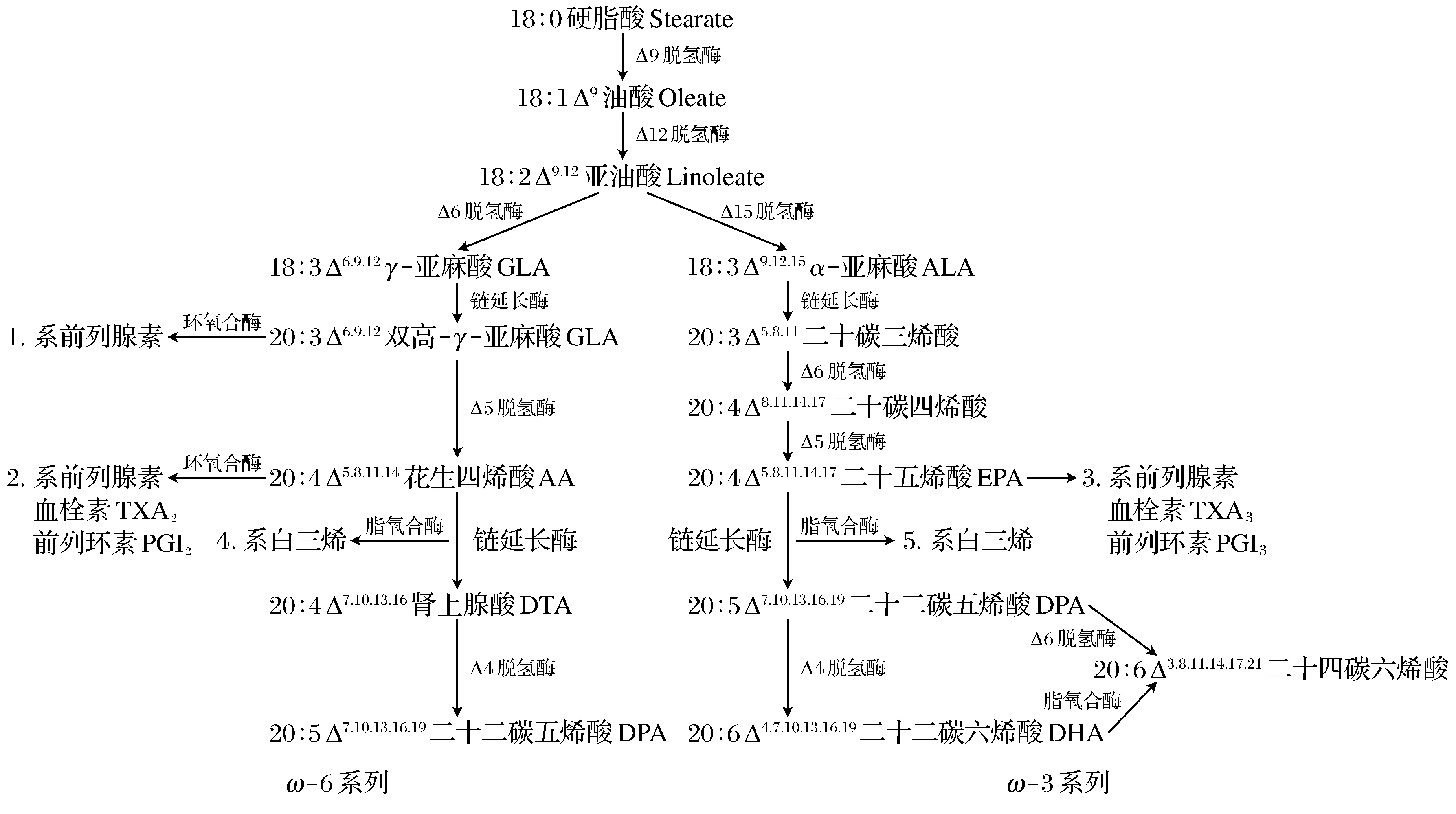
图5 ω6和ω3 PUFAs在生物体中的合成转化
哺乳动物缺乏Δ-12脱氢酶和Δ-15脱氢酶,不能完成油酸向亚麻酸转化的过程,因此亚麻酸成为了哺乳动物的必须脂肪酸。Δ-5脱氢酶和Δ-6脱氢酶是亚麻酸转化为其他PUFA的关键去饱和酶。实验结果显示Δ-5脱氢酶和Δ-6脱氢酶均在达乌尔黄鼠的起始育肥期表达量最多,说明此时多不饱和脂肪酸合成过程的去饱和反应大量发生,动物体内多不饱和脂肪酸可能在此时期合成最多,这与达乌尔黄鼠在育肥初期以脂肪酸合成代谢为主的结论相一致[22]。育肥完成期达乌尔黄鼠体重开始下降,机体的供能方式也发生改变,动物由活跃状态向非活跃状态转变,Δ-5脱氢酶和Δ-6脱氢酶的低水平表达提示此阶段PUFA的合成也开始降低,并持续到冬眠期。由于PUFA可以提高机体的非特异性免疫并双向调节特异性免疫,因此可以推测Δ-5脱氢酶和Δ-6脱氢酶的表达降低,会降低PUFA的含量进而在一定程度上降低动物的免疫能力,这可能是冬眠动物在冬眠期间免疫功能受到抑制[23-24]的原因之一。
综上所述,达乌尔黄鼠在不同的生理阶段其体内与多不饱和脂肪酸合成过程相关的基因出现差异表达,延长酶系列的羟酰基辅酶A脱氢酶与烯酰辅酶A还原酶基因在冬眠期表达最高,去饱和酶系列的Δ-5脱氢酶和Δ-6脱氢酶在育肥初期表达最高。动物对体内PUFA合成过程的脂肪酸链的延长和去饱和作用存在着基因表达的调控,这可能与动物在不同时期需要PUFA发挥其生物学作用的强弱相关,具体的作用机制还需进一步研究。
[ 1 ]CALDER P C. Fatty acids, dietary lipids and lymphocyte functions[J]. Biochem Soc Trans, 1995,23:302-309.
[ 2 ]SHLOMO Y, SHARON R, RALPH C, et al. The role of polyunsaturated fatty acids in restoring the aging neuronal membrane[J]. Neurobiol Aging, 2002,23(5):843-853.
[ 3 ]芦灵军,陈晓理.ω-3 多不饱和脂肪酸与炎症反应[J]. 国外医学:外科学分册, 2002, 29(6):340-343.
[ 4 ]李秋荣,马健,施谦,等. 二十碳五烯酸影响T细胞膜脂肪微区域中IL-2受体的分布[J]. 营养学报, 2004,11(6):324-328.
[ 5 ]王新颖,黎介涛.ω-3多不饱和脂肪酸影响炎症和免疫功能的基础研究[J]. 肠外与肠内营养, 2007,14 (1):54-58.
[ 6 ]黄艳玲,罗旭刚. 饲粮脂肪酸对脂肪代谢酶有关基因表达的影响[J]. 动物营养报, 2005,17(4):1-5.
[ 7 ]RINALDI B, DIPIERRO P, VITELLI M R, et al. Effects of docosahexaenoic acid on calcium pathway in adult rat cardiomyocytes[J]. Life Sci, 2002,71(9):993-1004.
[ 8 ]黄升谋.ω-3系列多不饱和脂肪酸生理功能及其机理[J]. 襄樊学院学报, 2010,31(5):16-19.
[ 9 ]高宗颖,苏丽,袁丽,等. 多不饱和脂肪酸的应用[J]. 农产品加工业, 2011(2):39-41.
[10]NAKAMURA M T, NARA T Y. Structure, function, and dietary regulation of delta6, delta5, and delta 9 desaturases[J]. Annu Rev Nutr, 2004,24:345-376.
[11]ALLMAN D W, GIBSON D M. Fatty acid synthesis during early linoleic acid deficiency in the mouse[J]. J Lipid Res, 1965,79:51-62.
[12]颜新春,汪以真,许梓荣. 日粮多不饱和脂肪酸对动物基因表达和脂肪细胞分化调解[J]. 饲料研究, 2001,2:4-5.
[13]COOK M E, MILLER C C, PARK Y, et al. Immune modulation by altered nutrient metabolism: nutritional control of immuneinduced growth depression[J]. Poult Sci, 1993,72:1301-1305.
[14]MICHAL J B, CHEW B P, SHULTZ T D, et al. Interaction of conjugated dienoic derivatives of linoleic acid withβ-carotene on cellular host defense[J]. FASEB J, 1992,6(2):1102.
[15]FOWLER K H, CHAPKIN R S, MCMURRAY D N. Effects of purified dietaryn-3 ethyl esters on murine T lymphocyte function[J]. J Immunol, 1993,151(10):5186-5197.
[16]LOMBARDI V R M, CAGIAO A, FERNANDEZ-NOVOA L, et al. Short term food supplementation effects of a fish derived extract on the immunological status of pregnant rats and their sucking pups[J]. Nutr Res, 2001,21(11):1425-1434.
[17]孙翔宇,高贵田,段爱莉,等. 多不饱和脂肪酸的研究进展[J]. 食品工业科技, 2012,33(7):418-423.
[18]HUT R A, BARNES B M, DAAN S. Body temperature patterns before, during, and after semi-natural hibernation in the European ground squirrel[J]. J Comp Physiol B, 2002,172:47- 58.
[19]HELDMAIER G, ORTMANN S, ELVERT R. Natural hypometabolism during hibernation and daily torpor in mammals[J]. Resp Physiol Neurobi, 2004,141(3):317-329.
[20]DESAGER J P, DRICOT J, HARVENGT C. Hypotriglyceridemic action of omega-3 fatty acids in healthy subjects does not occur by enhanced lipoprotein lipase and hepatic lipase activities[J]. Res Commun Chem Pathol Pharmacol,1989,65(2):269.
[21]ANDO M, SANAKA T, NIHEI H. Eicosapentanoic acid reduces plasma levels of remnant lipoproteins and prevents in vivo peroxidation of LDL in dialysis patients[J]. J Am Soc Nephrol, 1999,10(10):2177-2184.
[22]吕铮,宋士一,杨明,等. 达乌尔黄鼠入眠准备期的体温、代谢率及能量特征[J]. 兽类学报, 2014,34(4):1-11.
[23]MATSUZAWA H, SHIMIZU K, OKADA K, et al. Analysis of targetorgans for the latency of murine cytomegalovirus DNA using specific pathogen free and germfree mice[J]. Arch Virol, 1995,140:853-864.
[24]蔡益鹏. 冬眠与免疫[J]. 生物学通报, 2002,37(6):19-22.
Gene expressions associated with poly unsaturated fatty acids synthetic in white adipose tissue in Daurian ground squirrel (Spermophilus dauricus)
MENLiyuan1,LIUShuai1,YUChao1,SONGShiyi1,PENGXia2,YANGMing1
(1. College of Chemistry and Life Science, Shenyang Normal University, Shenyang 110034, China;2. Experiment Centre, Shenyang Normal University, Shenyang 110034, China)
Polyunsaturated fatty acids play an important role in regulating the structure and function of cell membrane, immunity, lipid metabolism in mammalian. For researching the polyunsaturated fatty acids systhesis regulated by gene expression in hibernators, by means of the next transcriptome sequencing technology, we sequenced the transcriptom in the white adipose tissue of the Daurian ground squirrel (Spermophilus dauricus), and then got differentially expressed genes involved in hydroxyacyl-CoA reductase, enoyl-CoA dehydrogenase, delta-5 desaturase and delta-6 desaturase at four physiological stage: Initial-Fattening, Rapid-Fattening, Finished-Fattening and Hibernation. The results show that hydroxyacyl-CoA reductase up-regulate in hibernation and is different from Initial-Fattening significantly; The expression of enoyl-CoA dehydrogenase in Hibernation is also higher than Initial-Fattening and Rapid-Fattening significantly; delta-5 desaturase and delta-6 desaturase present a higher level in Initial-Fattening. These indicate that polyunsaturated fatty acids systhesis is regulated by gene expression in the Daurian ground squirrel. The cell membrane fluidity and immune ability may be adjusted in different physiological period by this way.
Daurian ground squirrel (Spermophilus dauricus); Polyunsaturated fatty acids; gene expression
2015-03-18。
国家自然科学基金资助项目(30770337,31170380)。
门丽媛(1990-),女,辽宁大连人,沈阳师范大学硕士研究生; 通信作者: 杨 明(1966-),女,辽宁昌图人,沈阳师范大学教授,博士,硕士研究生导师。
1673-5862(2015)03-0319-05
Q958.1
A
10.3969/ j.issn.1673-5862.2015.03.001
