芍甘附子汤加味对胶原诱导性关节炎大鼠滑膜血管新生相关因子表达的影响
2015-04-21柳洋朱跃兰侯秀娟刘小平
柳洋 朱跃兰 侯秀娟 刘小平
类风湿关节炎(rheumatoid arthritis,RA)是一种累及全身多关节、以慢性滑膜炎和血管翳形成为主要病理改变的自身免疫性疾病。广泛的新生血管网的形成是维持血管翳生长、关节软骨和骨组织遭受侵蚀和破坏的病理基础。血管新生是由多分子机制参与形成的过程,其中缺氧诱导因子(hypoxiainducible factor,HⅠF)—血管内皮生长因子(vascular endothelial growth factor,VEGF)—血管生成素(angiopoietin,ANG)轴[1]起着重要作用。笔者团队前期研究表明芍甘附子汤可能通过降低胶原诱导性关节炎(CⅠA)大鼠滑膜VEGF 及其受体VEGFR 的表达起到抑制血管新生的作用[2]。本实验拟通过进一步观察CⅠA 大鼠滑膜组织中HⅠF-1α、Ang-1 和Ang-2的表达,探讨它们在滑膜血管新生中的作用机制,为临床治疗RA 提供依据。
1 材料与方法
1.1 实验动物
清洁级健康Wistar 大鼠30 只,雌性,体质量(110 ±10)g,鼠龄6 ~8 周,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001,适应性饲养1 周。
1.2 实验药物
芍甘附子汤加味(方药组成:黑顺片15 g、白芍15 g、甘草10 g、鸡血藤15 g、青风藤15 g、牛膝15 g),购自北京同仁堂,由北京中医药大学东方医院中药房煎制;雷公藤多甙片(湖南千金协力药业有限公司,生产批号:Z43020138,10 mg/片)。芍甘附子汤加味和雷公藤多甙片按照成人用量的7 倍来计算大鼠用量。
1.3 试剂和仪器
牛Ⅱ型胶原购自美国Chondrex 公司,批号20022;完全弗氏佐剂购自美国Sigma 公司,批号SLBC5083;HⅠF-1α 抗体购自美国Abcam 公司,批号ab8366;Ang-1、Ang-2 抗体均购自北京博奥森生物技术有限公司,批号bs-0800R、bs-0677R;酶标仪购自美国Thermo 公司,型号MK3;足趾容积测量仪购自济南益延科技发展有限公司,型号YLS-7B;德国ⅠKA 高速分散机,型号T10 basic ULTRA-TURRAX。
1.4 制备模型
参照文献[3]的方法,制备CⅠA 模型。将10 mg牛Ⅱ型胶原溶解于0.1 mol/L 乙酸,此溶液与等量的完全弗氏佐剂溶液混合,制备成终浓度为1 mg/mL的混合物,并使混合物充分乳化。取此乳化剂于大鼠左足底及尾根部进行多点皮内注射,每只0.2 mL,压迫注射部位使乳化物完全吸收,7 天后如同法加强免疫1 次。
1.5 动物分组及给药
将动物随机分出5 只为正常组,常规饲养,其余均如上法制备CⅠA 模型。造模成功后,将其随机分为:模型组、对照组及小、中、大剂量治疗组,每组各5 只。于第二天开始给药干预,正常组和模型组均给予蒸馏水灌胃,对照组给予雷公藤多甙片(8.75 mg/kg·d)灌胃,治疗组则分别给予小、中、大剂量(0.708、1.42、2.83 g/kg·d)芍甘附子汤加味灌胃,每天1 次,连续4 周。
1.6 一般情况观察
观察各组大鼠的精神状态、毛发、食水量及活动情况,于每周固定时间测定体质量变化。
1.7 足趾肿胀体积测定及关节炎指数(AⅠ)评分
采用足趾容积测量仪测量各组大鼠双后足踝关节的体积,并观察关节肿胀度变化。关节病变以按级评分法评价,根据四肢各肢体病变程度累计积分,计算出AⅠ。0 分:无红肿;1 分:1 个趾关节红肿;2 分:2 个及2 个以上趾关节红肿;3 分:踝关节以下足爪红肿和足趾肿胀,4 分:全足爪严重肿胀且不能负重。各关节积分累积即每只大鼠的AⅠ,最高分为16 分。
1.8 免疫组化法检测HⅠF-1α、Ang-1 和Ang-2 表达
用10%水合氯醛对大鼠进行腹腔麻醉,腹主动脉取血后取膝关节,保留完整滑膜组织,放入4%多聚甲醛固定24 小时,10%乙二胺四乙酸(EDTA)溶液脱钙,常规石蜡包埋切片,行免疫组化染色。HⅠF-1α 阳性结果为滑膜组织细胞浆染成棕黄色,Ang-1和Ang-2 阳性结果为滑膜组织细胞浆呈棕黄色或棕褐色,少量表达于细胞核。每张切片随机观察5 个视野,输入Mias 图像分析管理系统4.0 进行分析,计算阳性细胞的平均光密度值(OD 值)。
1.9 统计方法
所有数据采用SPSS 17.0 软件进行统计分析,以均数±标准差(±s)表示,组间比较采用单因素方差分析(One-way ANOVA),足趾肿胀体积、HⅠF-1α、Ang-1、Ang-2 的表达和AⅠ28 方差齐,其两两比较用One-way ANOVA 的LSD 法,AⅠ14、AⅠ42 和AⅠ56方差不齐,采用Mann-Whitney 检验。以P <0.05 为有统计学意义。
2 结果
2.1 一般情况
正常组大鼠状态良好,反应敏捷,行动迅速,毛发浓密有光泽,食欲较好,体质量稳定增长。模型组大鼠则出现精神变差、食欲下降、行动迟缓、体质量增长缓慢等改变。后逐渐出现四肢红肿,皮肤充血,局部皮肤破溃,双后肢难以负重,关节明显变形。药物干预大鼠与模型组大鼠相比,关节炎症状均有不同程度减轻,肿胀逐渐消退,原充血皮肤出现皱缩,破溃处结痂或愈合,精神状态亦有所好转。
2.2 足趾肿胀体积和AⅠ变化
与正常组比较,造模第5 天开始出现轻度炎症表现,左足皮肤发红,轻微肿胀。造模第14 天和第28 天,所有造模大鼠均表现出明显炎症反应并呈逐渐加重趋势,足趾肿胀体积和AⅠ评分升高(P <0.01)。模型建立成功后即开始给予药物治疗。与模型组比较,造模第42 天,对照组和大剂量治疗组足趾肿胀体积有所降低(P <0.05),对照组和中、大剂量治疗组AⅠ评分明显降低(P <0.01);第56 天,对照组和大剂量治疗组足趾肿胀体积明显降低(P<0.01),对照组和中、大剂量治疗组AⅠ评分明显降低(P <0.01)。见表1、2。
表1 芍甘附子汤加味对CⅠA 大鼠足趾肿胀体积的影响(±s,n=5,mm)
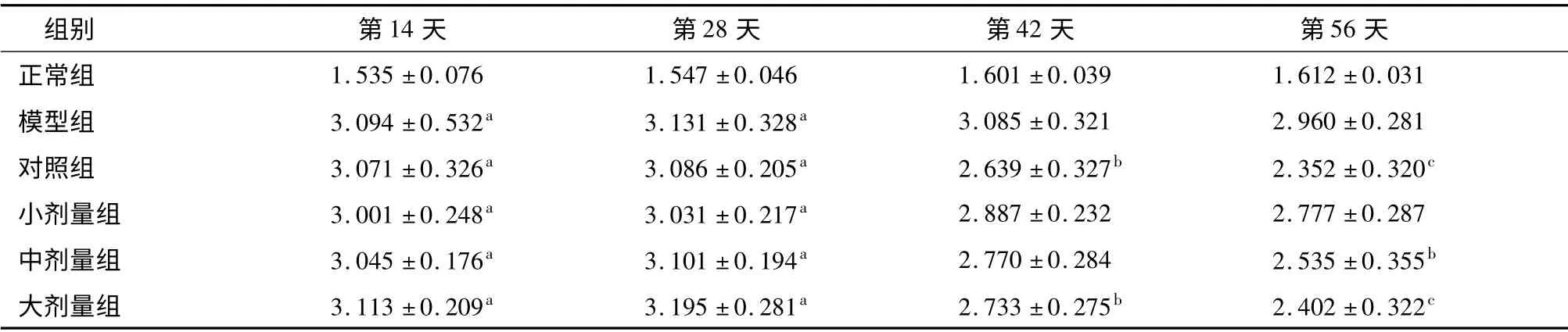
表1 芍甘附子汤加味对CⅠA 大鼠足趾肿胀体积的影响(±s,n=5,mm)
注:与正常组比较aP <0.01;与模型组比较bP <0.05 cP <0.01
组别 第14 天 第28 天 第42 天 第56天正常组 1.535 ±0.076 1.547 ±0.046 1.601 ±0.039 1.612 ±0.031模型组 3.094 ±0.532a 3.131 ±0.328a 3.085 ±0.321 2.960 ±0.281对照组 3.071 ±0.326a 3.086 ±0.205a 2.639 ±0.327b 2.352 ±0.320c小剂量组 3.001 ±0.248a 3.031 ±0.217a 2.887 ±0.232 2.777 ±0.287中剂量组 3.045 ±0.176a 3.101 ±0.194a 2.770 ±0.284 2.535 ±0.355b大剂量组 3.113 ±0.209a 3.195 ±0.281a 2.733 ±0.275b 2.402 ±0.322 c
2.3 各组大鼠滑膜组织HⅠF-1α、Ang-1 和Ang-2 的表达变化
与正常组比较,模型组HⅠF-1α 和Ang-1 表达均显著增加(P <0.01),Ang-2 表达增加(P <0.05);与模型组比较,对照组和大、中剂量治疗组HⅠF-1α和Ang-1 表达均出现显著减少(P <0.01),与对照组比较,小剂量治疗组HⅠF-1α 和Ang-1 表达明显增加(P <0.01),中、大剂量组差异无统计学意义;而中、大剂量治疗组HⅠF-1α 相较于小剂量组的表达则有所降低(P <0.05);Ang-2 表达呈减少趋势,但各组间差异无统计学意义。HⅠF-1α、Ang-1 和Ang-2免疫组化染色结果分别见图1、2、3;平均光密度值及各组间比较见表3。
表2 芍甘附子汤加味对CⅠA 大鼠AⅠ评分的影响(±s),n=5,分)

表2 芍甘附子汤加味对CⅠA 大鼠AⅠ评分的影响(±s),n=5,分)
注:与正常组比较aP <0.01;与模型组比较bP <0.05 cP <0.01
组别 第14 天 第28 天 第42 天 第56天正常组0 0 0 0模型组 4.70 ±0.97a 8.80 ±1.30a 7.60 ±0.55 6.60 ±0.89对照组 4.30 ±0.97a 8.80 ±1.48a 5.00 ±1.00c 2.40 ±1.52c小剂量组 4.60 ±0.89a 8.40 ±1.82a 6.00 ±0.71b 4.20 ±1.30b中剂量组 4.40 ±1.14a 8.40 ±1.14a 5.20 ±0.84c 3.00 ±0.71c大剂量组 4.60 ±0.96a 8.60 ±1.52a 4.80 ±1.30c 2.60 ±0.89 c
表3 芍甘附子汤加味对CⅠA 大鼠滑膜组织HⅠF-1α、Ang-1 和Ang-2 表达的影响(±s,n=5)
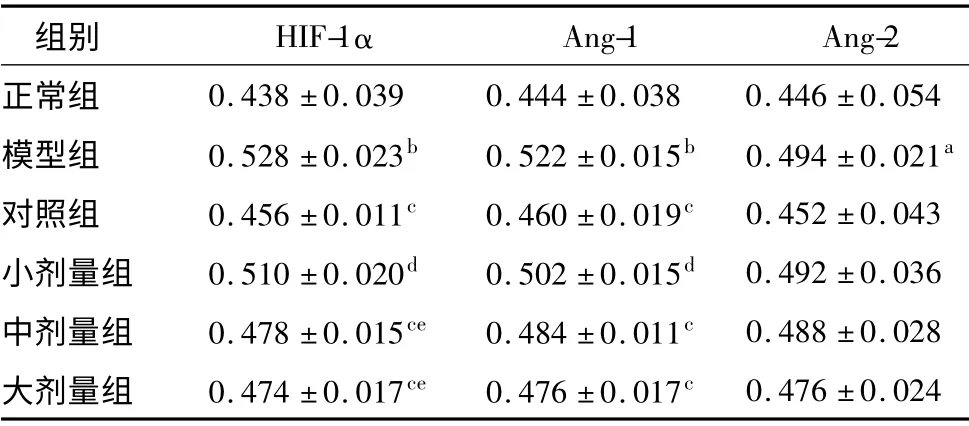
表3 芍甘附子汤加味对CⅠA 大鼠滑膜组织HⅠF-1α、Ang-1 和Ang-2 表达的影响(±s,n=5)
注:与正常组比较aP <0.05 bP <0.01;与模型组比较cP <0.01;与对照组比较dP <0.01;与小剂量组比较eP <0.05
组别 HⅠF-1α Ang-1 Ang-2正常组0.438 ±0.039 0.444 ±0.038 0.446 ±0.054模型组 0.528 ±0.023b 0.522 ±0.015b 0.494 ±0.021a对照组 0.456 ±0.011c 0.460 ±0.019c 0.452 ±0.043小剂量组 0.510 ±0.020d 0.502 ±0.015d 0.492 ±0.036中剂量组 0.478 ±0.015ce 0.484 ±0.011c 0.488 ±0.028大剂量组 0.474 ±0.017ce 0.476 ±0.017c 0.476 ±0.024
3 讨论
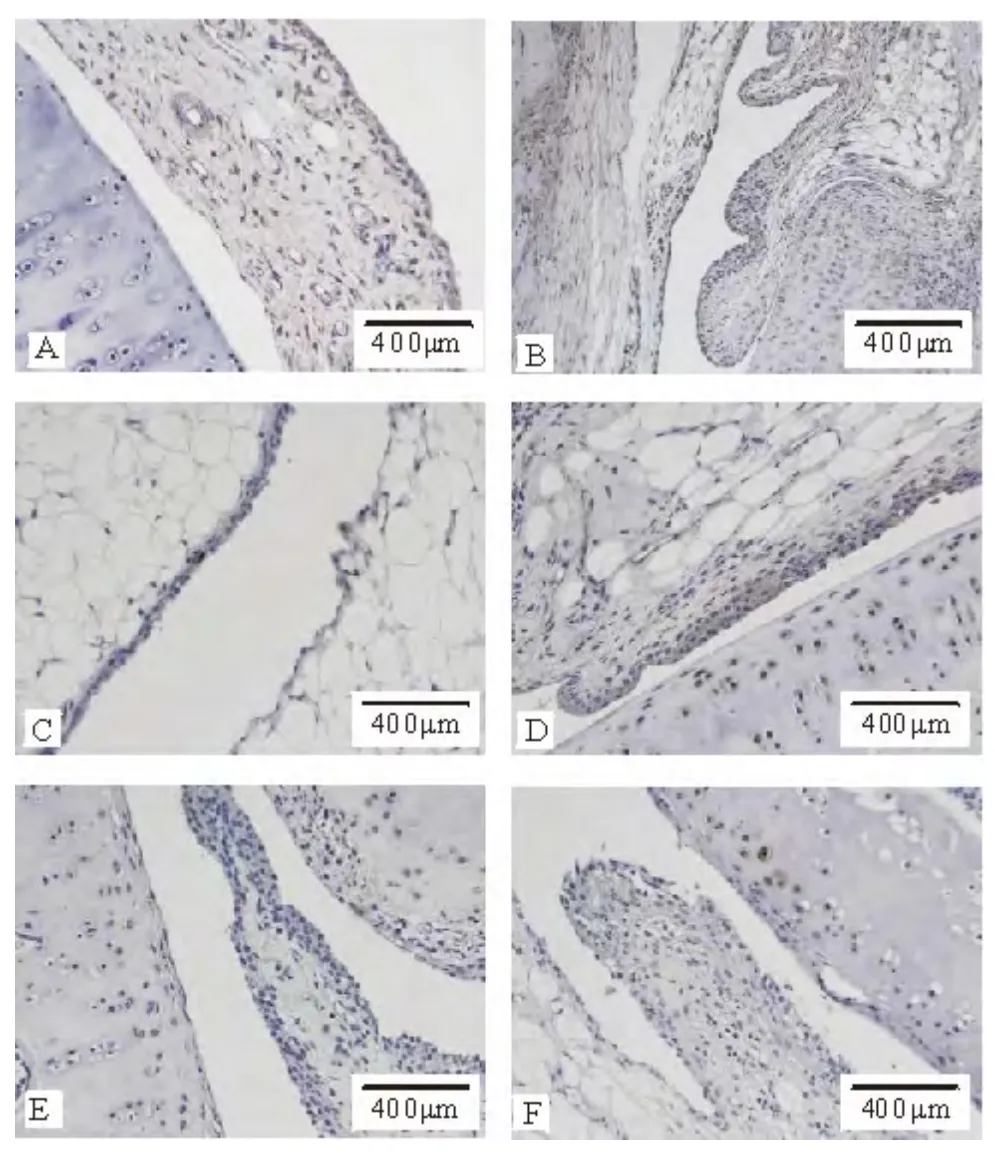
图1 各组大鼠膝关节滑膜组织HⅠF-1α免疫组化染色结果(×200)
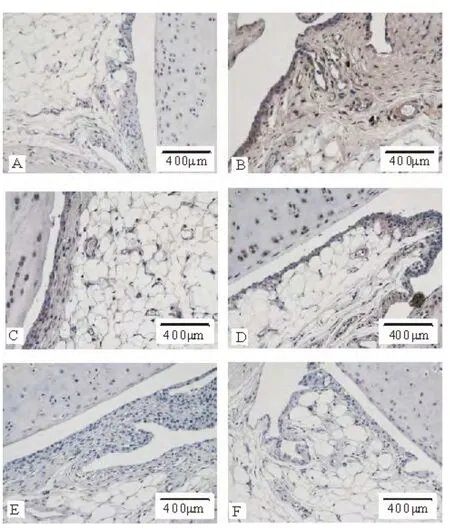
图2 各组大鼠膝关节滑膜组织Ang-1免疫组化染色结果(×200)
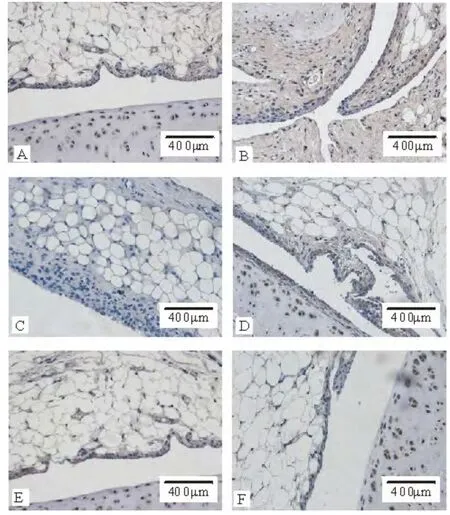
图3 各组大鼠膝关节滑膜组织Ang-2免疫组化染色结果(×200)
RA 是一种以慢性滑膜炎为特征的自身免疫性疾病,其主要病理学表现为滑膜组织增厚、滑膜细胞增生和炎症细胞浸润等,导致血管翳的形成,进一步侵蚀和破坏骨结构和关节软骨,最终造成不可逆的关节畸形和功能障碍。近年来诸多研究发现,血管新生在RA 的病理过程中具有关键性的作用,在疾病的早期便开始作用并贯穿整个病程,它是在原有的毛细血管基础上通过血管内皮细胞的增殖和迁移,从先前存在的血管处衍生出的新的毛细血管,是由众多炎性介质、细胞因子及蛋白酶等因素共同介导、相互作用的复杂的病理过程[4]。其中,缺氧、VEGF 和血管生成素及其之间的相互作用,就是促进新生血管的形成和稳定的主要因素[5]。RA患者的滑膜腔是一个慢性缺氧、低PH 值环境,HⅠF-1 是最重要的低氧信号传递因子,缺氧刺激HⅠF-1α的产生和稳定,继而通过上调VEGF 的表达发挥促进血管新生作用[6]。Ang-1 和Ang-2 的表达亦受缺氧等的调控,并与VEGF 协同促进新生血管的成熟和重建[7]。CⅠA 大鼠模型是一种由胶原诱导的自身免疫性关节炎动物模型[8],其症状、病理改变及致病机理与人类RA 有很多相似之处,被公认为研究RA 的经典动物模型,广泛应用于观察RA 病理机制及药效学研究[9]。
RA 属于中医“痹证”范畴,外因由风、寒、湿三气杂至,内因由正气不足、肝肾亏虚为本,正所谓“邪之所凑,其气必虚”。风寒湿邪侵袭经脉,痹阻气血,故法应温经通络,补益肝肾。芍甘附子汤加味是在《伤寒论》芍药甘草附子汤基础上加味而成,是应用于临床诊治RA 多年的经验有效方。方中白芍养血柔肝,能缓急止痛;附子温经散寒,补火助阳,助以开经通络;炙甘草补中益气、缓急止痛,兼调和药性。结合现代药理学研究,白芍的有效成分白芍总苷具有解痉、镇痛功效,制附子可抑制炎症发展,有调节免疫的作用。在基础方之上加以青风藤、川牛膝等共奏温经通络,补益肝肾之效。本课题组前期研究[2,10]也发现,芍甘附子汤加味可降低CⅠA 大鼠血清中ⅠL-1β、TNF-α 含量,抑制VEGF 及其受体KDR 的表达水平,降低滑膜病理学评分,有效改善关节炎症,抑制血管新生,延缓RA 的病情进展。雷公藤多甙是从雷公藤的根部提取和精制而成的活性成分,被称为“中草药激素”[11],具有抗炎和免疫抑制或免疫调节功能。有研究表明,雷公藤多甙可降低CⅠA 模型的发病率和严重性[12],亦能降低血清炎症因子如ⅠL-1β、TNF-α 和VEGF 等的表达[13],表现出抗血管新生的作用;在临床上已广泛用于RA 的治疗,并取得了肯定的疗效,因此选取为本研究的阳性对照药物。本研究通过建立CⅠA 大鼠模型,给予不同剂量芍甘附子汤加味治疗,经干预后,CⅠA 大鼠关节肿胀度及AⅠ评分均有改善,滑膜组织中HⅠF-1α、Ang-1 和Ang-2 的表达也有不同程度地降低。
综上所述,在RA 疾病过程中,血管新生起着关键作用,因此以血管新生为靶点将可能成为未来治疗RA 的核心突破点。目前国外已有动物研究显示,以VEGF 及其受体、HⅠF、血管生成素等为靶点的治疗手段获得一定的疗效,但尚缺乏临床证据和安全评价。本研究结果提示芍甘附子汤加味可能是通过改善滑膜腔内的氧缺乏和调节血管生成素的表达从而抑制滑膜血管新生,阻断血管翳的形成,防止关节软骨和骨组织的破坏,减轻炎症症状,进而延缓RA 发病进程,为临床早期干预RA 提供依据,但作用机制研究及临床观察仍需在今后进一步开展。
[1]Szekanecz Z,Besenyei T,SzentPetery A,et al.Angiogenesis and vasculogenesis in rheumatoid arthritis[J].Curr OPin Rheumatol,2010,22(3):299-306.
[2]靖卫霞,朱跃兰,侯秀娟,等.温经通络法对胶原性关节炎大鼠血管新生干预作用的研究[J].世界中西医结合杂志,2013,8(5):502-506.
[3]徐叔云,卞如廉,陈修.药理实验方法学[M].北京:人民卫生出版社,2002:921-922.
[4]Szekanecz Z,Besenyei T,Paragh G,et al.Angiogenesis in rheumatoid arthritis[J].Autoimmunity,2009,42(7):563-573.
[5]Veale D J,Fearon U.Ⅰnhibition of angiogenic Pathways in rheumatoid arthritis:Potential for theraPeutic targeting[J].Best Pract Res Clin Rheumatol,2006,20(5):941-947.
[6]Gaber T,Dziurla R,TriPmacher R,et al.HyPoxia inducible factor (HⅠF)in rheumatology:low O2!See what HⅠF can do![J].Ann Rheum Dis,2005,64(7):971-980.
[7]任海霞,肖诚,李梢,等.类风湿性关节炎中的血管生成相关因子研究进展[J].中国中医基础医学杂志,2007,13(4):315-318.
[8]Brand DD,Latham KA,Rosloniec EF.Collagen-induced arthritis.[J].Nat Protoc,2007,2(5):1269-1275
[9]Hirose J,Tanaka S.Animal models for bone and joint disease.CⅠA,CAⅠA model[J].Clin Calcium,2011,21(2):253-259.
[10]朱跃兰,侯秀娟.加味芍甘附子汤对胶原诱导性关节炎大鼠血清ⅠL-1β、TNF-α 的干预作用[J].中国医药指南,2012,10(13):86-87.
[11]姚骥如,孙莹,罗顺葵,等.雷公藤多苷的临床应用进展[J].中国新药与临床杂志,2010,(3):179-182.
[12]Bao J,Dai S M.A Chinese herb TriPterygium wilfordii Hook F in the treatment of rheumatoid arthritis:mechanism,efficacy,and safety[J].Rheumatol Ⅰnt,2011,31(9):1123-1129.
[13]梁虹,张学增,张育,等.雷公藤多甙对胶原诱导关节炎大鼠的治疗作用及其作用机制[J].中华临床免疫和变态反应杂志,2010,4(4):272-279.
