槲皮素通过自噬途径减轻高糖致体外培养RSC96细胞的损伤
2015-04-21屈岭梁晓春顾蓓张宏石玥
屈岭 梁晓春 顾蓓 张宏 石玥
糖尿病周围神经病变发病机制尚未阐明,尚缺乏有效治疗手段[1-2]。槲皮素广泛存在于多种中药和食物中,具有抗氧化、清除自由基等作用。有学者发现槲皮素可增加被高浓度葡萄糖所抑制的神经细胞的增殖活性,减少氧化应激损伤,并可通过诱导自噬而减少凋亡[3-5]。本研究通过离体实验观察了槲皮素对高浓度葡萄糖培养雪旺细胞中增殖活性、凋亡与自噬变化规律的影响,来了解槲皮素是否通过自噬—凋亡途径对糖尿病周围神经病变起到防治作用。
1 材料和方法
1.1 材料
1.1.1 实验细胞 大鼠雪旺细胞系细胞(rat Schwann cell line,RSC96),一种永生化的大鼠雪旺细胞,购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2 药品试剂 槲皮素、噻唑基四唑(methyl thiazolyl tetrazolium,MTT)、3-甲基嘌呤(3-methyladenine,3-MA)(Sigma,美国);改良Eagle培养基(Dulbecco's modification of Eagle's medium,DMEM)(Gibco,美国);兔抗大鼠caspase-3 多克隆抗体、兔抗大鼠caspase-9 多克隆抗体(Santa Cruz,美国);原位末端标记法(terminal dexynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL)试剂盒(Roche,美国)。
1.1.3 实验仪器 CO2培养箱(Forma 3111,美国);高速低温离心机(ALC PK121R,美国);倒置相差显微镜(Olympus CKX31SF,日本);激光扫描共聚焦显微镜(LEⅠCA TCS SP2SE,德国);透射电子显微镜(JEM 1010,日本)。
1.2 实验方法
1.2.1 细胞培养 复苏RSC96 细胞,加入DMEM培养基、胎牛血清(10%)、谷氨酰胺(终浓度4 mmol/L)、丙酮酸钠(终浓度1 mmol/L)、HEPES(终浓度12.5 mmol/L),2 ~3 天换液1 次。
1.2.2 TUNEL 检测 作用72 小时后,4%多聚甲醛固定样本1 小时(室温下);0.1%TritionX-100 孵育3 分钟;阳性对照组:滴加脱氧核糖核酸酶Ⅰ后,室温下孵育10 分钟,滴加TUNEL 反应液,阴性对照组滴加试剂2,避光,37℃,湿盒中孵育60 分钟;滴加转换剂50 μL,37℃,湿盒中孵育30 分钟,滴加显色剂,1 ~2 分钟,滴加苏木素染色,盐酸酒精分化液分化,封片。各组在×400 倍视野下,随机选取10个视野。应用ⅠPP 6.0 软件计算凋亡细胞占有核细胞的百分比。重复2 次。
1.2.3 MTT 比色法 加入不同条件72 小时后检测。取96 孔板,弃培养基,加入10% MTT 200 μL/孔于37℃孵育2 ~4 小时后,吸出培养液,加入二甲基亚砜200 μL/孔,室温静置30 分钟至1 小时于酶标分析仪检测吸光度(optical density,OD)值,检测波长570 nm。每次重复5 孔,重复3 次。
1.2.4 Western Blot 加入不同条件72 小时后检测。各组细胞标本加入裂解液进行匀浆,离心取上清液,测定蛋白浓度,将含有50 μg 蛋白的上清液用电泳分离,并转移到硝酸纤维素膜上,用含5%脱脂奶粉的TBS-T 中和硝酸纤维素膜降低非特异性结合。一抗孵育,冲洗后再用二抗孵育,采用ECL 试剂盒检测。条带用Gel-Pro 图像分析系统扫描定量。重复3 次。
1.3 统计学处理
数据录入和处理均采用SPSS 19.0 统计软件包,分析前采用One Sample Kolmoglrov-Smirnov Z test 检验数据是否符合正态分布,符合正态分布的数据采用均数±标准差(±s)描述,多组独立样本比较采用单因素方差分析,细胞增殖活性OD 值方差齐,采用Bonferroni 法,凋亡率、P35/β-actin、P20/β-actin 及Beclin1/β-actin 方差不齐,采用Dunnett's T3 法。各种检验的显著性水平设定为P <0.05。
2 结果
2.1 高浓度葡萄糖抑制RSC96 细胞增殖活性
在培养基中加入不同浓度的葡萄糖,分为正常对照(Con)组、G50 组(葡萄糖终浓度为50 mmol/L)、G75 组(葡萄糖终浓度为75 mmol/L)、G100 组(葡萄糖终浓度为100 mmol/L)及G125 组(葡萄糖终浓度为125 mmol/L)。各组OD 值随着时间延长而升高。72 小时后检测,G100 组与G125 组OD 值较Con 组明显降低(P <0.05,P <0.01)。提示高浓度葡萄糖可抑制RSC96 细胞增殖活性,见表1。
表1 不同时间不同浓度葡萄糖对OD 值的影响(±s)
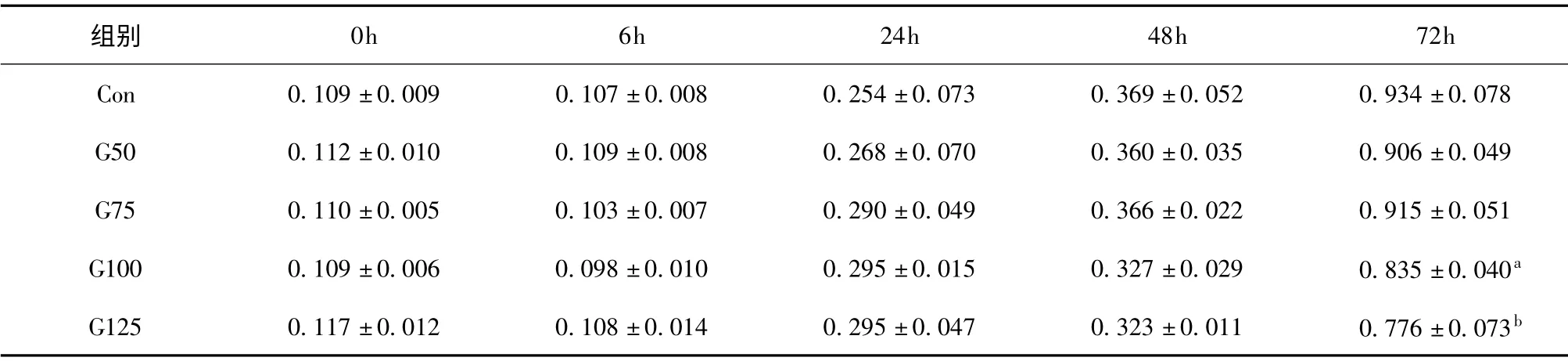
表1 不同时间不同浓度葡萄糖对OD 值的影响(±s)
注:与Con 组比较,aP <0.05,bP <0.01。
组别0h 6h 24h 48h 72h Con 0.109 ±0.009 0.107 ±0.008 0.254 ±0.073 0.369 ±0.052 0.934 ±0.078 G50 0.112 ±0.010 0.109 ±0.008 0.268 ±0.070 0.360 ±0.035 0.906 ±0.049 G75 0.110 ±0.005 0.103 ±0.007 0.290 ±0.049 0.366 ±0.022 0.915 ±0.051 G100 0.109 ±0.006 0.098 ±0.010 0.295 ±0.015 0.327 ±0.029 0.835 ±0.040a G125 0.117 ±0.012 0.108 ±0.014 0.295 ±0.047 0.323 ±0.011 0.776 ±0.073 b
2.2 槲皮素减轻高糖对RSC96 细胞增殖活性的抑制
在终浓度125 mmol/L 的葡萄糖培养基中加入不同浓度的槲皮素。实验分为Con 组、高糖(Glu)组、Q10 组(Que 终浓度10 μmol/L)、Q25 组(Que 终浓度25 μmol/L)、Q50 组(Que 终浓度50 μmol/L)、Q100 组(Que 终浓度100 μmol/L)及Q200 组(Que 终浓度200 μmol/L)。作用72 小时后,各治疗组OD 值均较Con组降低,除Q10 及Q25 组外,均具有统计学意义(P <0.01);Q10 及Q25 组与与Con 组无明显差异(P>0.05)。Q10 与Q25 组OD 值较Glu 组明显升高(P <0.01),Q100 与Q200 组OD 值较Glu 组显著降低(P<0.01),Q50 组与Glu 组之间比较无明显差异(P>0.05,表2)。提示槲皮素对高糖培养的RSC96 细胞的增殖活性呈双向调节作用。低浓度槲皮素可促进高糖培养RSC96 细胞的增殖活性,而高浓度槲皮素则抑制高糖培养RSC96 细胞的增殖活性。
表2 不同浓度槲皮素对高糖培养RSC96 细胞OD 值的影响(±s)

表2 不同浓度槲皮素对高糖培养RSC96 细胞OD 值的影响(±s)
注:与Glu 组比较aP <0.01;与Con 组比较bP <0.01。
组别 OD值Con 0.983 ±0.133 a Glu 0.560 ±0.06b Q10 0.828 ±0.080a Q25 0.821 ±0.069a Q50 0.551 ±0.199b Q100 0.168 ±0.02ab Q200 0.083 ±0.005 ab
2.3 低浓度槲皮素减少高浓度葡萄糖所致RSC96细胞的凋亡
结果显示Glu 组凋亡率较Con 组明显升高(P <0.01),Que 组(终浓度25 μmol/L)较Glu 组明显减少(P <0.01),与Con 组比较无明显差异(P>0.05,图1A、表3)。进一步通过Western blot 法检测caspase-9 活化的P35 亚基和caspase-3 活化的P20亚基的表达(图1B,表3)。结果Glu 组P35 亚基表达较Con 组明显增加(P <0.01);Que 组活化的P35亚基表达较Glu 组减少(P <0.05),与Con 组比较无统计学差异(P>0.05)。Glu 组P20 亚基表达较Con组增加(P <0.01),Que 组P20 亚基表达较Glu 组减少(P <0.01),与Con 组比较无统计学差异(P>0.05)。提示低浓度槲皮素可减少高浓度葡萄糖所致RSC96 细胞的凋亡。

图1 槲皮素对高糖培养RSC96 凋亡的影响
表3 槲皮素对高糖培养RSC96 凋亡的影响(±s)

表3 槲皮素对高糖培养RSC96 凋亡的影响(±s)
注:与Glu 组比较,aP <0.05,bP <0.01。
组别 凋亡率(%) P35/β-actin P20/β-actin Con 8.45 ±3.88b 0.13 ±0.02b 0.09 ±0.06 b Glu 23.61 ±7.57 1.40 ±0.19 0.35 ±0.08 Que 10.99 ±4.03b 0.73 ±0.37a 0.04 ±0.04 b
2.4 抑制自噬削弱槲皮素对高糖培养RSC96 细胞增殖的促进作用
加入自噬抑制剂3-MA,其中M0 组(不加入3-MA)、M1 组(3-MA 终浓度1 mmol/L)、M2 组(3-MA终浓度2 mmol/L)、M5 组(3-MA 终浓度5 mmol/L)及M10 组(3-MA 终浓度10 mmol/L)。作用72 小时后以MTT 法检测细胞增殖活性。结果显示,与各组未加3-MA 时比较,除了加入1 mmol/L 的3-MA 外,随着3-MA 浓度的提高,各组OD 值明显降低(P <0.01)。当加入1 mmol/L 的3-MA 时,Glu 组和Que组OD 值均较Con 组明显减低(P <0.01),而Que 组和Glu 组相比较,两组OD 值无明显差异(P>0.05)。当加入2 mmol/L 及以上浓度的3-MA 时,三组间OD 值比较均无明显差异(P>0.05)。抑制自噬后槲皮素促进高糖培养RSC96 细胞增殖活性的保护作用随之消失,提示槲皮素的促增殖作用与自噬途径相关,见表4。
表4 自噬对高糖培养RSC96 增殖的影响(OD,±s)

表4 自噬对高糖培养RSC96 增殖的影响(OD,±s)
注:与相同3-MA 浓度条件下的Glu 组比较,aP <0.01;与相同3-MA 浓度条件下的Con 组比较,bP <0.01;与各自组未加入3-MA 时比较,cP <0.01。
组别Con Glu Que M0 0.983 ±0.133a 0.560 ±0.062b 0.821 ±0.069 ab M1 0.800 ±0.097 0.619 ±0.071b 0.557 ±0.118bc M2 0.332 ±0.061c 0.329 ±0.025c 0.370 ±0.060c M5 0.115 ±0.009c 0.116 ±0.015c 0.097 ±0.011c M10 0.100 ±0.018c 0.092 ±0.012c 0.089 ±0.010 c
2.5 抑制自噬削弱槲皮素减少高糖培养RSC96 细胞凋亡的作用
加入10 mmol/L 的3-MA 后光学显微镜可见各组RSC96 细胞数量均明显减少,胞体肿胀明显,所剩细胞胞核多呈染色阳性表现;半定量分析,各组间凋亡率比较无明显差异(P>0.05,图2A,表5)。加入1 mmol/L 的3-MA 后,自噬相关蛋白Beclin1、P35 亚基和P20 亚基的表达在三组间比较无明显差异(P>0.05,图2B,表5)。提示槲皮素减轻高糖培养RSC96 细胞凋亡的作用可能与自噬有关。

图2 自噬对高糖培养RSC96 凋亡的影响
表5 自噬对高糖培养RSC96 凋亡的影响(±s)

表5 自噬对高糖培养RSC96 凋亡的影响(±s)
组别 凋亡率(%) P35/β-actin P20/β-actin Beclin1/β-actin Con 25.35 ±20.61 0.07 ±0.08 0.53 ±0.31 0.07 ±0.04 Glu 46.78 ±37.62 0.06 ±0.07 0.83 ±0.57 0.03 ±0.01 Que 39.97 ±30.98 0.06 ±0.07 0.71 ±0.45 0.02 ±0.01
3 讨论
槲皮素广泛存在于中药和食物中,具有抗氧化应激损伤、抗癌、抗炎、降糖、降压、免疫调节等多种保护作用。糖尿病周围神经病变尚缺乏有效治疗手段,有学者发现槲皮素可减少高浓度葡萄糖对神经细胞增殖活性的抑制,减少氧化应激损伤,并可通过诱导自噬而减少凋亡[3-5]。本研究通过离体培养RSC96 细胞作为模型进一步探讨槲皮素在高浓度葡萄糖致雪旺细胞损伤中的保护作用机制。
本实验首先采用MTT 法检测细胞增殖活性,结果发现随着葡萄糖浓度的提高,RSC96 细胞增殖活性降低。此与既往在高浓度葡萄糖环境下原代培养雪旺细胞的研究结果相似[6-8],进而检测了不同浓度的槲皮素对高浓葡萄糖培养的RSC96 细胞增殖活性的影响,结果提示槲皮素对细胞增殖活性具有双向作用,即低浓度的槲皮素可减轻高浓度葡萄糖对雪旺细胞增殖活性的抑制作用;与之相反,高浓度的槲皮素则加剧了高浓度葡萄糖对雪旺细胞增殖活性的抑制作用。
高浓度葡萄糖对雪旺细胞的损伤作用还体现在增加原代培养雪旺细胞的凋亡方面[6,9-11],有文献报道槲皮素可通过诱导自噬而减少凋亡[3-5]。因此,本研究观察了低浓度槲皮素对高糖环境下RSC96 细胞凋亡的影响,结果表明高浓度葡萄糖可增加细胞凋亡,低浓度槲皮素则可减少高糖条件下细胞的凋亡。
Beclin1 基因也称becn1 基因,参与自噬体形成的启动过程,可对细胞自噬活性进行动态监测和判断[12]。3-甲基腺嘌呤(3-MA)是目前最常用的自噬抑制剂[13]。笔者发现加入3-MA 后各组RSC96 细胞增殖活性降低,槲皮素改善高糖培养细胞增殖的作用消失。同时,当自噬被抑制后各组细胞数量稀少,细胞死亡增多,槲皮素抗凋亡的作用也随之消失。以上结果不但提示低浓度槲皮素缓解高糖培养致RSC96 细胞增殖活性减低的作用可能与自噬途径有关,而且表明自噬途径可能也参与了低浓度槲皮素抗凋亡的调节。
综上笔者认为,槲皮素可能通过自噬途径增加高糖培养雪旺细胞的增殖活性、减少细胞凋亡。但是现有研究尚不能完全揭示自噬的分子机制、信号转导途径及其在高糖毒性中具体的病理生理学作用。在今后的工作中可进一步通过在体研究印证自噬对糖尿病周围神经病变的影响及槲皮素的保护作用。
[1]张翔,梁晓春.补肾活血法治疗糖尿病周围神经病变的研究进展[J].环球中医药,2014,7(6):492-496.
[2]孙朦朦,刘苇苇,倪青,等.单味中药治疗糖尿病周围神经病变研究进展[J].环球中医药,2013,6(2):143-146.
[3]Shi Y,Liang XC,Zhang H,et al.Quercetin protects rat dorsal root ganglion neurons against high glucose-induced injury in vitro through Nrf-2/HO-1 activation and NF-κB inhibition[J].Acta Pharmacol Sin,2013,34(9):1140-1148.
[4]Wang K,Liu R,Li J,et al.Quercetin induces protective autophagy in gastric cancer cells:involvement of Akt-mTOR-and hypoxia-induced factor 1α-mediated signaling[J].Autophagy,2011,7(9):966-978.
[5]Harris CS,Asim M,Saleem A,et al.Characterizing the cytoprotective activity of Sarracenia purpurea L.,a medicinal plant that inhibits glucotoxicity in PC12 cells[J].BMC Complement Altern Med,2012,(12):245.
[6]Sun LQ,Chen YY,Wang X,et al.The protective effect of alpha lipoic acid on Schwann cells exposed to constant or intermittent high glucose[J].Biochem Pharmacol,2012,84(7):961-973.
[7]Qu L,Liang XC,Zhang H,et al.Effect of Jinmaitong with Medicated Serum on Proliferation of Rat Schwann Cells Cultured in High Glucose Medium[J].Chinese Journal of Ⅰntegrative Medicine,2008,14(4):293-297.
[8]Qu L,Liang X,Gu B,et al.Quercetin alleviates high glucose-induced Schwann cell damage by autophagy[J].Neural Regen Res,2014,9(12):1195-1203.
[9]Sun LQ,Xue B,Li XJ,et al.Ⅰnhibitory effects of salvianolic acid B on apoptosis of Schwann cells and its mechanism induced by intermittent high glucose[J].Life Sci,2012;90(3-4):99-108.
[10]Sun LQ,Zhao J,Zhang TT,et al.Protective effects of Salvianolic acid B on Schwann cells apoptosis induced by high glucose[J].Neurochem Res,2012,37(5):996-1010.
[11]朴元林,梁晓春,赵丽,等.筋脉通含药血清对高糖培养施万细胞8-羟基脱氧鸟苷和活化的caspase-3 表达的影响[J].医学研究杂志,2011,40(10):35-39.
[12]Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[13]Yang Z,Klionsky DJ.Eaten alive:a history of macroautophagy[J].Nat Cell Biol,2010,12(9):814-822.
