以痴呆、精神症状和运动迟缓为主要表现的路易体痴呆1例
2015-04-21尚延昌朱明伟管维平解恒革贾建军王振福
尚延昌,朱明伟,陈 彤,张 熙,管维平,解恒革,贾建军,王振福
以痴呆、精神症状和运动迟缓为主要表现的路易体痴呆1例
尚延昌,朱明伟,陈 彤,张 熙,管维平,解恒革,贾建军,王振福*
(解放军总医院南楼临床部神经内科,北京 100853)
路易体痴呆是引起老年人群痴呆的第二位常见病因,经尸检确诊的路易体痴呆国内少见报道。患者临床主要表现为进行性认知功能减退,伴有间歇性精神行为异常、视幻觉、对神经安定类药物敏感等症状,随病情进展会出现帕金森综合征和(或)自主神经系统功能障碍。现报道经尸检确诊的路易体痴呆1例,尸检病理结果表明大脑皮质及皮质下结构神经元胞浆内广泛存在α−共核蛋白染色阳性的路易小体,证实了生前临床诊断。希望通过学习本病例,提高国内各科医师对于路易体痴呆的认识水平,以利于本病的早期诊断。
路易体痴呆;路易小体;α−共核蛋白;尸检
1 病例摘要
患者,男性,83岁,大学文化。主因“进行性认知功能减退伴间断性精神行为异常4年余,行动迟缓2年余”于2011年4月1日入院于解放军总医院神经内科。患者自2007年起无明显诱因出现逐渐近记忆力减退(不记得刚做过的事情),伴精神行为异常,表现为多疑(如怀疑家里有坏人,经常半夜起床去重复性关门;老伴与单位同事在一起,则怀疑老伴有不忠行为)。间断出现视幻觉(如看见小鸟飞进房间,墙上有虫子;时常诉说有外人进家门)。2009年出现在家中找不到自己房间、卫生间,外出后找不到家门,并逐渐出现动作迟缓、言语笨拙及双手抖动症状,多次无故跌倒,小便控制时间短、便秘,查体发现体位性低血压(立位时最低可至60/40mmHg;1mmHg=0.133kPa)。2009年5月住院期间查体发现远、近记忆力和计算力减退,构音不清,饮水呛咳。双上肢肌张力高,右侧病理征阳性。2009年7月出现夜间睡眠差、躁动、幻视,自行服用艾司唑仑(1mg)后出现嗜睡。曾诊断为“老年性痴呆”,服用胆碱酯酶抑制剂后出现精神行为症状加重,后调整药物为盐酸美金刚、奋乃静进行治疗,症状改善不明显。2009年曾在外院诊断为“精神分裂症”,给予奥氮平治疗,未规律服药。2011年3月28日精神受刺激后出现被害妄想,打骂老伴、夜间不眠,拒绝服药。2011年3月31日患者精神症状加重,家人自行给予患者口服奥氮平(2.5mg)及硝西泮(硝基安定,2.5mg),下午再次服用奥氮平(2.5mg)后,患者出现嗜睡、小便失禁。门诊以“老年变性病性痴呆”收住我科。既往史:1999年曾因撞车导致头部外伤。配偶体健,有2子1女,均体健。否认运动障碍及痴呆家族史。
入院查体 入院时卧位血压140/80mmHg,立位血压80/60mmHg。内科查体未见明显异常。神经系统查体:意识清楚、言语含糊、面部表情呆板、认知功能下降。双侧眼裂正常,眼球位置居中,各方向运动正常。双侧瞳孔等大等圆,直径约3mm,对光反射灵敏。双侧额纹正常,闭目有力,双侧鼻唇沟对称,示齿口角不偏。双耳听力减退,Rinne试验气导大于骨导,Weber试验居中。伸舌居中,无舌肌萎缩及震颤。四肢肌力5级,肌张力呈齿轮样增高,左侧肢体为著。双侧指鼻试验稳准,双侧跟膝胫试验稳准,Romberg征不能配合。双侧肱二头肌、肱三头肌和膝腱反射对称存在,双侧跟腱反射对称减低。双侧Hoffmann征阴性、右侧Chaddock征、双划征均阳性,左侧病理征未引出。双侧深、浅感觉对称存在。无颈项强直,Kernig征阴性,Brudzinski征阴性。
诊疗经过 入院诊断考虑“路易体痴呆可能性大”。入院时查血、尿、便常规、肿瘤标志物、血清4项、甲状腺功能、叶酸、维生素B12、同型半胱氨酸水平均在正常范围内。2010年8月和2011年1月查简易智能状态量表(Mini-Mental State Examination,MMSE)评分,分别为14分和8分(表1)。2010年8月26日头颅MRI提示脑内多发缺血灶,未见急性病灶,老年性脑改变伴脑萎缩,颞叶相对保留,海马轻度萎缩。2011年4月2日头颅MRI:脑内多发缺血灶,未见急性缺血灶,老年性脑萎缩较前加重。2011年1月12日葡萄糖代谢头颅PET/CT示:双侧额、颞、顶叶葡萄糖代谢减低,两侧纹状体葡萄糖代谢轻度降低(基本对称)。入院后给予营养神经,改善脑代谢及对症支持治疗,口服盐酸美金刚、奥氮平,间断应用艾司唑仑助眠,神经系统功能呈缓慢进行性下降。住院期间神经精神查体痴呆状态,有时自言自语、内容不切题,间断伴有精神行为异常,表现为烦躁,易激惹,攻击陪护人员等。经过治疗后精神症状有改善,可主动与人打招呼,回答简单问题,可在陪伴搀扶下行走,但行走距离逐渐缩短。2011年9月出现肺部感染,此后长期卧床,并出现语言功能逐渐丧失,四肢及颈部肌张力持续性增高,颈部因长期肌张力增高呈后仰位。2014年6月25日再次出现肺部感染,6月30日出现呼吸衰竭,给予行床旁经鼻气管插管。感染期间患者间断出现全身抖动,持续时间数秒到数分钟左右。6月25日曾复查头颅CT示老年性脑改变,未见新发病灶。先后应用氯硝西泮(氯硝安定)、左乙拉西坦、苯妥英钠片控制发作。伴随感染进行性加重,合并出现心、肝、肾、凝血功能等多脏器功能衰竭。2014年7月8日死亡。总病程7年余。为明确生前临床诊断,经家属同意进行尸检。神经系统尸检结果回报,大体病理:脑重1 276g;双侧壳核可见数个腔隙性梗死灶,大小约米粒或绿豆样。双侧黑质色略淡,余未见明显病变。镜下检查:新皮质、边缘系统、杏仁核、丘脑等广泛分布皮质型路易小体;脑室旁核及黑质、蓝斑、迷走神经背核见大量经典型路易小体(图1)。脑干网状核及中缝核亦见大量α−共核蛋白阳性路易小体。上述区域可见密度稀少、中度不等的α−共核蛋白阳性轴索。黑质、蓝斑、迷走神经背核、三脑室旁核等可见严重神经细胞脱失伴胶质细胞增生。扣带回、岛叶、杏仁核、内嗅皮质中度神经元脱失;颞、顶、枕叶轻度脱失;伴有轻、中度胶质细胞增生。海马及海马旁回可见神经原纤维缠结(Braak-2/6级)。广泛新皮质及边缘系统、丘脑、杏仁核等见Aβ阳性斑。轻度脑血管淀粉样变性。
临床病理诊断 弥散性路易体痴呆(dementia with Lewy bodies,DLB)。
2 临床病理讨论
尚延昌经治医师 本病患者为老年男性,隐匿起病,病程慢性进行性加重。主要临床表现为进行性认知功能减退合并间断性精神行为异常,伴有多疑、鲜明的视幻觉等。逐渐出现动作迟缓、言语笨拙及肢体抖动等帕金森综合征表现。合并累及自主神经系统,出现小便控制差、便秘、体位性低血压等表现。对神经安定类药物敏感,服用低剂量安定类药物后即出现嗜睡。查体主要阳性体征为体位性低血压,高级认知功能减退,四肢及颈部肌张力增高,右侧Chaddock征、双划征阳性。定位诊断:依据患者高级认知功能减退,精神行为异常定位于双侧大脑皮质;动作迟缓、言语笨拙、四肢及颈部肌张力增高,定位于锥体外系;小便控制差、便秘、体位性低血压定位于自主神经系统;右侧Chaddock征、双划征阳性,定位于左侧皮质脊髓束。定性诊断:根据老年男性,慢性进行性加重病程,临床主要表现为认知功能减退、精神行为异常、视幻觉,合并有锥体外系及自主神经系统受累表现,对神经安定类药物敏感等,首先考虑诊断DLB的可能性大。
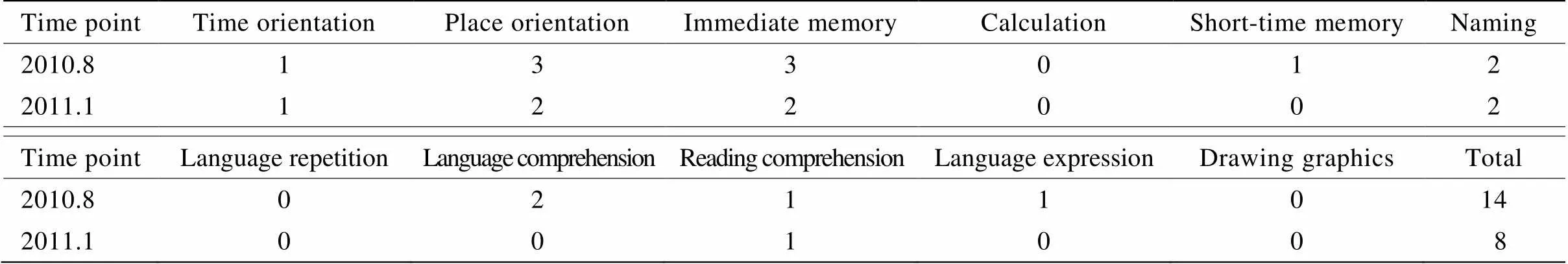
表1 患者不同时间点MMSE评分表
MMSE: Mini-Mental State Examinations
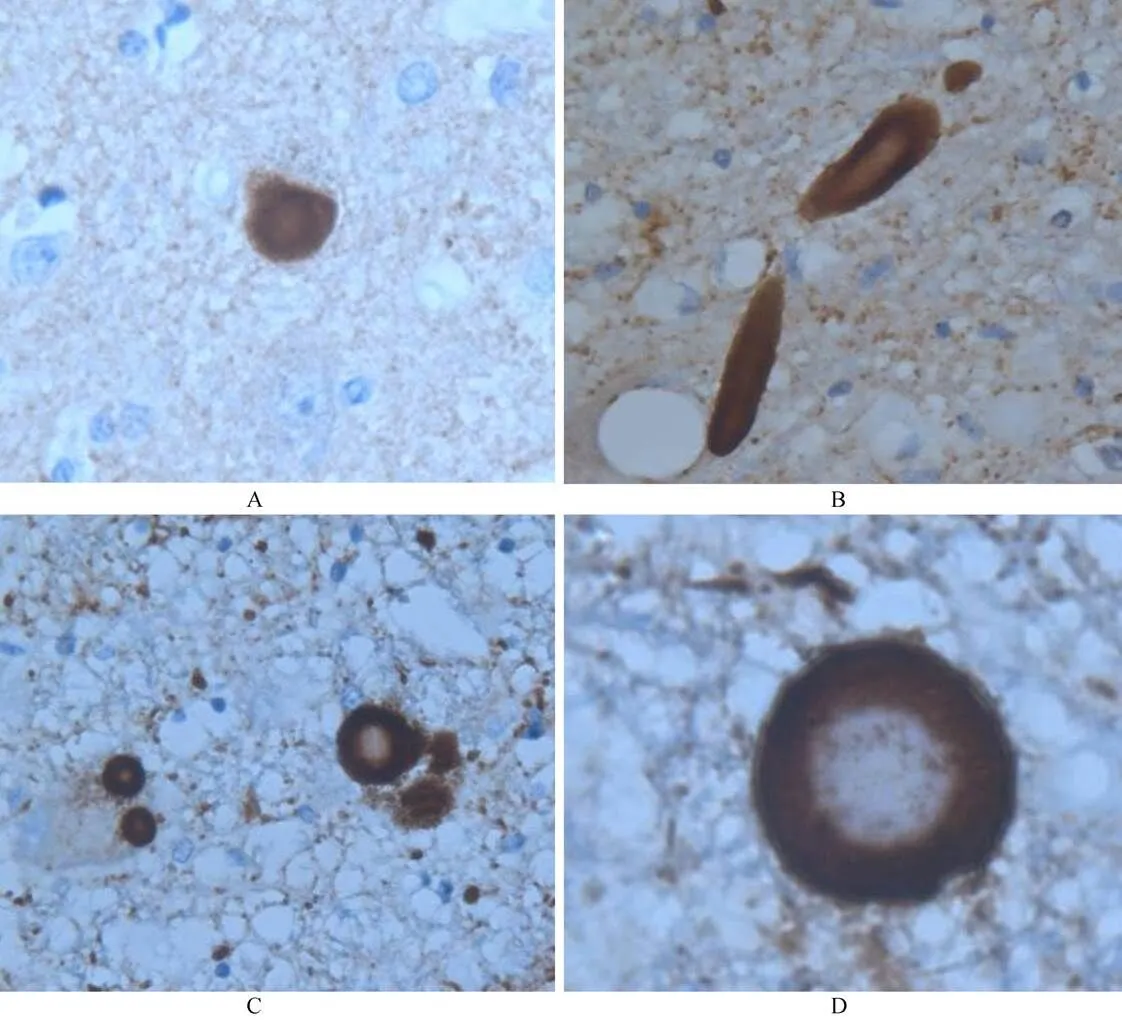
图1 神经元胞浆内路易小体形成
Figure 1 α-Synuclein positive Lewy bodies in cytoplasm of cortical and subcortical neurons (×1000)
A: cerebral cortex; B−D: brainstem neurons. B: midbrain; C: pons; D: medulla
陈彤主管医师 同意DLB的诊断。DLB主要临床表现为波动性认知功能障碍、反复发作的视幻觉和帕金森综合征3主征,特征性病理改变为神经元胞浆内存在路易小体[1]。既往又称弥漫性路易体病、皮质路易体病、老年痴呆型路易体病等。该病在>65岁人群中的患病率为3.6%~6.6%。在痴呆患者中DLB所占比例约为1.7%~30.5%,是发病率仅次于阿尔茨海默病(Alzheimer’s disease,AD)的老年变性病性痴呆[2]。该病起病年龄50~80岁,平均患病年龄74.7岁,男性多于女性。总病程一般为6年,病情进展速度快于AD。2005年版DLB诊断标准将其临床表现划分为核心表现、提示性表现和支持性表现3部分。核心表现包括波动性认知功能障碍、视幻觉、锥体外系功能障碍。提示性表现包括快速动眼(rapid eye movement,REM)期睡眠行为障碍(sleep behavioral disorder,RBD)、对神经安定剂敏感和多巴胺能转运体的功能异常。支持性表现包括反复摔倒和晕厥、一过性无法解释的意识丧失、严重自主神经功能障碍和其他形式(如幻觉,妄想,抑郁)[3]。依据病史和查体,该病例满足:3条核心表现,即病情早期出现认知功能障碍伴有精神行为异常,鲜明的视幻觉,随病情进展出现锥体外系功能障碍;1条提示性表现,即对神经安定类药物敏感,患者因服用安定类药物引起嗜睡。该病例的支持性表现包括自主神经功能障碍、体位性低血压、尿便障碍等。波动性认知功能障碍在疾病早期发生率约58%,随病情进展发生率可达75%,表现为认知功能障碍可在数周内甚至1d内数分钟到数小时有较大变化,异常与正常状态交替出现,常伴明显的注意力和警觉水平的变化。该病例在病程中没有出现有关认知功能障碍症状波动的描述,考虑可能与病程早期家属及患者自身对于症状波动并没有明显的注意和观察、故不能准确提供相关病史等因素有关,但这并不妨碍对该病的诊断。因此该患者从临床上诊断DLB是成立的,这也与尸检病理结果相吻合。
朱明伟主任医师 DLB的病理标志是神经元胞浆内存在路易小体。路易小体主要由不溶性α−共核蛋白异常聚集组成。有关该病的发病机制目前尚未明了。推测可能的机制为α−共核蛋白在氧化应激、内质网应激、衰老等条件作用下,产生蛋白异常折叠、新生蛋白错译后修饰、蛋白降解减少、不恰当的基因表达或剪切等,导致α−共核蛋白由正常可溶状态成为异常折叠的不可溶性丝状蛋白,这些损伤的蛋白聚集在一起形成路易小体。除路易小体外,该病病理表现还包括有大量神经元丢失,并可见老年斑和神经原纤维缠结等。根据路易小体在脑组织分布部位不同可分为脑干型、过渡型和弥散型[4]。脑干型是指路易小体主要局限分布在脑干核团,即黑质、蓝斑、Meynert核、下丘脑神经元内;弥散型是路易小体广泛累及大脑皮质,通常位于前额叶、扣带回、颞叶及岛叶等好发部分,在每100倍显微镜视野内发现>5个路易小体可诊断该型。位于两者之间的为过渡型[4]。该例尸检病理显示新皮质及皮质下结构等广泛分布路易小体,黑质、蓝斑、迷走神经背核等区域可见严重神经细胞脱失伴胶质细胞增生,支持弥散型DLB的诊断。根据是否合并AD病理改变又可分为普通型和纯粹型,普通型即脑内神经元胞浆内出现大量路易小体,合并AD病理改变(老年斑、神经原纤维缠结等),纯粹型是指仅有路易小体形成而不伴AD病理表现[5]。该病例尸检可见脑内神经元内路易小体形成,同时合并存在老年斑和神经原纤维缠结等AD的病理表现,因此该患者应属于普通型。
张熙主诊医师 同意前面几位医师的诊断,且尸检病理进一步证实,在皮质和皮质下结构神经元胞浆内均存在路易小体,因此该患者诊断弥散型DLB的证据充分。近年来研究表明,RBD与α−共核蛋白类神经系统变性疾病,包括帕金森病、DLB及多系统萎缩等关系密切,对于该类疾病的诊断具有重要的辅助作用[6]。RBD发生于快速动眼睡眠期,以睡眠中肌肉松弛间断缺失为特点,临床表现为躯体活动和痉挛增多,伴有复杂剧烈的肢体或躯干运动(如喊叫、摆臂、伴梦境回忆的异常行为等)。多导睡眠描记图显示睡眠期间颊下或肢体肌张力增高,一般发生于痴呆出现前数年。尸检研究表明RBD的病理基础可能是蓝斑和黑质的神经元丢失和路易小体形成[7]。DLB患者在病理分型上可分为脑干型、过渡型和弥散型。在弥散型,路易小体由皮质向下逐渐累及皮质下结构,脑干在病程后期才受累,RBD出现在弥散型DLB病程后期;而在脑干型,路易小体首先累及脑干,因此早期就可出现RBD症状。在临床上可根据RBD出现的早晚来明确DLB的类型。该患者病程早期没有RBD表现,提示可能为弥散型DLB,病理结果进一步证实了该诊断。AD特征性病理改变为β−淀粉样蛋白沉积形成老年斑和tau蛋白过度磷酸化形成的神经元内神经原纤维缠结,属于tau相关蛋白疾病的范畴,而RBD很少出现在tau相关蛋白疾病中。因此,RBD可作为DLB与AD的鉴别诊断的方法之一[8]。
王振福主任 同意大家的分析和诊断。DLB和帕金森病痴呆(Parkinson’s disease dementia,PDD)都属于α−共核蛋白病。目前DLB与PDD的鉴别诊断主要根据是人为划定的“1年原则”[1]。“1年原则”是指若痴呆在帕金森综合征出现后1年内发生,倾向于诊断DLB;若痴呆在帕金森综合征出现后>1年才发生,则倾向于诊断PDD。但“1年原则”并不适用于所有病例,也有文献表明部分DLB病例其痴呆症状发生在帕金森综合征出现2~3年后[9]。DLB患者也可先出现痴呆,后发生帕金森综合征,这种情况需与AD鉴别,DLB痴呆后发生帕金森综合征的相隔时间不长。在临床表现上,虽然两者都可有痴呆、帕金森综合征、精神症状、自主神经功能障碍等特点,但二者仍有不同的临床特征[10]。在PDD病例早期即出现明显锥体外系症状,中后期才出现认知功能改变,而DLB则在早期出现认知功能损害。另外,与PDD相比,DLB锥体外系症状相对较轻,一般为两侧同时发病,无明显的不对称性,只有约50%病例出现静止性震颤。在神经病理方面,两者特征性的病理改变均为神经元胞浆内广泛出现路易小体为特征,但DLB患者在纹状体区域路易小体分布更为广泛,神经元丢失更为严重,而在PDD患者中黑质区域的神经元丢失则更明显,这可能对解释二者在运动症状以及对多巴胺能药物反应存在的差别等方面有所帮助。在影像学方面,两者在头颅MRI或CT上均无特异性表现。在FDG-PET研究中发现,虽然两者均存在壳核和尾状核头的葡萄糖代谢降低,但PDD患者纹状体代谢降低明显不对称,以首发症状对侧的壳核最为明显,而DLB患者的两侧葡萄糖代谢降低基本对称。这种表现也与两组病例的临床表现相符合,即PDD运动障碍常单侧起病,而DLB病例可能为双侧同时受累[11]。淀粉样蛋白成像PET技术研究表明,多数DLB病例11C−6−羟基苯并噻唑(11C-PIB)摄取量显著增加,而PDD患者11C-PIB摄取量无明显变化,提示DLB患者脑内β−淀粉样蛋白(Aβ)的沉积明显重于PDD患者[12]。国外脑脊液标志物相关研究表明,在DLB和PDD病例中均存在脑脊液Aβ1-42的下降,在DLB中更为明显;在DLB中氧化型Aβ1-40升高,而PDD无类似情况,上述情况表明两者可能存在不同的发病机制[13]。对DLB迄今尚无有效的治疗药物能阻止其进展,目前主要为对症支持治疗,药物主要用于改善患者的运动症状、认知功能和精神症状[14]。对于帕金森病,左旋多巴具有明显改善运动症状的作用,而对于DLB,左旋多巴并不能明显改善锥体外系症状,但长远来看左旋多巴治疗对病情延缓有益,因此目前建议给予DLB患者小剂量单一左旋多巴长期维持治疗。由于DLB患者脑内可能存在胆碱能系统缺陷,应注意避免使用苯海索一类的抗胆碱能药物。认知功能改善方面,目前FDA尚无批准任何药物用于改善DLB的认知功能症状。目前临床上虽然也在使用卡巴拉汀、加兰他敏、美金刚等药物,但缺乏确切的临床证据证明上述药物对于改善DLB患者认知功能有效[15]。对于合并精神症状的DLB患者,应首先使用卡巴拉汀治疗,必要时也可以选用小剂量非典型抗精神病药物治疗。典型抗精神病类药物如氟哌啶醇等,DLB患者对其敏感性增加,可引起严重的神经抑制作用,同时存在加重锥体外系症状的可能,应避免使用。该病例在诊治过程中充分考虑到上述药物的适应证和可能存在的副作用,避免了由于不当治疗导致病情加重的可能性。DLB患病数较少,特别是经过病理明确诊断的DLB病例目前国内报道更少,国内医师对于路易体痴呆的认知还有待进一步提高,希望通过对该病例的学习,将有助于提高各科医师对DLB的认识水平,以利于该病的早期诊断。
[1] Mayo MC, Bordelon Y. Dementia with Lewy bodies[J]. Semin Neurol, 2014, 34(2): 182−188.
[2] Vann Jones SA, O’Brien JT. The prevalence and incidence of dementia with Lewy bodies: a systematic review of population and clinical studies[J]. Psychol Med, 2014, 44(4): 673−683.
[3] Karantzoulis S, Galvin JE. Update on dementia with Lewy bodies[J]. Curr Transl Geriatr Exp Gerontol Rep, 2013, 2(3): 196−204.
[4] Kosaka K. Latest concept of Lewy body disease[J]. Psychiatry Clin Neurosci, 2014, 68(6): 391−394.
[5] Winslow AR, Moussaud S, Zhu L,. Convergence of pathology in dementia with Lewy bodies and Alzheimer’s disease: a role for the novel interaction of alpha-synuclein and presenilin 1 in disease[J]. Brain, 2014, 137(Pt 7): 1958−1970.
[6] Ratti PL, Terzaghi M, Minafra B,. REM and NREM sleep enactment behaviors in Parkinson’s disease, Parkinson’s disease dementia, and dementia with Lewy bodies[J]. Sleep Med, 2012, 13(7): 926−932.
[7] Murray ME, Ferman TJ, Boeve BF,. MRI and pathology of REM sleep behavior disorder in dementia with Lewy bodies[J]. Neurology, 2013, 81(19): 1681−1689.
[8] Shand JA, Howe A. Differentiating Alzheimer’s dementia from dementia with Lewy bodies remains challenging[J]. Biomark Med, 2011, 5(3): 373.
[9] Wang Q, Han D, Chen T,. Clinical features of dementia with Lewy bodies in 35 Chinese patients[J]. Chin J Health Care Med, 2013, 15(2): 142−145. [王 琼, 韩 丁, 陈 彤, 等. 35例路易体痴呆临床特点分析[J]. 中华保健医学杂志, 2013, 15(2): 142−145. ]
[10] Savica R, Grossardt BR, Bower JH,Incidence of dementia with Lewy bodies and Parkinson disease dementia[J]. JAMA Neurol, 2013, 70(11): 1396−1402.
[11] Shivamurthy VK, Tahari AK, Marcus C,Brain FDG PET and the diagnosis of dementia[J]. Am J Roentgenol, 2015, 204(1): W76−W85.
[12] Quigley H, Colloby SJ, O’Brien JT. PET imaging of brain amyloid in dementia: a review[J]. Int J Geriatr Psychiatry, 2011, 26(10): 991−999.
[13] Bibl M, Esselmann H, Lewczuk P,. Combined analysis of CSF tau, Aβ42, Aβ1-42% and Aβ1-40% in Alzheimer’s disease, dementia with Lewy bodies and Parkinson’s disease dementia[J]. Int J Alzheimers Dis, 2010: 2010.
[14] Broadstock M, Ballard C, Corbett A. Latest treatment options for Alzheimer’s disease, Parkinson’s disease dementia and dementia with Lewy bodies[J]. Expert Opin Pharmacother, 2014, 15(13): 1797−1810.
[15] Wang HF, Yu JT, Tang SW,Efficacy and safety of cholinesterase inhibitors and memantine in cognitive impairment in Parkinson’s disease, Parkinson’s disease dementia, and dementia with Lewy bodies: systematic review with meta-analysis and trial sequential analysis[J]. J Neurol Neurosurg Psychiatry, 2015, 86(2): 135−143.
(编辑: 刘子琪)
Lewy body dementia with dementia, psychiatric symptoms and bradykinesia as main manifestations: a case report
SHANG Yan-Chang, ZHU Ming-Wei, CHEN Tong, ZHANG Xi, GUAN Wei-Ping, XIE Heng-Ge, JIA Jian-Jun, WANG Zhen-Fu*
(Department of Geriatric Neurology, Chinese PLA General Hospital, Beijing 100853, China)
Dementia with Lewy bodies (DLB), also known as Lewy body dementia, is the second most commonly degenerative cause of dementia in the elderly. At present, there are few reports about DLB confirmed by autopsy in our country. The main clinical manifestations of the patient were progressive cognitive decline, intermittent mental and behavior disorder, visual hallucination, sensitive to antipsychotic drugs, and parkinsonism and/or autonomic nervous system dysfunctions along with the progress. Here we reported such 1 case. The results of autopsy pathology showed that α-synuclein positive Lewy bodies existed extensively in the cytoplasm of cortical and subcortical neurons, which verified the clinical diagnosis before the patient’s death. We hope to enhance the recognition of the disease and facilitate its early diagnosis through studying this case.
dementia with Lewy bodies; Lewy body; α-synuclein; autopsy
R592; R749.1
A
10.11915/j.issn.1671-5403.2015.08.144
2015−07−09;
2015−07−12
王振福,E-mail: zhenfuw@sina.com.cn
