80岁以上高龄重症患者使用万古霉素的安全性分析
2015-04-21毕立清朱冬梅周苏明
黄 敏,周 静,毕立清,韩 艺,张 倩,朱冬梅,周苏明
80岁以上高龄重症患者使用万古霉素的安全性分析
黄 敏,周 静,毕立清,韩 艺,张 倩,朱冬梅,周苏明*
(南京医科大学第一附属医院老年重症监护室,南京 210029)
观察万古霉素治疗革兰阳性菌感染的高龄重症患者有效性及其对肾功能的影响。回顾性地分析2007年1月至2014年3月期间南京医科大学第一附属医院老年重症监护室收治的≥80岁革兰阳性菌感染的老年患者48例,静脉应用万古霉素,观察患者症状及体征变化,进行病原体分析,评价其临床疗效并动态观察用药期间肾功能变化。48例患者使用万古霉素治疗平均疗程为(18±9)d ,临床有效率为72.92%,其中明确培养或涂片有革兰阳性球菌者39例,共培养出菌株50株,经治疗后细菌清除率为82.25%。万古霉素治疗过程中出现肾毒性12例(25%),单因素logistic回归分析显示,治疗前急性生理与慢性健康评分(APACHE Ⅱ)(OR=1.240,95% CI:1.061~1.449,=0.007)、平均万古霉素谷浓度(OR=1.268,95% CI:1.066~1.757,=0.014)、合并使用升压药[(将其分为3层:未用升压药;小剂量升压药;大剂量升压药),(OR=4.335,95%CI:1.620~11.598,=0.003)]、合并使用利尿剂[(将其按照呋塞米日剂量分为4层:≤40mg/d、41~80mg/d、81~120mg/d、>120mg/d),(OR=2.066,95%CI:1.189~3.589,=0.010)]为本组高龄患者万古霉素用药后出现肾毒性的危险因素。多因素logistic回归分析显示,APACHE Ⅱ评分≥25分、平均万古霉素谷浓度≥18mg/L、合并利尿剂(呋塞米≥40mg/d)均会增加高龄患者的肾毒性风险。万古霉素用于高龄重症患者革兰阳性球菌感染的治疗是有效的。高龄重症患者使用万古霉素具有一定的肾毒性风险,其独立危险因素为治疗前APACHE Ⅱ评分≥25分、万古霉素谷浓度≥18mg/L及呋塞米用量≥40mg/d。
万古霉素;老年人,80以上;革兰阳性球菌感染;肾毒性;谷浓度
近年来革兰阳性球菌尤其是耐甲氧西林金黄色葡萄球菌(meticillin-resistant,MRSA)、表皮葡萄球菌和肠球菌属引起的严重肺部感染、腹腔感染及血行感染逐渐增多。老年患者由于其抵抗力差、基础疾病多以及反复使用多种抗生素等原因,发生此类感染的人数大大增加,而且往往病情严重。万古霉素(vancomycin)等糖肽类抗生素是治疗这类耐药球菌感染的重要抗生素。然而该类药物治疗指数低,治疗窗狭窄,且毒性较大。老年人尤其是高龄患者,由于生理功能减退和组织器官萎缩等特殊性,其药代动力学过程与年轻人有较大的差异,毒性及耐药性等问题更易产生。故在应用的同时需注意对其进行血药浓度监测及肾功能检查,以便及时调整剂量,实行个体化给药,在取得良好疗效的同时减少不良反应的发生。既往曾有学者对万古霉素在老年人中使用的疗效及安全性做过分析[1−3],但一般限于>65岁且观察对象为一般患者。目前针对万古霉素在>80岁危重患者的安全性研究尚未见报道。现对南京医科大学第一附属医院老年重症监护病房(Intensive Care Unit,ICU)2007年1月至2014年3月期间收治的48例>80岁应用万古霉素治疗的危重患者的临床资料进行回顾性分析(排除血液透析及未正规监测万古霉素血药浓度的患者),对其应用过程中肾毒性、有效性与血药浓度等因素进行相关分析,以此为临床合理给药提供理论支持。
1 对象与方法
1.1 临床资料
2007年1月至2014年3月在本院ICU使用万古霉素治疗的>80岁重症感染患者(排除接收血液透析及未正规监测万古霉素血药浓度的患者)。其中男41例,女7例,年龄80~94(85.02±3.95)岁,急性生理与慢性健康评分(Acute Physiology And Chronic Health Evaluation,APACHE Ⅱ)15~34分,平均(23.17±5.10)分。本组患者选择万古霉素的依据如下。(1)临床标本(包括呼吸道分泌物、血液、腹腔引流液、胆汁及中段尿)细菌培养及药敏试验提示万古霉素敏感菌群患者;β−内酰胺类抗生素耐药或过敏的革兰阳性球菌感染者。(2)病原学培养未见革兰阳性球菌,但高度怀疑存在革兰阳性球菌。所有患者治疗过程中未应用其他明确对肾功能有影响的药物。
1.2 万古霉素给药及监测方案
按照患者的肌酐清除率(creatinine clearance rate,Ccr)水平决定患者的起始用药剂量,起始用药剂量=15×Ccr/d(mg),根据每天的剂量分1次、2次或3次给药,在第4次给药前测定万古霉素血药谷浓度,根据首次测得的谷浓度调整药物剂量,使万古霉素血药谷浓度达标(2007年1月至2009年12月目标谷浓度保持于10~15mg/L;依据美国传染病学协会(IDSA)等团体2009年《万古霉素治疗指南》[4],谷浓度应维持在>10mg/L,重症感染在15~20mg/L,故自2010年1月起谷浓度保持在15~20mg/L)。每次调整剂量后,连续给药3次后监测谷浓度。在谷浓度达标,相对稳定的情况下,每3~4d监测血肌酐(serum creatinine,SCr)及血药浓度水平,每周监测Ccr。疗程(18±9)d。
1.3 观察指标
记录病程中患者症状及体征变化;用药前、疗程中及结束后查血、尿、便常规,生化常规,C反应蛋白,肝肾功能,血气分析等指标;用药前、疗程中、治疗后进行细菌培养、涂片和药敏检查结果以及相关影像学检查。记录万古霉素用药前、疗程中及治疗后的SCr及Ccr,并进行相关分析。肾毒性判断标准:接受万古霉素治疗期间,较用药前基线水平,SCr绝对值连续2次增长5mg/L或增长率≥50%。为分析高龄患者使用万古霉素后出现肾毒性的风险因素,比较出现肾毒性组与未出现组年龄、治疗前APACHE Ⅱ评分、治疗前SCr、Ccr、使用过程中监测的万古霉素谷浓度平均值、使用疗程及合并使用利尿剂、升压药等指标。
1.4 疗效评价
根据原卫生部1993年颁布的《抗菌药物研究指导原则》,临床疗效判定标准为(1)痊愈:症状、体征、实验室检查及病原学检查4项指标,均恢复正常;(2)显效:病情明显好转,但上述4项有1项未完全恢复正常;(3)好转:用药后病情有所好转,但不够明显;(4)无效:用药72h后病情无明显进步或有加重者。痊愈、显效和进步总称为临床有效;无效为临床失败。
1.5 统计学处理
2 结 果
2.1 临床疾病、感染分布情况及万古霉素临床疗效
48例患者中,合并高血压35例,合并冠状动脉粥样硬化性心脏病21例,合并糖尿病17例。感染分布:肺部感染26例,血行感染10例,腹腔感染2例,胆道感染1例,尿路感染1例,肺部感染合并血行感染7例,肺部感染合并尿路感染1例。万古霉素疗程(17.9±9.1)d,治愈9例,显效14例,进步12例,无效13例,临床有效率为72.92%(表1)。
2.2 合并用药情况
48例患者中,均联合使用抗感染药物,其中联用1种抗感染药物6例(12.50%),联用两种抗感染药物34例(70.83%),联用3种抗感染药物8例(16.67%);在所有与万古霉素联用的抗感染药物中,主要有氟康唑33例(68.75%),碳青霉烯类32例(66.67%),β−内酰胺类及β−内酰胺类+酶抑制剂16例(33.33%),伏立康唑4例(8.33%),氟喹诺酮类3例(6.25%)。
2.3 万古霉素治疗后细菌清除率
细菌清除率指万古霉素治疗结束后某特定细菌的清除率。在被调查的48例患者中,均送病原学检查及药敏试验,其中9例为无阳性球菌病原学依据的经验性治疗,其余39例均有阳性球菌病原学依据,占81.25%。所得阳性球菌菌株药敏试验:对万古霉素均敏感。送检标本包括:痰、血液、腹腔引流液、胆汁及中段尿。具体细菌学结果及清除情况(治疗后连续2次培养转阴为清除标准)见表2。
2.4 万古霉素治疗过程中肾毒性发生的比率及相关资料比较
48例患者在接受万古霉素治疗期间均持续监测SCr、Ccr等变化,共有12例(25.0%)出现肾毒性改变,其中9例(18.8%)继发多脏器功能衰竭而死亡,2例(4.2%)接受血液透析治疗,1例(2.1%)停药后肾功能有恢复。比较出现肾毒性组及未出现肾毒性组相关临床资料(表3),两组在治疗前APACHE Ⅱ评分及万古霉素谷浓度差异有统计学意义(=0.002,=0.003)。
2.5 万古霉素治疗过程中肾毒性发生相关的危险因素分析
单因素logistic回归分析结果显示,治疗前APACHE Ⅱ评分(OR=1.240,95% CI:1.061~1.449,=0.007)、万古霉素谷浓度(OR=1.268,95% CI:1.066~1.757,=0.014);合并使用升压药[(将其分为3层:未用升压药、小剂量升压药、大剂量升压药),(OR=4.335,95% CI:1.620~11.598,=0.003)]、合并使用利尿剂[(将其按照呋塞米日剂量分为4层:≤40、41~80、81~120、>120mg/d(OR=2.066,95% CI:1.189~3.589,=0.010)]为本组高龄患者万古霉素用药后出现肾毒性的危险因素(表4)。为进一步寻找APACHE Ⅱ评分、万古霉素谷浓度、合并利尿剂及升压药使用致肾毒性增加的折点,我们拟将APACHE Ⅱ评分≥25分、万古霉素谷浓度≥18mg/L、合并利尿剂(呋塞米≥40mg/d)及升压药[(去甲肾上腺素≥0.5μg/(kg·min)或多巴胺≥20μg/(kg·min)]作为危险因素进一步行多因素危险因素分析,因合并使用去甲肾上腺素≥0.5μg/(kg·min)或多巴胺≥20μg/(kg·min)的患者均出现了肾毒性,故未将其纳入。多因素logistic回归分析进一步显示,APACHE Ⅱ评分≥25分、万古霉素谷浓度≥18mg/L、合并利尿剂(呋塞米≥40mg/d)均会增加高龄患者的肾毒性风险(表5)。
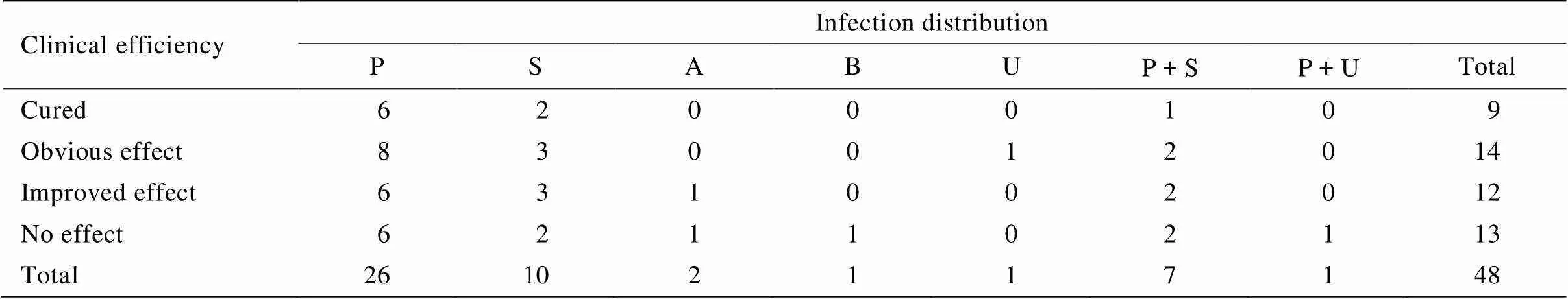
表1 临床感染分布情况及万古霉素临床疗效
P: pneumonia; S: sepsis; A: abdominal infection; B: biliary tract infection; U: urinary infection; P+S: pneumonia concomitant with sepsis; P+U: pneumonia concomitant with urinary infection
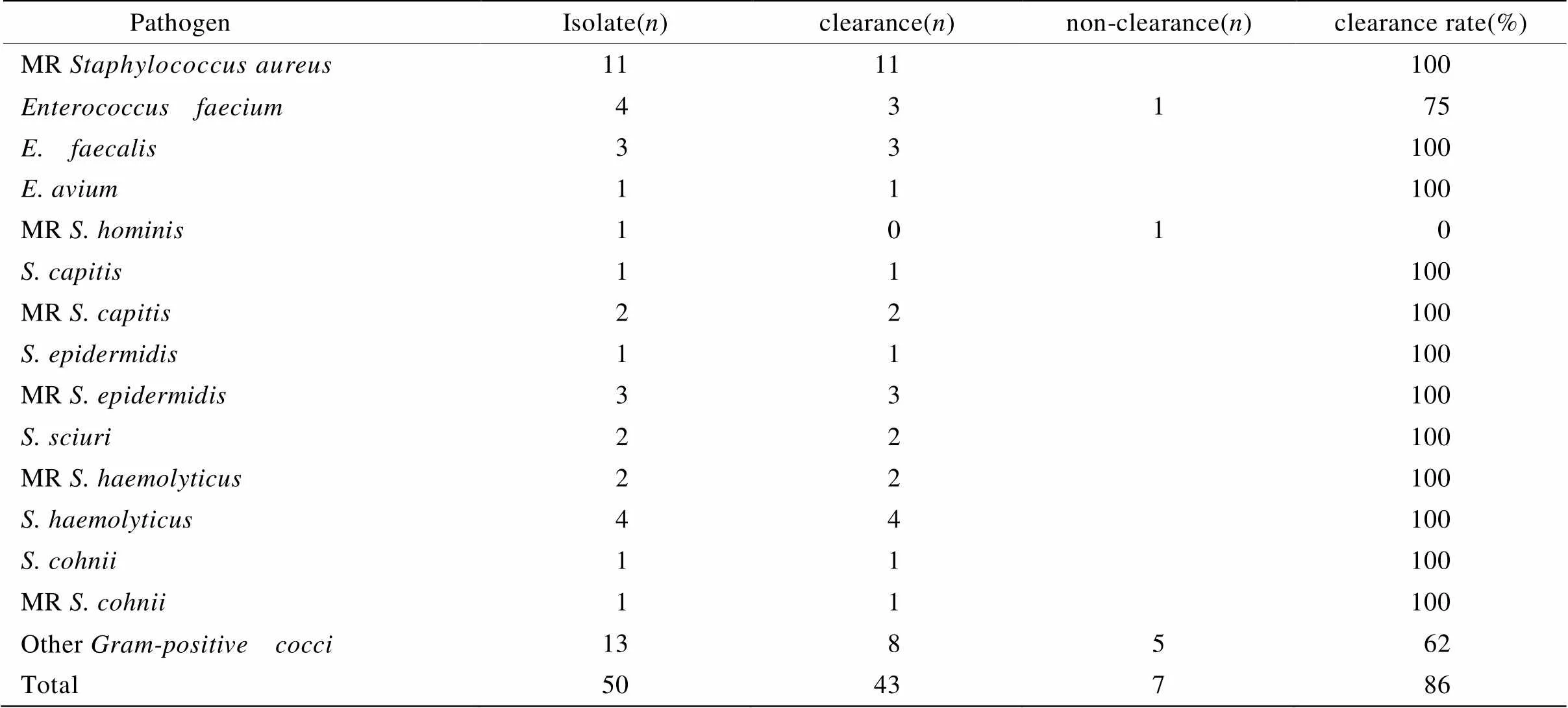
表2 病原学检查结果及清除率
MR: meticillin-resistant
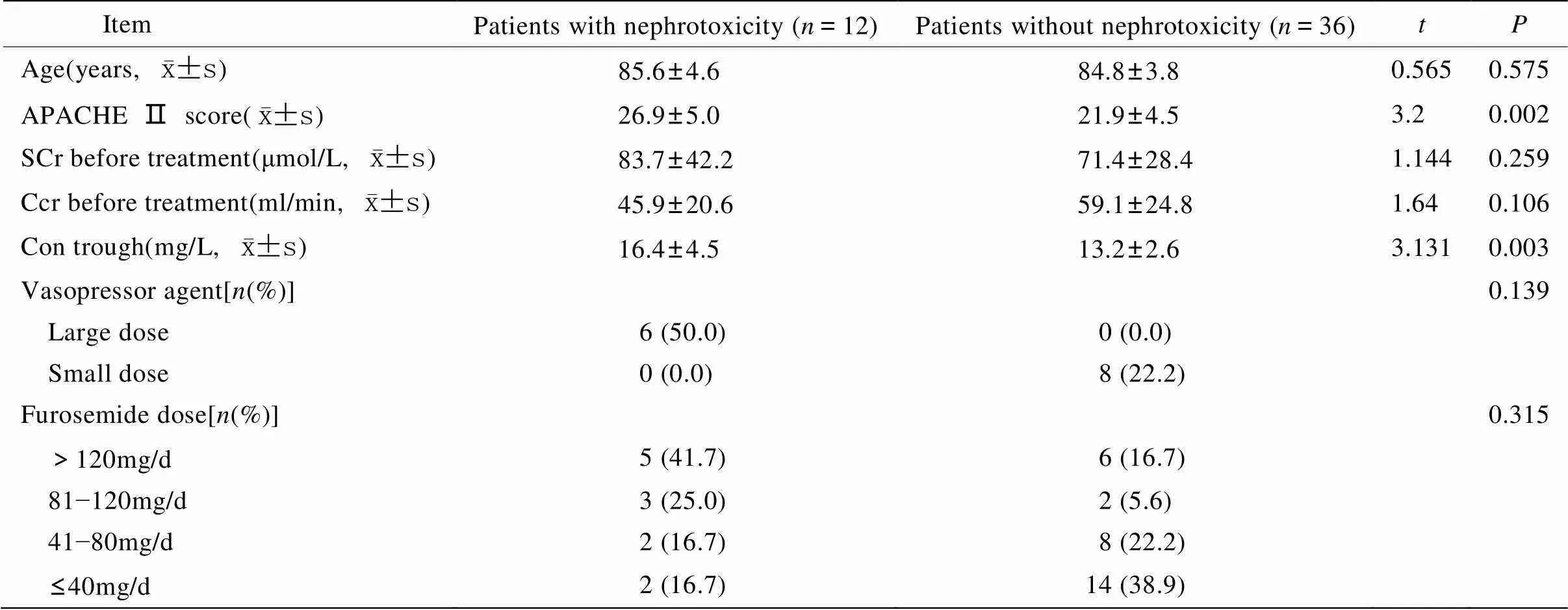
表3 肾毒性组与无肾毒性组相关资料比较
SCr: serum creatinine; Ccr: creatinine clearance rate; Con trough: vancomycin trough concentration; large dose of vasopressor agent: norepinephrine≥0.5μg/(kg·min) or dopamine≥20μg/(kg·min); small dose of vasopressor agent: norepinephrine<0.5μg/(kg·min) or dopamine<20μg/(kg·min)
3 讨 论
临床上万古霉素主要应用于治疗MRSA、表皮葡萄球菌及肠球菌属感染等。MRSA等耐药革兰阳性菌感染将增加患者病死率,延长住院时间,增加住院费用。有学者[5]综合分析既往30多项研究证实,MRSA感染与病死率增高显著相关,其患者病死率是甲氧西林敏感金黄色葡萄球菌感染者的20倍。近年来,治疗MRSA感染的新型抗菌药物也在不断地应用于临床,如利奈唑胺(linezolide)、达托霉素(daptomycin)、特拉万星(telavancin)和头孢罗林酯(ceftaroline fosamil)等[6]。尽管这些新型抗菌药物有很大的发展前景,但目前被批准的临床适应证尚有限,没有一种药物能替代万古霉素在治疗MRSA感染中的地位[7]。并且新型抗菌药物治疗MRSA严重感染患者的疗效尚不能确定,糖肽类抗生素仍是治疗MRSA的首选药物。
在本组入选48例患者中,39例(81.25%)具有阳性球菌病原学依据,部分患者存在≥2种球菌感染,共分离出阳性球菌50株,以葡萄球菌属为主占58%(MRSA 22%,耐甲氧西林其他葡萄球菌22%、肠球菌属16%)。所有病例经万古霉素治疗后,临床有效率达72.92%,细菌学清除率为86%。杜斌等[8]报道万古霉素对于ICU阳性球菌感染患者,临床总有效率90%,细菌学总清除率达90%,有效率及细菌清除率均较本组资料高。考虑与本组资料中患者均为>80岁高龄,混合感染及感染迁延者较多,且高龄患者自身抵抗力差,感染不易清除等有关。
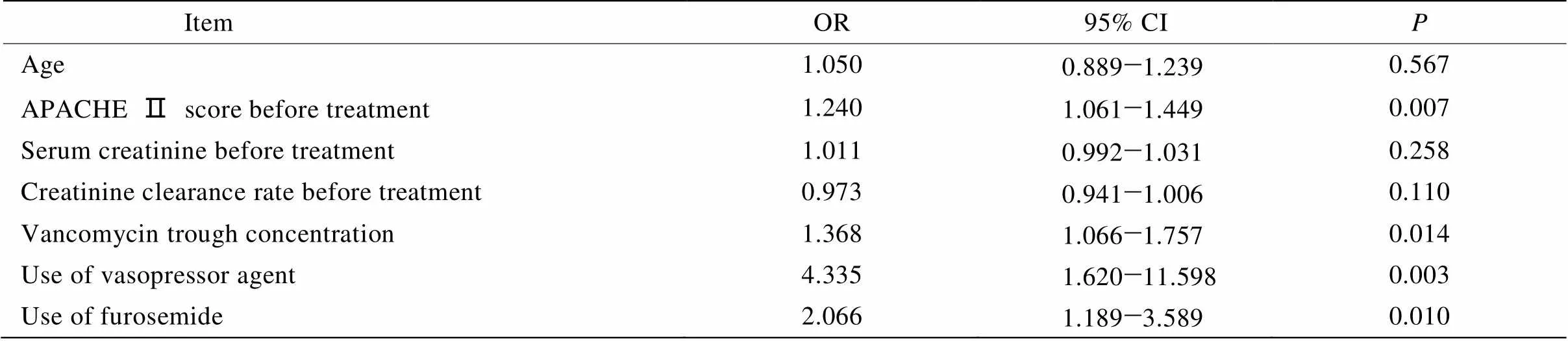
表4 万古霉素用药后高龄患者肾毒性单因素危险因素分析

表5 万古霉素用药后高龄患者肾毒性多因素危险因素分析
万古霉素主要以原型从肾小球滤过,经近端肾小管的重吸收和分泌而排出,还有少部分则通过肝代谢。在老年患者中,由于肾对万古霉素的清除率下降可引起万古霉素的蓄积继而增加肾毒性,因此临床应用时应根据肾功能状态对剂量做相应的调整。现有证据表明,万古霉素的药物浓度监测对于降低肾毒性的发生非常必要[9]。研究显示,万古霉素药物浓度监测能使医师及时调整给药方案,有效降低患者的肾毒性风险(<0.05)[10]。根据IDSA等团体《指南》,谷浓度应维持在>10mg/L,重症感染在15~20mg/L,不需要监测峰浓度[4]。但同时《指南》也指出,支持万古霉素血药谷浓度维持在15~20mg/L的安全性资料有限,故有待进一步研究。在本组高龄重症患者中,我们以谷浓度维持在10~20mg/L为目标,常规给予监测万古霉素谷浓度,并以此调整给药方案。结果显示肾毒性发生率占25%。对于高龄重症患者,其往往合并有多种基础疾病,伴有单个或多个脏器功能不全,因而发生肾毒性的风险较年轻患者明显升高[11]。为进一步明确高龄患者在使用万古霉素时发生肾毒性的危险因素,我们将两组患者年龄、治疗前APACHE Ⅱ评分、治疗前SCr、Ccr、使用过程中监测的万古霉素谷浓度、使用疗程及合并使用利尿剂、升压药等指标进行了比较。结果显示,肾毒性组治疗前APACHE Ⅱ评分较无肾毒性组明显升高。患者APACHE Ⅱ评分越高,提示患者越危重,各脏器功能的储备可能越差,肾毒性的发生也相应增加。Elting等[12]观察了726例癌症患者(年龄17~86岁)使用万古霉素发生肾毒性的情况,发现APACHE Ⅱ评分≥40分的患者比APACHE Ⅱ评分<40分的患者发生肾毒性的概率明显增加。同时肾毒性组万古霉素谷浓度较无肾毒性组也明显升高。这与以往的研究相一致,Lodise等[13]从药动学角度研究万古霉素谷浓度与肾毒性的关系,结果万古霉素谷浓度>20mg/L和10~20mg/L时,肾毒性发生率分别为33%和21%,谷浓度<10mg/L时,肾毒性发生率降至5%。另有研究表明[14],当万古霉素的谷浓度超过推荐范围>20mg/L时,肾毒性发生率非常高,甚至高达65%。
由于本研究入组者均为高龄危重患者,其本身合并心功能不全、重症感染及循环不稳定的概率极大,部分患者需同时合用利尿剂及升压药。为进一步明确利尿剂与升压药的合并使用是否会增加高龄患者的肾毒性风险,我们将患者按照是否合并使用升压药及使用剂量将其分为3层:未用升压药、小剂量升压药、大剂量升压药。同时按照使用呋塞米日剂量分为4层:≤40、41~80、81~120、<120mg/d。经单因素回归分析显示,合并使用升压药、呋塞米均为本组高龄患者万古霉素用药后出现肾毒性的危险因素。曾有学者[15]在多元回归分析中发现老年人同时使用袢利尿剂与万古霉素肾毒性的发生呈正相关,这与我们的结果一致。利尿剂在减轻患者水负荷的同时,可直接(肾脏血供减少)或间接(细胞外液减少)引起肾血流动力学的异常,肾血流灌注量显著减少和肾小球滤过率下降,导致肾前性氮质血症甚至急性肾小管坏死。故随着利尿剂使用剂量的增加,肾毒性的发生也增加。对于重症休克患者,在积极液体复苏后,升压药的使用可以改善患者血压,保证重要脏器的灌注,为后续的治疗争取时间,但大剂量升压药的使用往往会影响到肾等内脏血流供应。此外,在本组研究中,合并使用大剂量升压药的患者都出现肾毒性。需用大剂量升压药的患者提示其病情较重,发生肾毒性的风险也增加。
万古霉素用于高龄重症患者革兰阳性球菌感染的治疗是有效的,目前其仍是治疗MRSA感染最有效的药物之一。由于高龄重症患者本身肾脏储备功能低,且疾病严重程度、合并用药等多种因素均使其在使用万古霉素时的肾毒性风险增加。我们的研究显示APACHE Ⅱ评分≥25分、万古霉素谷浓度≥18mg/L、合并利尿剂(呋塞米≥40mg/d)、合并大剂量升压药是>80岁使用万古霉素治疗的重症患者发生肾毒性的独立危险因素,故我们在临床工作中,需常规监测万古霉素的血药浓度,根据血药浓度调整药物剂量。对于需合并使用大剂量升压药物或大剂量利尿剂的患者,建议换用其他对肾功能影响较小的药物,减少肾毒性的发生。
[1] Bi MH. The efficacy and safety of vancomycin in the treatment of old population[J]. Beijing Med J, 2011, 33(6): 491−493. [毕明慧. 老年重症感染患者使用万古霉素的疗效及安全性分析[J]. 北京医学, 2011, 33(6): 491−493.]
[2] Shi XJ, Cai Y, Wei GY,. Analysis on therapeutic drug monitoring data of vancomycin in 64 elderly patients[J]. Chin J Drug Appl Monit, 2012, 9(3): 129−135. [石秀锦, 蔡 郁, 魏国义, 等. 64例老年患者万古霉素血药浓度监测结果分析[J]. 中国药物应用与监测, 2012, 9(3): 129−135.]
[3] Yu CN, Wang F, Zhang J,Analysis of clinical application of vancomycin in elderly patients over 70 years old in our hospital during 2011−2012[J]. China Pharm, 2013, 24(34): 3194−3197. [于春娜, 王 芳, 张 杰, 等. 2011−2012年我院70岁以上老年患者万古霉素临床用药分析[J]. 中国药房, 2013, 24(34): 3194−3197.]
[4] Liu XL, Huang X. The guideline of the treatment of vancomycin recommended by the Infectious Diseases Society of America, the American Pharmacists Association and Infectious Diseases Pharmacists Society[J]. Chin J Infect Control, 2009, 8(5): 373−374. [刘小丽, 黄 勋. 美国感染病学会、美国药师学会、感染病药师学会共同推荐的万古霉素治疗指南[J]. 中国感染控制杂志, 2009, 8(5): 373−374.]
[5] Usery JB, Vo NH, Finch CK,. Evaluation of the treatment of methicillin-resistantbacteremia[J]. Am J Med Sci, 2015, 349(1): 36−41.
[6] Poon H, Chang MH, Fung HB. Ceftaroline fosamil: a cephalosporin with activity against methicillin-resistant[J]. Clin Ther, 2012, 34(4): 743−765.
[7] Wong-Beringer A, Joo J, Tse E,. Vancomycin-associated nephrotoxicity: a critical appraisal of risk with high-dose therapy[J]. Int J Antimicrob Agents, 2011, 37(2): 95−101.
[8] Du B, Chen DC, Liu DW. Efficacy and nephrotoxicity of vancomycin in the treatment of Gram positive infections[J]. Chin Crit Care Med, 2003, 15(1): 32−34. [杜 斌, 陈德昌, 刘大为. 万古霉素治疗84例革兰阳性球菌感染的效果与肾毒性评价[J]. 中国危重病急救医学, 2003, 15(1): 32−34.]
[9] Jelassi ML, Benlmouden A, Lefeuvre S,. Level of evidence for therapeutic drug monitoring of vancomycin[J]. Therapie, 2011, 66(1): 29−37.
[10] Huang YZ, Mao MY, Yuan KX. Clinical application of drug monitoring of vancomycin[J]. Chin J Infect Chemother, 2011, 11(4): 295−298.[黄义泽, 毛名扬, 袁孔现. 万古霉素血药浓度监测的临床应用[J]. 中国感染与化疗杂志, 2011, 11(4): 295−298.]
[11] Hu JL, Zhang J. Research updates of vancomycin nephyrotoxicity[J]. Chin J Infect Chemother, 2013, 13(5): 394−399. [胡佳丽, 张 菁. 万古霉素肾毒性的研究进展[J]. 中国感染与化疗杂志, 2013, 13(5): 394−399.]
[12] Elting LS, Rubenstein EB, Kurtin D,. Mississippi mud in the 1990s: risks and outcomes of vancomycin-associated toxicity in general oncology practice[J]. Cancer, 1998, 83(12): 2597−2607.
[13] Lodise TP, Patel N, Lomaestro BM,. Relationship between initial vancomycin concentration-time profile and nephrotoxicity among hospitalized patients[J]. Clin Infect Dis, 2009, 49(4): 507−514.
[14] Avent ML, Vaska VL, Rogers BA,Vancomycin therapeutics and monitoring: a contemporary approach[J]. Intern Med J, 2013, 43(2): 110−119.
[15] Meaney CJ, Hynicka LM, Tsoukleris MG, Vancomycin-associated nephrotoxicity in adult medicine patients: incidence, outcomes, and risk factors[J]. Pharmacotherapy, 2014, 34(7): 653−661.
(编辑: 刘子琪)
Safety of vancomycin in over-80-year-old patients with severe Gram-positive infections
HUANG Min, ZHOU Jing, BI Li-Qing, HAN Yi, ZHANG Qian, ZHU Dong-Mei, ZHOU Su-Ming*
(Geriatric Intensive Care Unit, the First Affiliated Hospital, Nanjing Medical University, Nanjing 210029, China)
To investigate the efficacy of vancomycin in the treatment of severe Gram-positive infections in very old patients and determine its effect on renal functions.A total of 48 very old patients (age ≥80 years) with confirmed Gram-positive infection admitted in our geriatric unit from January 2007 to March 2014 were included in this study. They all received venous injection of vancomycin. Pathogen analysis was conducted for all the patients. Their signs and symptoms were observed before and after the treatment, as well as the clinical efficiency. And renal functions were evaluated dynamically during the treatment.The course of vancomycin treatment was averagely (18±9)d for the 48 patients, and the clinical efficiency was 72.92%. Among the 48 patients, 39 were infected by Gram-positive cocci in the bacterial culture or in smear test, and a total of 50 isolated strains were obtained. The bacterial clearance rate reached 82.25% after the vancomycin therapy. During the vancomycin treatment, 12 cases had renal toxicity, accounting for 25% of the total cases. Univariate logistic analysis showed that pre-treatment score of Acute Physiology And Chronic Health Evaluation (APACHE)Ⅱ (OR=1.240, 95% CI: 1.061−1.449,=0.007), mean trough concentration of vancomycin (OR=1.268, 95% CI: 1.066−1.757,=0.014), the combined use of vasopressor agent (stratified into 3 groups, receiving no, small and large doses; OR=4.33, 95% CI: 1.620−11.598,=0.0035), and the combined use of diuretics (stratified into 4 groups according to daily dose of furosemide, that is, ≤40, 41−80, 81−120 and >120mg/d; OR=2.066, 95% CI: 1.189−3.589,=0.010) were risk factors for renal toxicity in the cohort during vancomycin treatment. Multivariate logistic regression analysis demonstrated that APACHE Ⅱ score ≥25 points, trough concentrations of vancomycin ≥18mg/L, and the combined use of diuretics (furosemide ≥40mg/d) would increase the risks of renal toxicity in the elderly patients.Vancomycin is efficient in the treatment of severe Gram-positive infections in the elderly patients. But for them, the treatment leads to certain risk for renal toxicity, and the pre-treatment APACHE Ⅱ score ≥25 points, trough concentrations of vancomycin ≥18mg/L, and combined use of diuretics (furosemide ≥40mg/d) are independent risk factors for the toxicity.
vancomycin; aged, 80 and over; severe Gram-positive infections; nephrotoxicity; trough concentrations
R978.16; R453.2
A
10.11915/j.issn.1671-5403.2015.04.058
2015−02−09;
2015−03−12
周苏明, E-mail: zhousmco@aliyun.com
