Src激酶特异性抑制剂PP2对人胆管癌QBC939细胞侵袭能力的影响和机制研究
2015-04-20王刚解寒冰戚文涛董梁
王刚,解寒冰,戚文涛,董梁
(1.郑州人民医院 急诊科,河南 郑州450000;2.郑州人民医院 普通外科,河南 郑州450000)
胆管癌是一种原发于左右肝管至胆总管下端的肝外胆管上皮的恶性肿瘤,占所有消化道肿瘤的3.0%[1],占肝胆恶性肿瘤的10.0%~20.0%[2],且其发病率呈逐年上升趋势。胆管癌早期发现率低,转移性强,手术切除是唯一有效地治疗方法[3-4],手术切除率为32.0%~51.0%。根治性手术后,胆管癌患者的3年生存率为40.0%~60.0%[5],5年生存率低于20.0%[6]。绝大多数胆管癌患者术后易于复发,未见转移者手术切除后,3年复发率13.3%,5年复发率为71.4%;肝区转移者手术切除后,3年复发率73.9%,5年复发率为100.0%,复发的主要原因为肝及肝门转移[7]。因此,抑制胆管癌的侵袭转移是胆管癌防治以及改善预后的重要环节。Src基因是第1个被发现的有内在络氨酸活性的癌基因,其表达的Src激酶是一种不需要受体的膜相关信号转导蛋白激酶[8],且该Src激酶的表达水平和肿瘤的高侵袭性和不良预后密切相关[9]。因此,越来越多的研究把Src激酶被作为恶性肿瘤中抗肿瘤药物的一个作用靶点,将Src激酶抑制剂用于预防和治疗恶性肿瘤[10]。但是,截至目前,Src激酶在胆管癌中的研究却是非常有限,本研究旨在探讨Src激酶特异性抑制剂PP2对人胆管癌QBC939细胞侵袭能力的影响和机制,为应用Src激酶抑制剂治疗胆管癌、改善患者预后提供可靠的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 人胆管癌QBC939细胞株购自上海欣然科技发展有限公司
1.1.2 主要试剂 细胞培养用RPMI 1640培养液、胎牛血清(FCS)、青霉素-链霉素(P-S双抗)等均购自美国GIBCO公司,使用前按照89∶10∶1比例配制成完全1640培养液;细胞培养板购自美国Costar公司;Src激酶特异性抑制剂PP2购自Sigma公司;兔抗人磷酸化Src(p-Src) 单克隆抗体(Tyr416)购自Millipore公司产品;鼠抗人β-actin单克隆抗体购自北京博奥森生物技术有限公司产品;Transwell侵袭小室(8 pm孔径)购自Millipore公司;细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自碧云天生物技术研究所;mRNA抽提试剂盒miRNeasy Mini Kit购自QIAGEN公司;cDNA逆转录试剂盒ReverAidTM First Strand Cdna Synthesis Kit购 自Thermo公 司;RT-PCR 试 剂 盒FastvStart Universal SYBR Green Master Kit购自罗氏公司。
1.2 方法
1.2.1 细胞培养 人胆管癌QBC939细胞购自上海欣然科技发展有限公司,用含10%胎牛血清和P-S双抗的RPMI 1640培养液,置于37℃、二氧化碳CO2体积分数为5%的培养箱内培养;常规更换培养液,胰酶消化传代,所有实验均采用处于对数生长期的细胞。
1.2.2 实验分组 依据文献,本课题实验设4组,A1组:对照组(不做处理);A2组、A3组、A4组(PP2组:分别用2.5、5.0和10.0μmol/L的Src激酶特异性抑制剂PP2处理),各组均为6×3=18次/个观测样本,即每组样本>6,实验重复3次。
1.2.3 PP2溶液的配制 Src激酶特异性抑制剂PP2购于Sigma公司,溶解度为20mg/ml,溶剂为DMSO,将其配制成饱和溶液,随后用含10%胎牛血清的培养液稀释获得50μmol/L的浓度,使用时根据需要再稀释获得不同浓度的工作液。
1.2.4 W estern Blot技术检测PP2对QBC939细胞Src激酶磷酸化的影响 取对数生长期的人胆管癌QBC939细胞分别用2.5、5.0和10.0μmol/L浓度的PP2处理48 h后,收集细胞、裂解、提取蛋白,并以BCA法测定细胞裂解蛋白含量。取80μg蛋白样品行SDS-PAGE分离蛋白,随后电转移至聚偏二氟乙烯膜(PVDF),5%脱脂奶粉封闭非特异性抗原,加入1∶500稀释的兔抗人磷酸化Src(p-Src)单克隆抗体(Tyr 416),1∶200稀释的鼠抗人β-actin单克隆抗体作为内对照,4℃反应过夜,用含0.1%Tween 20的TBS洗膜,再加入1∶1 000稀释的辣根过氧化物酶标记的二抗,室温下反应1 h,洗膜后DAB显色,将条带结果进行扫描。
1.2.5 人胆管癌QBC939细胞体外侵袭实验 用50mg/L基质胶1∶4稀释液包被8/μm孔径Transwell小室滤膜的上表面,于37℃、5%二氧化碳CO2培养箱中温育1 h,用L-15水化小室滤膜上、下表面。消化收集细胞,离心弃去培养液。用PBS洗1~2遍,用含0.1% BSA的L-15培养基重悬,调整细胞密度至1×105/ml的细胞悬液。24孔板中放置Transwell侵袭小室,先在小室上层分别加入事先制备好的4组细胞悬液200μl,轻轻摇匀,再向下室加入600μl含10%FBS的L-15培养液。置24孔板于37℃、无二氧化碳CO2培养箱中培养。48 h后从孔板中移出小室,用脱脂棉拭去小室滤膜上层未通过微孔的细胞,将此滤膜先于4%多聚甲醛中固定30 min,1%结晶紫染色10min,使侵袭到滤膜下层的细胞充分着色呈紫蓝色,轻轻洗涤残余染料,倒置显微镜观察,每组随机选择6个视野,计数。并重复实验3次。
1.2.6 PCR技术检测PP2对QBC939细胞中侵袭相关分子mRNA表达的影响 取对数生长期的人胆管癌QBC939细胞经PP2处理48 h后,收集细胞,提RNA,逆转录为cDNA,取各组cDNA,用ddH2O稀释50倍。按要求加入试剂cDNA、正义引物,反义引物和ROX。上机,按20μl体系,设定以下循环:①50℃,2 min;②95℃,10 min;③95℃,15 s;④60℃,1min;⑤重复第③④步;⑥95℃,15 s;⑦60℃,30 s;⑧95℃,15 s。上样检测。
1.2.7 W estern Blot技术检测PP2对QBC939细胞中侵袭相关分子蛋白表达的影响 取对数生长期的人胆管癌QBC939细胞经PP2处理48 h后,收集细胞、裂解、提取蛋白,并以BCA法测定细胞裂解蛋白含量取80μg蛋白质,12%SDS-PAGE法进行分离后,转移至PVDF膜,5%脱脂奶粉封闭非特异性抗原,分别加入稀释后的鼠抗人E-cadherin和CD44一抗,1∶200稀释的鼠抗人β-actin单克隆抗体作为内对照,4℃反应过夜,用含0.1%Tween 20的TBS洗膜,再加入1∶1 000稀释的辣根过氧化物酶标记的二抗,室温下反应1 h,洗膜后DAB显色,将条带结果进行扫描。
1.3 统计学方法
用SPSS 17.0统计软件进行统计分析。试验观测数据主要为计量数据,文中以均数±标准差(±s)表示。通过正态性检验的资料。多组间的整体比较为单因素方差分析,两两组间的多重比较为LSD法和HSD法,两法比较结果互为参考。部分试验资料为轻微偏态且方差不齐同,采用1+LOG转换,而后行单因素方差分析。检验水准均取α=0.05。
2 结果
2.1 Src激酶特异性抑制剂PP2抑制p-Src的表达
经Src激酶抑制剂PP2处理后,用Western Blot技术检测Src磷酸化水平,结果显示,PP2组中p-Src蛋白的表达水平明显低于对照组。结果提示,Src激酶抑制剂PP2能有效抑制Src激酶的活性。见图1。
2.2 Src激酶特异性抑制剂PP2对QBC939细胞侵袭能力的影响
经Src激酶抑制剂PP2处理后,用Transwell小室法检测QBC939细胞的体外侵袭能力。结果发现,PP2组穿过小室的细胞数显著低于对照组的(38.33±9.67)个,经单因素方差分析,差异具有统计学意义;经多重比较分析,各实验组(A2、A3和A4)与对照组(A1-Control)比较,差异均有统计学意义。详见表1、2和图2。实验结果表明,Src激酶抑制剂PP2抑制Src激酶活化后,能显著抑制QBC939细胞的体外侵袭能力,且5μmol/L的抑制效果较好。
2.3 PP2对QBC939细胞侵袭相关分子E-cadherin和CD44 m RNA水平的影响
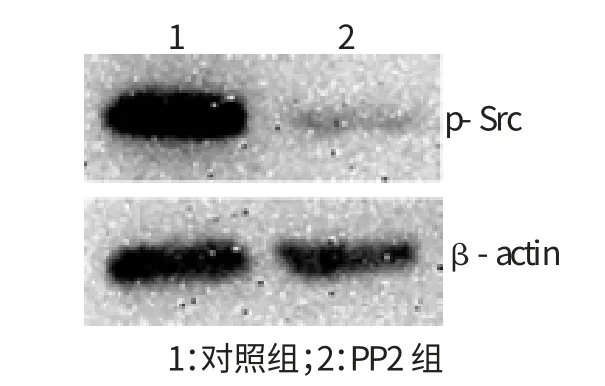
图1 PP2对QBC939细胞中p-Src蛋白表达的影响
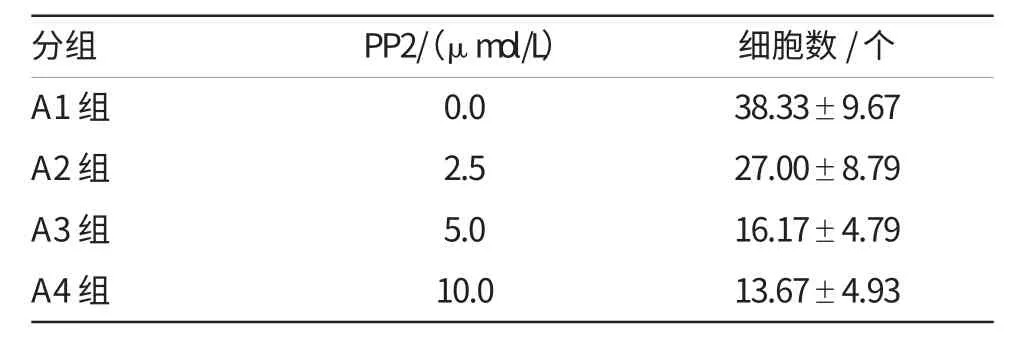
表1 PP2对QBC939细胞侵袭能力的影响(观测数据)
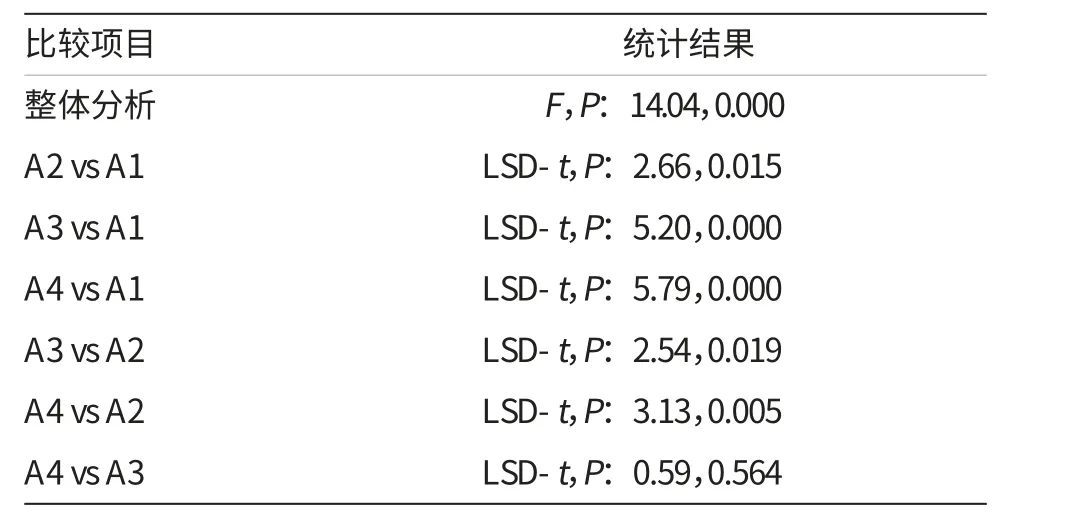
表2 PP2对QBC939细胞侵袭能力的影响(统计结果)
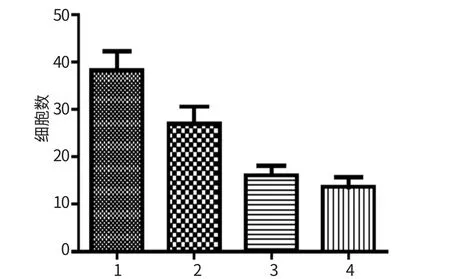
图2 PP2对QBC939细胞侵袭能力的影响
经Src激酶抑制剂PP2处理后,用RT-PCR技术检测QBC939细胞侵袭能力相关分子E-cadherin和CD44的在mRNA水平的表达情况。结果显示,与对照组相比,经PP2处理后,E-cadherin的mRNA的表达显著增强,均有统计学意义(表3和4,图3A);而PP2组CD44的mRNA的表达则较对照组显著减弱(表5和6,图3B),经分析差异均具有统计学意义(P<0.001)。本实验结果证明,Src激酶抑制剂PP2抑制QBC939细胞中Src激酶的活化后,能上调肿瘤细胞侵袭抑制分子E-cadherin、下调肿瘤细胞促侵袭分子CD44的mRNA水平,而且5μmol/L的抑制浓度最佳。
2.4 PP2对QBC939细胞E-cadherin和CD44蛋白水平的影响
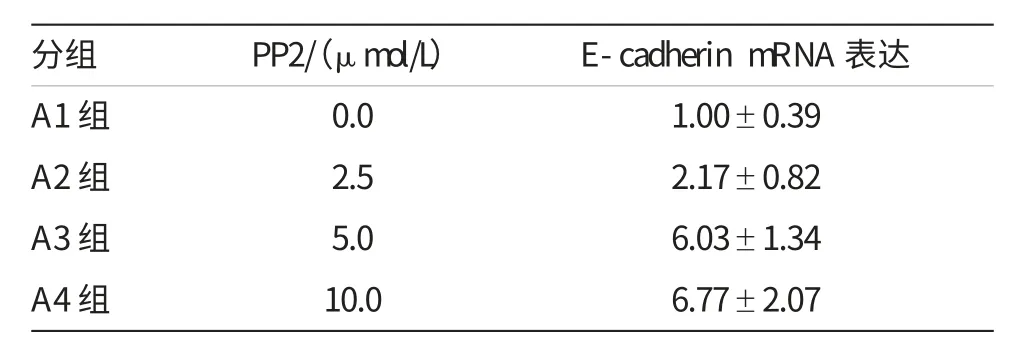
表3 PP2对E-cadherin mRNA表达的影响(观测数据)

表4 PP2对E-cadherin m RNA表达的影响(统计结果)
经Src激酶抑制剂PP2处理后,用Western Blot技术检测了QBC939细胞侵袭能力相关分子E-cadherin和CD44的蛋白水平的表达情况。结果显示,PP2组E-cadherin的蛋白表达水平比对照组明显增高;而与对照组相比,而PP2组CD44的蛋白表达水平则明显降低。结果表明,Src激酶抑制剂PP2抑制QBC939细胞中Src激酶的活化后,能增强肿瘤细胞侵袭抑制分子E-cadherin的表达,减弱肿瘤细胞促侵袭分子CD44的表达。见图4。
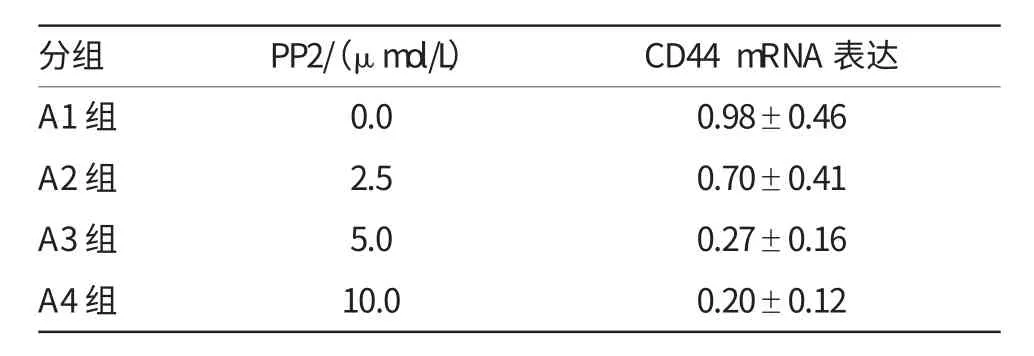
表5 PP2对CD44 m RNA表达的影响(观测数据)

表6 PP2对CD44 m RNA表达的影响(统计结果)

图3 PP2对QBC939细胞侵袭能力相关分子mRNA表达的影响
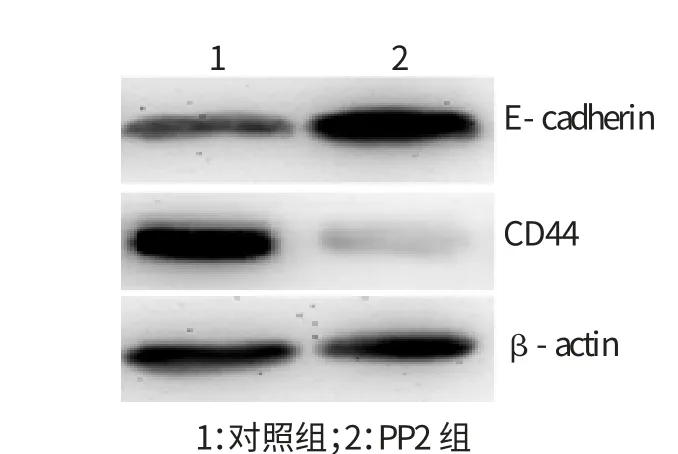
图4 PP2对QBC939细胞侵袭能力相关分子蛋白表达的影响
3 讨论
肿瘤的侵袭是一个复杂而繁琐的过程,随着细胞黏附性的降低,肿瘤细胞脱离原发部位,散落至其他部位,形成转移灶[11]。Src激酶在肺癌、宫颈癌等多种实体恶性肿瘤组织中过表达和被活化,活化后的Src激酶磷酸化其下游的信号转导分子,通过复杂的信号转导过程最终影响肿瘤细胞的侵袭能力[12]。PP2是1995年被发现的一种pyrazolopyrimidine复合物,可选择性抑制Src激酶家族,为Src激酶特异性抑制剂[13]。本研究通过PP2抑制人胆管癌QBC939细胞中Src激酶,观察Src激酶抑制剂PP2对人胆管癌QBC939细胞侵袭能力的作用和机制。
本研究发现,人胆管癌QBC939细胞中Src激酶处于高活性状态,而用5μmol/L的Src激酶抑制剂PP2可显著抑制QBC939细胞中p-Src的表达,即Src激酶的活性被Src激酶抑制剂PP2抑制了,本结果与已有研究的报道基本一致[14]。随后,通过体外侵袭实验笔者发现,Src激酶抑制剂PP2抑制QBC939细胞Src激酶的活化后,QBC939细胞的侵袭能力明显减弱。但是Src激酶抑制剂PP2抑制Src激酶的活化后具体通过影响了QBC939细胞中什么因素致使该肿瘤细胞的侵袭能力减弱目前并不清楚。
已有文献报道,E-cadherin是广泛存在于组织的上皮细胞中的蛋白分子,对细胞的黏附聚集十分重要[15]。该E-cadherin分子为肿瘤侵袭抑制分子,下调其表达后,肿瘤细胞的侵袭能力显著增强[16]。CD44分子则是与肿瘤预后密切相关的肿瘤促侵袭分子,上调CD44的表达后,可使肿瘤细胞侵袭能力增强,更易进入血液和淋巴循环,导致肿瘤转移灶的产生[17]。本研究结果显示,Src激酶抑制剂PP2抑制Src激酶的活化后,E-cadherin分子mRNA水平和蛋白水平的表达显著增高,而CD44分子mRNA水平和蛋白水平的表达则明显降低。
上述结果提示,Src激酶抑制剂PP2抑制Src激酶的活化后,可能是通过上调肿瘤细胞侵袭抑制分子E-cadherin、下调肿瘤细胞促侵袭分子CD44 mRNA的水平,进而增强肿瘤细胞侵袭抑制分子E-cadherin、减弱肿瘤细胞促侵袭分子CD44的表达,最终导致QBC939细胞侵袭能力的减弱。
综上所述,本研究为胆管癌患者以Src激酶为治疗靶标的Src激酶特异性抑制剂抗肿瘤治疗策略的研发提供了实验依据,并为Src激酶特异性抑制剂应用于临床奠定了理论基础。
[1]ULSTRUPT,PEDERSEN FM.Photodynamic therapy of cholangiocarcinomas[J].Ugeskr Laeger,2013,175(9):579-582.
[2]BLECHACZ B,GORESGJ.Cholangiocarcinoma:advances in pathogenesis,diagnosis,and treatment[J].Hepatology,2008,48(1):308-321.
[3]MANSFIELD SD,BARAKATO,CHARNLEY RM,etal.Management of hilar cholangiocarcinoma in the North of England:pathology,treatment,and outcome[J].World JGastroenterol,2005,11(48):7625-7630.
[4]LEESG,LEE YJ,PARK KM,etal.One hundred and eleven liver resections for hilar bile duct cancer[J].JHepatobiliary Pancreat Surg,2000,7(2):135-141.
[5]GORESGJ.Cholangiocarcinoma:currentconceptsand insights[J].Hepatology,2003,37(5):961-969.
[6]SILVAMA,TEKIN K,AYTEKIN F,etal.Surgery for hilar cholangiocarcinoma,a 10 year experience of a tertiary referral centre in the UK[J].Eur JSurgOncol,2005,31(5):533-539.
[7]POPESCU I,DAVID L,BRASOVEANU V,etal.Two-stage hepatectomy:an analysis of a single center's experience[J].Magy Seb,2006,59(3):184-189.
[8]CABINAKOVA M,TESAROVA P.Disseminated and circulating tumour cellsand their role in breast cancer[J].Folia Biol(Praha),2012,58(3):87-97.
[9]WARMUTH M,DAMOISEAUX R,LIU Y,et al.SRC family kinases:potential targets for the treatment of human cancer and leukemia[J].Curr Pharm Des,2003,9(25):2043-2059.
[10]NAM S,KIM D,CHENG JQ,etal.Action of the Src family kinase inhibitor,dasatinib (BMS-354825),on human prostate cancer cells[J].Cancer Res,2005,65(20):9185-9189.
[11]TANGZ,GENGG,HUANGQ,etal.Prognostic significanceof tissue factor pathway inhibitor-2 in pancreatic carcinoma and its effect on tumor invasion andmetastasis[J].Med Oncol,2010,27(3):867-875.
[12]SANCHEZ-BAILONMP,CALCABRINIA,GOMEZ-DOMINGUEZD,etal.Src kinases catalytic activity regulates proliferation,migration and invasivenessofMDA-MB-231 breastcancer cells[J].Cell Signal,2012,24(6):1276-1286.
[13]THOMASSM,BRUGGE JS.Cellular functions regulated by Src family kinases[J].Annu Rev CellDev Biol,1997,13:513-609.
[14]JENSEN HA,STYSKAL LE,TASSEFFR,et al.The Src-family kinase inhibitor PP2 rescues inducible differentiation events in emergent retinoic acid-resistantmyeloblastic leukemia cells[J].PLoSOne,2013,8(3):e58621.
[15]SOLISGP,SCHROCK Y,HULSBUSCH N,et al.Reggies/flotillins regulate E-cadherin-mediated cell contact formation by affecting EGFR trafficking[J].MolBiolCell,2012,23(10):1812-1825.
[16]CUFIS,COROMINAS-FAJA B,VAZQUEZ-MARTINA,etal.Metformin-induced preferential killing of breast cancer initiating CD44+CD24-/low cells is sufficient to overcome primary resistance to trastuzumab in HER2+human breastcancer xenografts[J].Oncotarget,2012,3(4):395-398.
[17]VIEIRA AF,RICARDO S,ABLETTMP,etal.P-cadherin is coexpressed with CD44 and CD49f and mediates stem cell properties in basal-like breast cancer[J].Stem Cells,2012,30(5):854-864.
