小鼠和大鼠口服阿维菌素原料药和制剂的急性毒性试验
2015-04-20刘剑鹏
刘剑鹏
(甘肃省动物疫病预防控制中心730046)
自上世纪40 年代起, 抗蠕虫药以平均每5 年开发一种新药的速度增长,从40 年代的吩噻嗪(Phenothiazine)到70 年代的奥吩哒唑(Oxfendazole),抗蠕虫药的发展趋势是药效越来越强,用药剂量越来越低(从600mg/kg 下降到5mg/kg)。1976年阿维菌素类药物(Avermectins)的发现揭开了抗蠕虫药研究的新纪元。 Avermectins 是由链霉菌 St reptomyces avermiti l is 产生的一组大环内酯类物质,包含有结构相似的8 种天然组分。该类化合物对寄生于动物的线、虫和节肢动物有极强的驱杀作用, 从而使抗蠕虫药物用药剂量由mg/ kg 级下降到μg/ kg 级。目前在这类药物中已商品化的有阿维菌素(Avermectin B1 ,AVM 或Abamectin)、伊维菌素(Ivermectin ,IVM 即22,23—dihydroavermectin B1)、多拉菌素(Doramectin 即25—cyclo2hexylavermectin B1)[1]和Eprinomectin[2]。
Avermectins 由于其优异的驱虫活性和较高的安全性,被视为目前最为优良, 而且应用最广泛的兽用驱虫药, 是近20年来抗寄生虫药物研究中最为杰出的研究成果[3]。Avermectins虽然拥有良好的脂溶性,但其分子量较大,因此与脂溶性的小分子药物相比,其透皮吸收过程较为缓慢。已有研究表明,对许多肠道线虫和丝虫而言,两者对Avermectins 的摄取,经表皮吸收和经口两种途径起着同等重要的作用[3]。Avermectins 在线虫和节肢动物体内与其特异位点结合可产生一系列的电生理和生物化学反应。越来越多的研究表明,Avermectins 的驱虫活性主要是由于药物引起由谷氨酸控制的Cl-通道的开放,从而导致膜对Cl-通透性增加,带负电荷的Cl-引起神经元休止电位的超极化,使正常的电动电位不能释放,神经传导受阻,最终引起虫体麻痹死亡[4、5]。由于哺乳动物具有血脑屏障,因而药物进入中枢神经系统的数量很少。此外,至今尚未发现在哺乳动物体内存在受谷氨酸控制的Cl-通道。因此,Avermectins对哺乳动物具有很高的安全性。本研究以《化学药物急性毒性试验技术指导原则为指导》[6],按照简化寇氏法对阿维菌素微乳制剂进行了急性毒性试验, 为该药的毒性研究和临床合理、有效用药提供依据。
1 材料与方法
1.1 供试药品
阿维菌素原料药,白色粉末状物质,纯度98.2%,水分1.33%,四川天通兽药股份有限公司提供。
阿维菌素制剂,无色、透明液体,规格:0.75ml:45mg,含量99.6%,山西运城兽药公司提供。
1.2 试验动物昆明种小鼠(普通级)154 只,雌雄各半,体重18~22g,购自兰州大学实验动物中心,许可证号:SCXK(甘)2009-0004。
Wistar 大鼠(清洁级)154 只,雌雄各半,体重180~220g,购自兰州大学实验动物中心,许可证号:SCXK(甘)2009-0004。
1.3 试验方法
本试验选用简化寇氏法对小鼠和大鼠进行LD50的测定[7]。
预试验:每个试验组有4 只试验动物,雌雄数量各半,小鼠和大鼠一次性口服不同剂量的阿维菌素原料药和制剂,分别测定LD0和LD100。此外对小鼠和大鼠分别透皮给与高剂量阿维菌素制剂10g·kg-1,观察动物的毒副反应情况。
正式试验:根据预试验得到的LD100和LD10,计算二者的比值对正式试验进行分组。每组的试验动物数为10 只,雌雄数量各半。在透皮给药时,小鼠和大鼠的数量分别增至20 只,雌雄数量各半。给药后观察详细记录大鼠和小鼠的死亡情况以及出现的症状,症状起始的时间和持续时间。在给药后20 天内连续观察,对于试验中死亡的动物以及试验结束时处死的动物进行大体解剖,并对组织器官出现的体积和颜色的变化做详细记录。统计死亡率,计算LD50及其95%可信限。
2 试验结果
2.1 预试验结果
小鼠口服阿维菌素原料药的LD0、LD100分别为3.9g·kg-1、11.7g·kg-1;大鼠口服阿维菌素原料药的LD0、LD100分别为1.4g·kg-1、4.6g·kg-1;小鼠口服阿维菌素制剂的LD0、LD100分别为4.3g·kg-1、8.2g·kg-1;大鼠口服阿维菌素制剂的LD0、LD100分别为3.6 g·kg-1、8.7g·kg-1。小鼠和大鼠分别透皮给与高剂量阿维菌素制剂10g·kg-1,未见到任何毒副反应。
2.2 正式试验结果
2.2.1 小鼠口服原料药试验结果
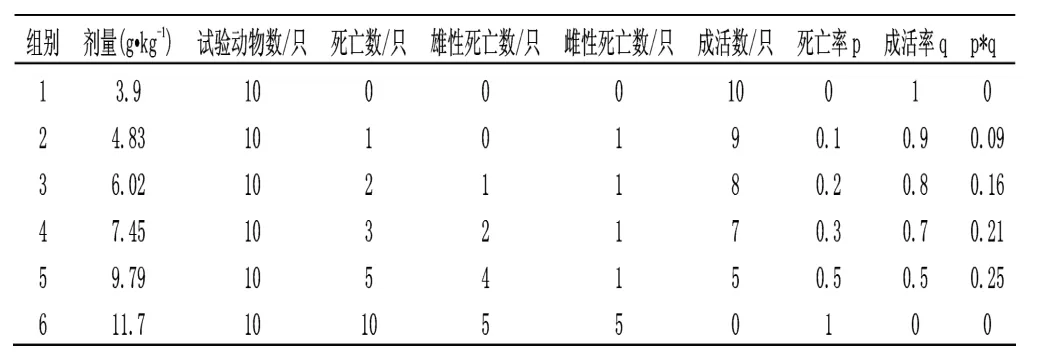
表1 小鼠口服原料药正式试验数据统计结果
测得的LD50=8.12g·kg-1,LD50的95%可信限为7.73~9.82g·kg-1。由于LD50值在5001~15000mg·kg-1之间,故阿维菌素原料药对小鼠是实际无毒的。
在小鼠口服原料药急性毒性试验中给药3h 后开始出现临床症状,表现为精神萎靡、食欲下降等临床症状,部分小鼠还表现为流泪、腹泻等症状,死亡时间出现在给药后的26h~9d 内,死后剖检症状如下:皮下、腹膜、肠系膜、胸膈膜、十二指肠易剥落,肝、肾暗红色,有的小鼠肝、肾肿大、腺胃有出血点或出血带。
雄性小鼠和雌性小鼠的死亡率无显著性差异(P=0.42)。
2.2.2 大鼠口服原料药试验结果
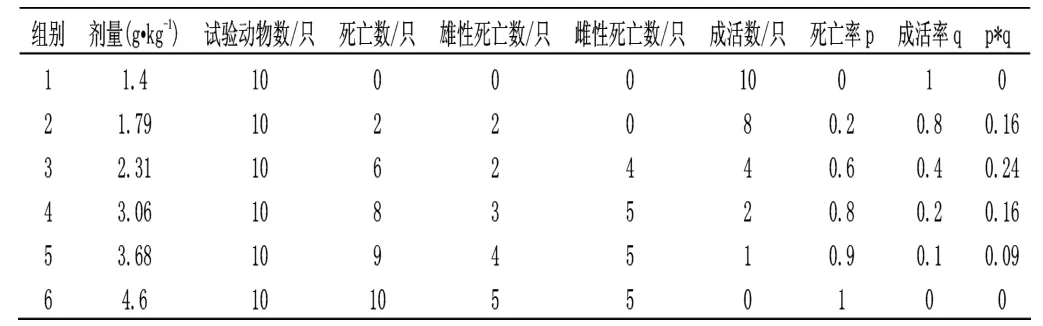
表2 大鼠口服原料药正式试验数据统计结果
测得的LD50=2.31g·kg-1,LD50的95%可信限为2.24~2.82 g·kg-1。由于LD50值在501~5000mg·kg-1之间,故阿维菌素原料药对大鼠是低毒的。
在大鼠口服原料药急性毒性试验中给药后1h 开始出现精神沉郁、弓背、食欲降低等症状,死亡时间多出现在给药后的5~12d 内,多数大鼠在死亡时有鼻孔有出血的迹象,死后剖检症状如下:皮下、腹肌严重充血,肠系膜、肠膜、肠壁较薄,肠粘膜易剥落,肝、肾暗红色,有的脾也为暗红色,有的大鼠肝、脾、肾肿大。
雄性小鼠和雌性小鼠的死亡率无显著性差异(P=0.46)。
2.2.3 小鼠口服制剂试验结果
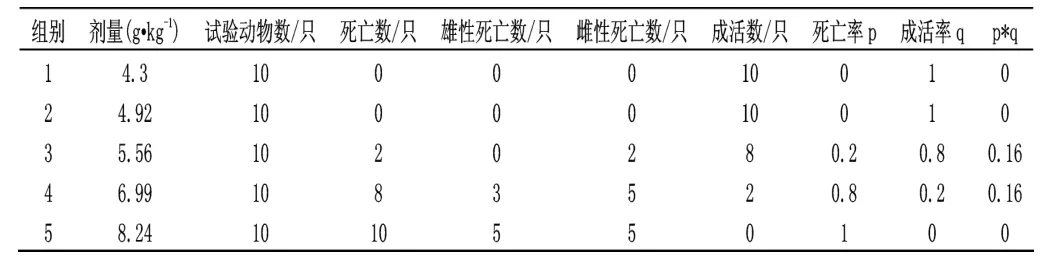
表3 小鼠口服制剂正式试验数据统计结果
测得的LD50=7.67g·kg-1,LD50的95%可信限为7.26~8.19g·kg-1。由于LD50值在5001~15000mg·kg-1之间,故阿维菌素制剂对小鼠是实际无毒的。
在小鼠口服制剂急性毒性试验中给药后3min 大部分小鼠均出现反应迟钝、抽搐等现象,给药后1h 部分小鼠均不能动弹,俯卧,呼吸急促。在试验中未死亡的小鼠,在给药后的24h 能正常活动。死亡时间出现在给药后的2~26h 内,死后剖检症状如下:皮下、腹膜、肠系膜、十二指肠、空肠肠壁较薄,肠粘膜易剥落,肝暗红色,有的小鼠肾为暗红色,肝、脾、肾肿大。
雄性小鼠和雌性小鼠的死亡率无显著性差异(P=0.18)。
2.2.4 大鼠口服制剂试验结果
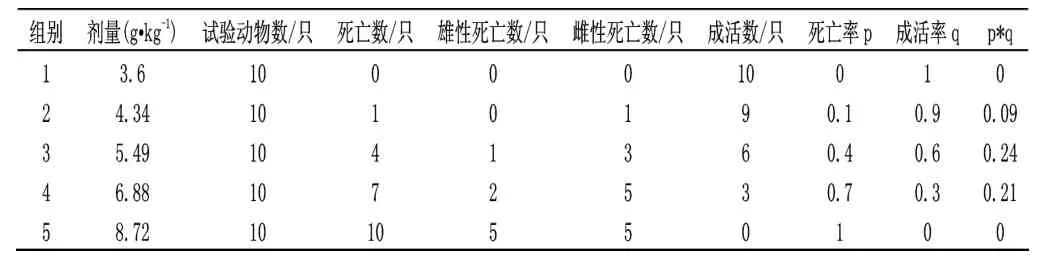
表4 大鼠口服制剂正式试验数据统计结果
测得的LD50=6.83g·kg-1,LD50的95%可信限为6.10~7.53 g·kg-1。由于LD50值在5001~15000mg·kg-1之间,故阿维菌素制剂对大鼠是实际无毒的。
在大鼠口服制剂急性毒性试验中所有大鼠在给药后2 min 内反应迟钝、部分抽搐,给药后1h 几乎所有小鼠均不能动弹,俯卧,呼吸急促。试验中未死亡的小鼠在给药后的24h 能正常活动。死亡时间出现在给药后的5~16d 内,死后剖检症状如下:皮下、腹肌、肠系膜、十二指肠、空肠肠壁较薄,肠粘膜易剥落,肝暗红色,有出血点,有的小鼠肾为暗红色,肝、脾、肾肿大。
雄性小鼠和雌性小鼠的死亡率无显著性差异(P=0.11)。
2.2.5 小鼠透皮给与制剂的试验结果

表5 小鼠透皮给与制剂的试验数据统计结果
透皮给与小鼠制剂10g·kg-1未见任何毒副反应,饮食与活动正常。
2.2.6 大鼠透皮给与制剂的试验结果

表6 大鼠透皮给与制剂的试验数据统计结果
透皮给与大鼠制剂10g·kg-1未见任何毒副反应,饮食与活动正常。
3 讨论
本试验严格以《化学药物急性毒性试验技术指导原则》为指导,用经典的急性毒性试验方法-半数致死量法获得受试物的LD50,经统计计算得小鼠和大鼠口服原料药的LD50分别是8.12g·kg-1、2.31g·kg-1;小 鼠 和 大 鼠 口 服 制 剂 的LD50分 别 是7.67g·kg-1、6.83g·kg-1。由于LD50值均在501~15000mg·kg-1之间,按毒性分级标准[8]将阿维菌素原料及制剂判为低毒或实际无毒物质。在制剂的透皮试验中,大鼠和小鼠的给药剂量是10 g·kg-1,该剂量大于临床推荐剂量6mg·kg-1(原料药)[9]的100 倍,未见任何不良反应,这些都提示阿维菌素制剂临床用药剂量是安全的。
[1]Goudie A C, Evans N A, Gration K A F,et al.Doramectin-a potent novel endectocid [J].Veterinary Para2 sitology,1993,49,5~15.
[2]Shoop W L,et al. Eprinomectin:a novel avermectin for use as a topical endectocide for cat tle [J],International Journal Parasitology,1996,26(11):1237~1242.
[3]Mckel larQ A,Benchaoui H A.Avermectins and mi lbermycins[J].Journal of Veterinary Pharmacology andTherapeutics.,1996,19 :331~351.
[4]Shoop W L,Morzik H,Fisher M H.St ructure and activity of avermectins and mi lbemycins in animal heal th[J].Veterinary Parasitology,1995,59,139~156.
[5]Turner M J,Schaef fer J M.Mode of action of ivermectin[M].In Ivermectin and Abamectin.Ed.Campbel l,W.C.pp.Springer-Ver lag,New York.1989,73~88.
[6]《化学药物急性毒性试验技术指导原则》课题研究组.化学药物急性毒性试验技术指导原则[S].国家药物评审中心, 2005,1-3.
[7]楼宜嘉.药物毒理学(第2 版)[M].北京:人民卫生出版社,2007:172-178.
[8]沈建忠.动物毒理学[M].北京:中国农业出版社,2002.
[9]Kim Sang-Hun,Lee Jung-Youn,Jun Hyung-Kyou,et al.Ef ficacy of selamectin in the t reatment of cheyletiel losis in pet rabbits[J].Veterinary dermatology,2007,19(1):26-27.
