大鼠实验性牙髓炎痛敏模型的建立及检验
2015-04-20栗红师孙亚男吴礼安
高 磊,栗红师,闫 磊,孙亚男,张 海,吴礼安
(1.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院儿童口腔科,陕西西安710032;2.解放军空军总医院,北京100036;3.第四军医大学实验动物中心,陕西西安710032)
大鼠实验性牙髓炎痛敏模型的建立及检验
高 磊1,栗红师2,闫 磊1,孙亚男1,张 海3,吴礼安1
(1.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院儿童口腔科,陕西西安710032;2.解放军空军总医院,北京100036;3.第四军医大学实验动物中心,陕西西安710032)
目的:验证牙髓暴露法建立大鼠实验性牙髓炎痛敏模型的可行性。方法:取健康雄性SD大鼠36只,随机分为2组;对照组(n=10)麻醉后不作任何处理,牙髓炎模型组(n=26)麻醉后于左侧上颌第一磨牙穿髓并使之暴露于口腔。然后,每组中各随机抽取6只分别检测其术前及术后1、3、7、14 d的擦面行为。对照组所余4只于术后2 h取延髓及牙髓,牙髓炎组所余20只分别于术后2 h取延髓,1、3、7、14 d取牙髓;用免疫荧光染色检测延髓中c-Fos蛋白及牙髓中TNF-α的表达,HE染色观察牙髓炎症情况。结果:①牙髓炎组在建模术后1 d时的擦面总时间最高,其次为术后3 d组,两者分别与组内其他各时间相比,以及与同一时间点的对照组相比差异均有统计学意义(P<0.05);②HE染色显示,牙髓暴露1 d时即可见明显炎症,术后1、3、7、14 d,其坏死组织的边缘分别位于髓角和根上、中、下1/3处;③牙髓炎组在术后1、3、7、14 d各时间点的TNF-α表达强度的平均光密度值均明显高于对照组(P<0.05);④术后2 h牙髓炎组和对照组延髓背角的c-Fos阳性细胞数为176.8± 14.82和18.2±4.08(P<0.05)。结论:牙髓暴露法能有效模拟临床牙髓炎及其痛敏过程。
开髓;实验性牙髓炎;痛行为;免疫荧光染色;c-Fos
[Chinese Journal of Conservative Dentistry,2015,25(5):299]
慢性牙髓炎是指发生于牙髓组织的慢性炎症病变,临床表现主要为疼痛。因此,建立一种能有效模拟临床牙髓炎发生发展过程的慢性牙髓炎痛敏模型,对牙髓炎疼痛信息在中枢机制的研究具有重要意义。国内外关于大鼠实验性牙髓炎建模的方法很多,如电刺激法、内毒素脂多糖诱导法、软龋置入法等[1]。但这些方法的实验过程均较复杂,且条件难以控制,从而使重复性较差。本实验采用牙髓暴露法制作大鼠牙髓炎模型,并纳入痛行为学指标,分别从疼痛反应、牙髓组织形态学变化、炎性反应及痛觉中枢延髓活化4个方面,验证大鼠慢性牙髓炎痛敏模型的有效性,以期为后续慢性牙髓炎的中枢机制研究提供实验基础。
1 材料和方法
1.1 主要材料和设备
雄性SD大鼠(第四军医大学实验动物中心提供);Face Grooming观测仪(UgoBasil,意大利);高速涡轮机及1/2圆钻(Mani,日本);荧光显微镜(Olympus IX71,日本);兔抗TNF-α、c-Fos抗体(Santa Cruz,美国);山羊抗兔IgG(H+L)(Santa Cruz,美国);DAPI(上海碧云天生物技术有限公司)。
1.2 慢性牙髓炎动物模型的建立
取健康雄性SD大鼠36只(体质量180~230 g),在室温20℃、湿度55%的安静环境下适应性饲养(自由饮水进食)1周后用于实验。所有大鼠分别经70mg/mL水合氯醛腹腔注射(0.4mL/100 g)麻醉后,从中随机抽取10只不作任何处理,用于正常对照;所余26只大鼠分别取仰卧位固定后,开口器撑开口腔,750 mL/L乙醇消毒术区,然后用高速涡轮机及1/2圆钻于各大鼠左侧上颌第一磨牙近中窝处,间歇性磨除其牙体硬组织,待近髓透红时,用4.5号注射器针头(直径0.45mm)穿髓并使之暴露于口腔。
1.3 痛行为学测试
建模结束后,分别从对照组和牙髓炎组中各随机抽取6只大鼠用于擦面行为观察,以评估建模后不同时间大鼠的疼痛反应。具体方法为:分别于术前和术后1、3、7、14 d各时间点的上午9∶00~11∶00之间,将各大鼠放入Face Grooming观测仪内;待其适应环境5 min后,通过仪器底部的摄像机进行实时拍摄,并分别记录每只大鼠在3 min内擦面行为的总时间。
1.4 取材及组织切片制备
对照组所余4只大鼠于术后2 h采用心内灌注法(含20 IU/mL肝素的生理盐水+40 g/L多聚甲醛)处死后,分别取其延髓及包含左侧上颌第一磨牙的上颌骨段。其中延髓组织常规制备冰冻切片(沿延髓长轴过三叉神经脊束核,片厚25μm,隔6取1);左侧上颌骨组织分别经40 g/L多聚甲醛固定2 h、EDTA液脱钙2周后,常规石腊包埋,然后沿牙齿近远中向、过窝洞制备组织切片(厚度为5μm,隔6取1)。牙髓炎组所余20只大鼠随机分为5组(n=4),其中一组于术后2 h按上述方法处死各大鼠,并取其延髓制备冰冻切片;另外4组分别于术后1、3、7、14 d各时间点处死各大鼠,并取其包含左侧上颌第一磨牙的上颌骨段制备石蜡切片(所有方法均同上)。
1.5 延髓c-Fos蛋白免疫荧光染色观察
分别取对照组、牙髓炎建模术后2 h组的延髓冰冻切片,按试剂盒说明进行延髓c-Fos免疫荧光染色(常规洗片、透膜、封闭、一抗二抗孵育、封片)后,荧光显微镜下观察;并从每张切片中各随机取5个高倍视野(×60),记录其染色阳性细胞数,取均值。
1.6 牙髓组织HE染色、TNF-α免疫荧光染色观察
取对照组、牙髓炎建模术后1、3、7、14 d组牙髓石腊切片,分别进行HE染色、TNF-α免疫荧光染色。HE染色:常规脱蜡复水、HE染色、脱水透明、中性树胶封片、光镜下观察各组牙髓的组织学变化。TNF-α免疫荧光染色:常规烘片、脱蜡复水、微波炉抗原修复、一抗二抗孵育、DAPI细胞核染色、甘油封片,荧光显微镜下观察;并从每张切片中随机取5个荧光区域,用Image J图像分析软件(National Institutes of Health开发)测其平均光密度值,取均值。
1.7 统计学分析
2 结果
2.1 痛行为学测试结果
对照组大鼠在各时间点的擦面行为总时间(s)分别为19.0±4.10、19.17±3.76、19.5±5.39、24.67±7.69、21±8.99,各时间点两两相比均无统计学意义(P>0.05);牙髓炎模型组在建模术前、术后1、3、7、14 d各时间点的擦面行为总时间分别为17.33±4.93、68.67±9.03、45.17±11.16、22.17±8.72、22.83±7.25,其中以术后1 d组最高,与其他各时间点相比差异均有统计学意义(P<0.05),其次为术后3 d组,除明显低于术后1 d组(P<0.05)外,均明显高于其他各时间点(P<0.05);各时间点内牙髓炎模型组与对照组两两相比,除术后1、3 d明显高于对照组(P<0.05)外,其他各时间点均无统计学差异(P>0.05)(图1)。以上结果提示,牙髓暴露术后1、3 d均可引起典型的痛行为反应,其中以术后1 d痛行为反应最强,随后逐渐降低。
2.2 牙髓组织HE染色观察结果
各组牙髓组织HE染色观察显示:①对照组成牙本质细胞排列整齐,牙髓细胞呈星形,核染色深,胞质淡染,并可见部分血管(图2a);②牙髓炎组术后1 d组的牙髓髓角处,可见炎性细胞浸润,成牙本质细胞排列部分紊乱,但根髓基本正常(图2b);③术后3 d组可见炎症已进展到根髓上1/3处,冠髓全部坏死,炎性细胞主要分布于坏死组织断面(图2c);④术后7 d组可见炎症已进展到根髓中1/3处,深部存活牙髓组织间有散在的炎性细胞浸润(图2d);⑤术后14 d组:可见炎症已进展到根髓下1/3处,牙髓几乎全部坏死,但尚未出根尖孔,未累及根尖周组织(图2e)。以上结果表明,牙髓暴露1 d时即表现出明显炎症(大量炎性细胞浸润),此后牙髓自冠髓至根髓逐渐坏死。

图1 各组各时间点擦面总时间比较
2.3 牙髓TNF-α免疫荧光染色观察结果(图3)
各组牙髓TNF-α免疫荧光染色:图中蓝色为DAPI细胞核染色,绿色为TNF-α免疫荧光染色,TNF-α免疫荧光染色主要表达于邻近坏死层的牙髓组织内;图像分析结果显示:牙髓炎建模术后1、3、7、14 d各组的平均光密度值均明显高于对照组(P<0.05),其中以1 d组最高,14 d组最低,各组间两两相比,除术后3 d与术后7 d组P>0.05外,其他各组间差异均P<0.05。
2.4 延髓c-Fos蛋白免疫荧光染色观察结果
延髓组织中c-Fos蛋白检测结果(图4)所示:c-Fos免疫荧光(绿色)主要分布于延髓背角浅层(图4a、b)。牙髓炎建模术后2 h,其延髓背角的c-Fos染色阳性细胞数(176.8±14.82)明显高于对照组(18.2±4.08)(P<0.05)(图4c)。以上结果提示,牙髓暴露2 h即可使延髓背角的细胞活化。
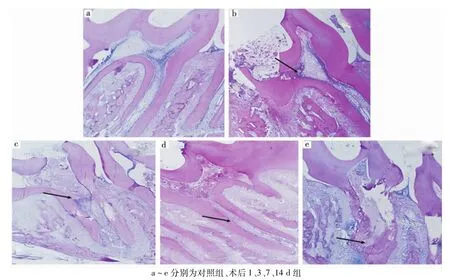
图2 各组牙髓组织HE染色观察(×4)

图3 各组TNF-α免疫荧光染色观察(×4)

图4 对照组和牙髓炎建模术后2 h组延髓背角c-Fos免疫荧光染色观察(×4)
3 讨论
牙髓炎痛敏模型的选择,对于后续研究至关重要。开髓暴露法操作简单,不仅能在口腔菌群自然感染环境下诱导牙髓炎症,更能模拟临床慢性牙髓炎的发生发展过程。Gibbs等[2]采用牙髓暴露模型法取得了很好的效果。牙髓炎的重要临床表现为疼痛,以往对牙髓炎模型的研究多聚焦于牙髓组织的病理学表现及炎症因子等的表达变化[3],本实验纳入痛行为学及中枢活化等指标,从外周、中枢以及痛行为等方面全方位的对实验性牙髓炎模型进行评估和验证,以期为后续慢性牙髓炎的中枢机制研究提供实验基础。
目前,对疼痛程度的评定主要通过实验动物的伤害性行为及生理反射来确定。Clavelou等[4](1989)在福尔马林颜面部疼痛实验研究中指出:抓擦注射部位皮肤是一种有效的、可量化的伤害性行为反应,可通过测量抓擦持续时间的长短,来评价三叉神经系统受伤害性刺激后产生疼痛的强度。随后,Chidiac等[5]也发现,通过记录大鼠擦面行为的持续时间,可准确反映牙髓炎疼痛指标。因此,我们选择擦面行为重要观测指标,通过观察大鼠痛行为学变化,从宏观上反映牙髓炎的痛敏过程,从而验证实验性大鼠牙髓炎痛敏模型的有效性。本实验中,术后1 d,擦面行为持续时间达到最高,随之逐渐降低;提示疼痛在第1天达到顶峰,为急性牙髓炎时期,随后转入慢性,疼痛程度逐渐降低。该结果表明开髓暴露法建立的牙髓炎痛敏模型非常成功。
痛行为学检测可从宏观上反映牙髓炎的痛敏过程,而病理切片则可从微观上直接观察牙髓组织从初期炎症到后期坏死的全过程。本实验通过牙髓组织HE染色可见:术后不同时间,其炎症自冠髓向根髓逐渐进展并发生渐进性坏死;术后14 d时其炎症已进展至根髓的根尖1/3处,且牙髓几乎全部坏死,但尚未出根尖孔,未累及根尖周组织。该结果与Kramer的研究(术后13 d进展到根尖1/3处)基本一致[6],但与Nakamura[7]的术后7 d以及Fan[8]的术后28 d进展到根尖1/3处等结果不同。这可能与开髓孔径大小、位置和深度有一定的关系。本实验均由同一操作者采用1/2圆钻于左侧上颌第一磨牙近中窝处,间歇式上下垂直提拉(不向四周扩展),当近髓透红时,用4.5号注射器针头(直径0.45mm)穿髓;同时用探针检查深度、大小、位置及出血情况,并排除不符合标准的样品,以保证样本的均一性。
TNF-α不仅作为重要的炎性介质参与炎症反应[9],而且还能直接增强兴奋性突触的传递和削弱抑制突触效能,诱发中枢敏化[10],同时也可以直接作用于初级传入神经元,引起痛觉超敏[11];因此TNF-α有着连接免疫与神经系统的多重作用。Kokkas等[12]发现TNF-α在不同牙髓炎状况中的表达各不相同,且与临床症状的严重程度成正比。本结果显示:TNF-α主要分布于坏死牙髓组织的边缘,其表达量在牙髓炎建模术后1 d(疼痛急性期)组的牙髓组织中最高,此后,随着病程的进展而逐渐降低,与Tani-Ishii等[13]报道基本一致。
中枢c-Fos蛋白的表达是外周伤害性刺激后神经元兴奋的标志,其表达量可反映外周伤害性刺激的强度[14]。Bhatt等[15]报道,c-Fos蛋白可通过参与调节阿片肽基因的表达,而参与疼痛的中枢调节。本实验发现,大鼠牙髓暴露后在短时间内(2 h)即可观察到口面部痛觉初级中枢延髓背角内c-Fos蛋白的表达明显增加;提示c-Fos蛋白表达灵敏,在炎症早期即有明显变化,是一种评价痛觉神经元激活的有效指标。
综上所述,牙髓暴露法操作简单、效果理想,能有效的模拟临床牙髓炎及其痛敏过程,是一种构建实验性牙髓炎痛敏模型的理想方法。
[1]Maltos KL,Menezes GB,CaliariMV,etal.Vascular and cellular responses to pro-inflammatory stimuli in rat dental pulp[J].Arch Oral Biol,2004,49(6):443-450.
[2]Gibbs JL,Urban R,Basbaum AI.Paradoxical surrogatemarkers of dental injury-induced pain in themouse[J].Pain,2013,154(8):1358-1367.
[3] 余擎,吴补领,肖明振,等.大鼠正常牙髓和炎症牙髓中Bcl-2,Bax的表达及其意义[J].牙体牙髓牙周病学杂志,1999,9(1):55-57.
[4]Clavelou P,Pajot J,Dallel R,etal.Application of the formalin test tothe study of orof acial pain in the rat[J].Neurosci Lett,1989,103:349-353.
[5]Chidiac JJ,Rifai K,Hawwa NN,et al.Nociceptive behaviour induced by dental application of irritants to rat incisors:a new model for tooth inflammatory pain[J].Eur J Pain,2002,6(1):55-67.
[6]Kramer PR,He J,Puri J.A Non-invasive Model for Measuring Nociception after Tooth Pulp Exposure[J].JDent Res,2012,91(9):883-887.[7]Nakamura K,YamasakiM,NishigakiN,etal.Effect ofmethotrexate-induced neutropenia on pulpal inflammation in rats[J].JEndod,2002,28(4):287-290.
[8]Fan W,Huang F,Zhu X,et al.Involvement ofmicroglial activation in the brainstem in experimental dental injury and inflammation[J].Arch Oral Biol,2010,55(9):706-711.
[9]Targan SR.Biology of inflammation in Crohn's disease:mechanisms of action of anti-TNF-a therapy[J].Can J Gastroenterol,2000,14(S),13C-16C.
[10]Andrade P1,Visser-Vandewalle V,Hoffmann C,et al.Role of TNF-alpha during central sensitization in preclinical studies[J].Neurol Sci,2011,32(5):757-771.
[11]Agarwal R,Agarwal P.Glaucomatous neurodegeneration:an eye on tumor necrosis factor-alpha[J].Indian J Ophthalmol,2012,60(4):255-261.
[12]Kokkas AB,Goulas A,Varsamidis K,et al.Irreversible but not reversible pulpitis is associated with up-regulation of tumour necrosis factor-alpha gene expression in human pulp[J].Int Endod J,2007,40(3):198-203.
[13]Tani-Ishii N,Wang CY,Stashenko P.Immunolocalization of bone-resorptive cytokines in rat pulp and periapical lesions following surgical pulp exposure[J].Oral Microbiol Immunol,1995,10(4):213-219.
[14]HossainiM,Duraku LS,Kohli SK,et al.Spinal distribution of c-Fos activated neurons expressing enkephalin in acute and chronic pain models[J].Brain Res,2014,1543:83-92.
[15]Bhatt DK,Ramachandran R,Christensen SL,et al.CGRP infusion in unanesthetized rats increasesexpression of c-Fos in the nucleus tractus solitarius and caudal ventrolateralmedulla,but not in the trigeminal nucleus caudalis.Cephalalgia[J].Cephalalgia,2015,35(3):220-233.
Establishment and verification of rat experimental hyperalgesic pulpitis
GAO Lei*,LIHong-shi,YAN Lei,SUN Ya-nan,ZHANG Hai,WU Li-an
(*State Key Laboratory of Military Stomatology,Department of Pediatric Dentistry,School of Stomatology,The Fourth Military Medical University,Shaanxi Key Laboratory of Stomatology,Xi′an 710032,China)
AIM:To establish and verify rat experimental hyperalgesic pulpitis.METHODS:36 male SD ratswere randomly divided into2 groups.The rats in control group(n=10)received no treatmentafter anesthesia,while the leftmaxillary firstmolar pulp of the rats in the pulpitis group(n=26)were exposed after anesthesia.6 rats of each group were randomly selected for face grooming testbefore and after1,3,7 and 14 d of surgery respectively.Themedulla oblongatas and pulps of the remaining 4 rats in the control group were taken after2 h of surgery.The remaining20 rats in the pulpitis group were randomly divided into5 groups(n=4),the pulpswere taken after1,3,7 and 14 d of surgery respectively.HE staining,TNF-αand c-Fos immunofluorescence staining were conducted tomeasure the changes of pulp and bulbusmedullae.RESULTS:The face Grooming after 1 d or 3 d of surgery in pulpitis groupswere longer than that in the control group(P<0.05).In the pulpitis groups longest face grooming was observed 1d followed by 3 d(P<0.05)after surgery.HE staining revealed that1,3,7 and 14 d after surgery,inflammation and necrotic tissues appeared at the pulp horn,cervical-third,middle-third and apical-third of the root respectively.Themean optical density of TNF-αat various time points of pulpitis group were significantly higher than that of control group(P<0.05).In pulpitis group highest TNF-αlevelwas observed 1d followed by 3 and 7 d after surgery(P<0.05),the lowest at14 d after surgery(P<0.05).c-Fos immunostaining results showed that c-Fos-positive cellswere significantly increased inmedullary dorsal horn after2 h of pulp exposure.CONCLUON:Pulp exposuremethod can effectively establish rat experimental hyperalgesic pulpitismadel,which simulates the process of clinical pulpitis and hyperalgesia.
pulp exposure;experimental hyperalgesic pulpitis;pain-behavior;immunofluorescence staining;c-Fos
R780.2
A
1005-2593(2015)05-0299-06
10.15956/j.cnki.chin.j.conserv.dent.2015.05.008
2014-11-21;
:2015-03-24
国家自然科学基金面上项目(81170929)
陕西省自然科学基金面上项目(2014JM4114)
高磊(1988-),男,汉族,河南人。硕士生(导师:吴礼安)
吴礼安,E-mail:lianwu@fmmu.edu.cn
