亚硫酸氢盐类引发剂引发丙烯酰胺聚合效果研究
2015-04-19赵庆美赵林汤琪马超
赵庆美,赵林 ,汤琪,马超
(1.长江大学化学与环境工程学院,湖北 荆州 434023; 2.长江大学石油工程学院,湖北 荆州 434023)
亚硫酸氢盐类引发剂引发丙烯酰胺聚合效果研究
赵庆美1,赵林2*,汤琪1,马超2
(1.长江大学化学与环境工程学院,湖北 荆州 434023; 2.长江大学石油工程学院,湖北 荆州 434023)
在合成聚丙烯酰胺(PAM)的过程中,分别以亚硫酸氢钠(NaHSO3)和亚硫酸氢钾(KHSO3)为引发剂引发丙烯酰胺(AM)聚合,确定最佳反应温度为30 ℃,最佳反应时间为4 h。与氧化-还原体系和过氧化物类引发剂的引发效果进行了对比,并通过红外分析、黏度测试及相对分子质量测定,确定NaHSO3和KHSO3具有较好的引发效果。NaHSO3和KHSO3可以较好地引发AM与丙烯酸(AA)、2- 丙烯酰胺基-2-甲基丙磺酸(AMPS)进行共聚反应。
聚合反应 引发剂 亚硫酸氢盐 丙烯酰胺
聚丙烯酰胺(PAM)作为一种重要的水溶性高分子材料,在石油化工等领域有着广泛的应用[1]。目前,工业及实验室合成PAM主要使用氧化-还原体系和过氧化物类两类引发剂。氧化-还原体系引发剂具有分解活化能低、聚合速率适中等优点,在合成疏水缔合聚丙烯酰胺的研究中常被采用,但该类引发剂在较低温度下引发丙烯酰胺(AM)聚合时,少量氧气的存在或体系中微量杂质的存在,就有可能导致聚合反应的诱导期延长[2-4]。过氧化物类引发剂具有分解活化能高、引发温度高、聚合速率快等优点,但过量过硫酸盐可能引起PAM的降解,因此,限制了其在合成某些特定用途PAM中的使用[5-6]。20世纪80年代,伍宣池等[7]对MnSO4存在下NaHSO3引发AM的聚合反应进行了研究;詹从红[8]对NaHSO3引发AM的聚合反应进行了研究。笔者以NaHSO3、KHSO3为引发剂合成PAM,并与氧化-还原体系引发剂NaHSO3-K2S2O8、NaHSO3-(NH4)2S2O8以及过氧化物类引发剂K2S2O8、(NH4)2S2O8的引发效果进行对比,探讨了亚硫酸氢盐的引发效果。
1 实验部分
1.1 试剂与仪器
亚硫酸氢钠,亚硫酸氢钾,分析纯,天津市博迪化工有限公司;丙烯酰胺,分析纯,天津市天力化学试剂有限公司;2-丙烯酰胺基-2-甲基丙磺酸(AMPS)、丙烯酸(AA),分析纯,天津市凯通化学试剂有限公司;过硫酸铵、过硫酸钾、溴酸钾、硫代硫酸钠、溴化钾,分析纯,天津市福晨化学试剂厂。
TENSOR27型傅里叶变换红外光谱仪,德国 BRUKER公司;NDJ-8S数字式旋转黏度计,上海哈勃光电子仪器公司。
1.2 聚丙烯酰胺的制备
将单体和引发剂分别用适量蒸馏水充分溶解,倒入三口瓶中,调节单体质量浓度为250 g/L,引发剂用量均占单体质量分数0.25%,在设定温度下聚合,持续搅拌,(以氧化-还原体系引发剂引发单体聚合时,反应前和反应中必须充分通氮气排除氧气,氧化剂用量占单体质量分数0.25%,氧化剂与还原剂的摩尔比为1∶2)聚合约4 h后,产物需进行后水解反应处理,以提高相对分子质量[9-10],后水解反应所选用的药品为NaOH,产物经无水乙醇多次洗涤浸泡后,在60 ℃干燥箱中充分干燥,经破碎机破碎成粉末后备用。
1.3 聚丙烯酰胺的表征
PAM相对分子质量的测定:根据GB 12005.1—89标准,采用一点法进行测量;
PAM中残留单体含量的测定:根据GB 12005.3—89标准进行测量;
PAM黏度的测定:配制ρ(PAM)= 5 g/L的蒸馏水溶液,采用1号转子测量黏度;
红外光谱测试:采用溴化钾粉末压片制样,对聚合物的结构进行表征。
2 结果与讨论
2.1 反应温度对亚硫酸氢盐引发效果的影响
实验中分别以NaHSO3、KHSO3为引发剂引发AM聚合,采用单因素法分析了反应温度对聚合反应的诱导期及产物相对分子质量的影响,实验结果如表1所示:
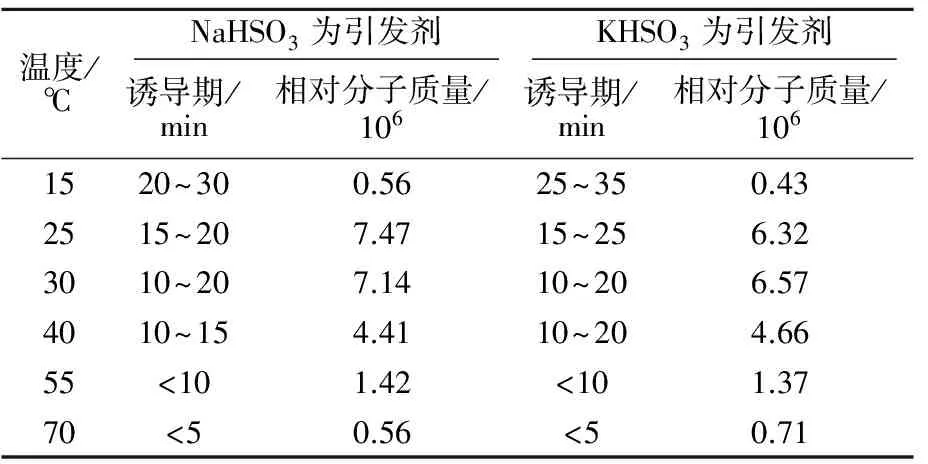
表1 反应温度对亚硫酸氢盐引发效果的影响
由表1可知:NaHSO3、KHSO3均可在15~70 ℃较宽广的温度范围内引发AM聚合,产物相对分子质量均随温度的升高先增大后减小,亚硫酸氢钠在25 ℃,亚硫酸氢钾在30 ℃时,产物相对分子质量最大;15 ℃时,聚合反应的诱导期较长,且聚合反应不稳定,有时聚合反应无法发生,当温度超过25 ℃以后,聚合反应稳定且均可在20 min内进行聚合,当聚合温度不断升高,有可能发生自由基向单体的链转移等副反应,导致相对分子质量随温度的升高而降低。综合考虑反应温度对聚合反应速率以及聚合产物相对分子质量的影响,确定亚硫酸氢盐引发AM聚合的最佳反应温度为30 ℃。
2.2 反应时间对聚合反应的影响
以NaHSO3为引发剂引发AM聚合,确定反应温度为30 ℃,聚合反应发生后,每隔一段时间取出适量产物,干燥,称重,测出不同聚合时间所得产物的单体残留率,分析反应时间对聚合体系单体残留率的影响。实验结果如图1所示:
由图1可知:在反应初期2h,单体残留率降低非常显著,反应4 h时,单体残留率基本降低到最低值12.9%。单体残留率的降低可以间接地反应出单体转化率的不断增加,NaHSO3在30 ℃引发AM聚合时最佳反应时间为4 h。

图1 反应时间对单体残留率的影响2.3 NaHSO3、KHSO3与NaHSO3-K2S2O8、NaHSO3-(NH4)2S2O8引发效果对比
氧化-还原体系引发剂NaHSO3-K2S2O8和NaHSO3-(NH4)2S2O8是引发AM聚合的常用引发剂,可在高于15 ℃充分通氮气除氧条件下引发AM单体聚合,在30 ℃时引发效果较好[5-6]。因此,在反应温度30 ℃,对比NaHSO3、KHSO3与NaHSO3-K2S2O8、NaHSO3-(NH4)2S2O8的引发效果,将聚合产物进行性能测试,实验结果见表2。

表2 不同引发剂引发效果对比
由表2可见:4种引发剂均可在30 min内引发AM聚合,聚合反应平稳,聚合现象无明显区别。NaHSO3、KHSO3引发所得产物的相对分子质量与黏度均略高于NaHSO3-K2S2O8和 NaHSO3-(NH4)2S2O8引发得到产物;亚硫酸氢盐引发所得产物中,单体的残留量也略低于NaHSO3-K2S2O8和 NaHSO3-(NH4)2S2O8引发所得产物;且亚硫酸氢盐引发AM聚合过程不需要通氮气排除氧气,在合成过程中可以提高生产效率,简化工序。
2.4 NaHSO3、KHSO3与K2S2O8、(NH4)2S2O8引发效果对比
过硫酸盐类引发剂热分解温度一般高于50 ℃,实验对比了55 ℃时NaHSO3、KHSO3与(NH4)2S2O8、K2S2O8的引发效果,结果见表3。
由表3可见:4组聚合体系均在10 min内开始聚合,过硫酸盐引发体系聚合较剧烈,反应30 min后体系呈凝胶状,亚硫酸氢盐引发体系,聚合较平稳,黏度逐渐增大。4组引发体系引发所得产物的相对分子质量、黏度、单体残留率相差不大,引发效果较为相似。
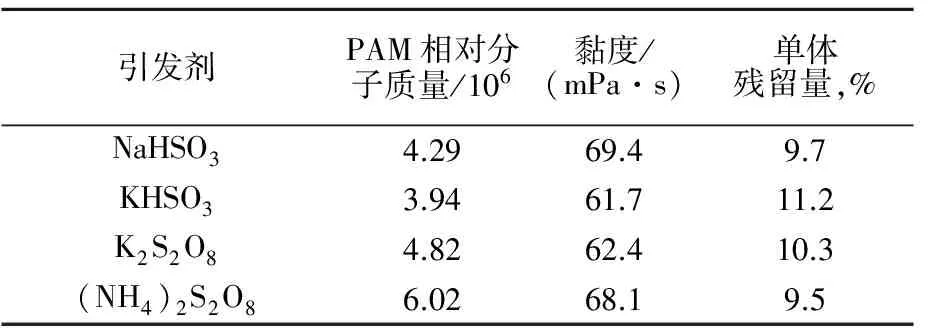
表3 亚硫酸氢盐与过氧化物类引发剂引发效果对比
2.5 NaHSO3、KHSO3引发AM共聚效果分析
NaHSO3与KHSO3不仅可以引发AM均聚,还可以较好的引发AM与AA、AMPS等单体共聚。实验中控制反应温度为30 ℃,以KHSO3为引发剂引发AM与AA、AMPS等单体共聚,合成中m(AM)∶m(AA)与m(AM)∶m(AMPS) 均为9∶1,m(AM)∶m(AA)∶m(AMPS)为8∶1∶1,聚合产品均没有经过后水解处理,对聚合产物分析所得结果见表4。
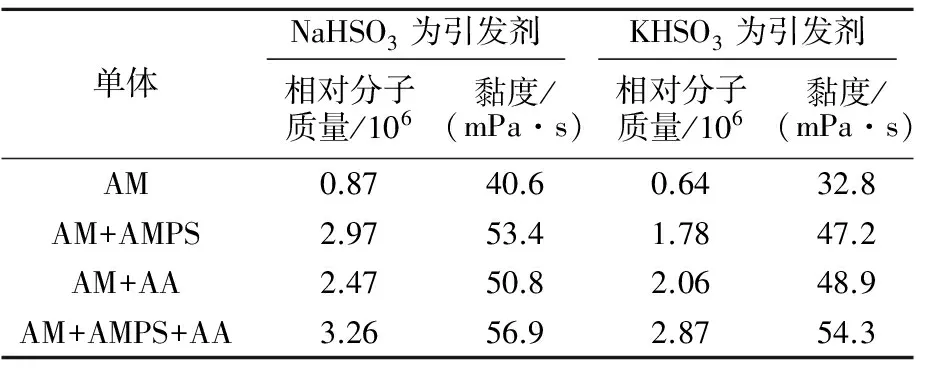
表4 不同丙烯酰胺聚合物性能比较
由表4可知:NaHSO3与KHSO3引发AM共聚反应所得产物的黏度和相对分子质量明显高于相同条件下AM均聚物的黏度和相对分子质量,这是因为电子效应导致共聚链增长反应速率增加,相对分子质量增大。实验分别对4组聚合产物进行了红外光谱分析,见图2。
图2(a)中3 404,3 330 cm-1处为N—H伸缩振动吸收峰;1 654 cm-1处为CO的伸缩振动吸收峰;1 326 cm-1是C—C的伸缩振动吸收峰;1 416,1 450 cm-1为—COO的伸缩振动吸收峰;704 cm-1处产生的吸收峰为4个以上相连的亚甲基弯曲振动吸收峰。(b)中除了AM的特征吸收峰外,1 115,1 059 cm-1为—SO3伸缩振动吸收峰是AMPS的特征吸收峰。(c)中除了AM的特征吸收峰外,在3 500~2 500 cm-1有AA特征缔合峰。(d)中出现了3种单体的特征吸收峰。上述分析,可以证明NaHSO3与KHSO3不仅能引发AM均聚,也能很好的引发AM与AA、AMPS单体发生共聚反应。

图2 聚丙烯酰胺红外光谱
a.NaHSO3和KHSO3引发AM聚合的最佳反应温度为30 ℃,最佳反应时间为4 h。
b.通过与氧化-还原体系引发剂和过氧化物类引发剂引发AM聚合的引发效果对比,确定亚硫酸氢盐类引发剂具有较好的引发效果。
c.NaHSO3和KHSO3不仅可以引发AM发生均聚,还可以很好的引发AM与AA、AMPS等单体进行共聚反应。
[1] 严瑞煊.水溶性高分子[M].北京:化学工业出版社,1998:105-106.
[2] 马自俊,金日辉.丙烯酰胺水溶液聚合的几种氧化还原引发体系的研究[J].精细石油化工,1997 (1):41-43.
[3] Pierre L, Bernard B. Synthesis characterizationassociative properties of triblock and diblock perfluorinated polyacrylamide[J].Polymer Bulletion,1999,43:59-66.
[4] 潘祖仁.高分子化学[M]. 第3版.北京:化学工业出版社,2007:83-92.
[5] Biswajit R, Brojia M M. Dispersion polymerizatization of acrylamile [J]. Iangmui, 1997,13:2191-2196.
[6] Paul J C,David M D,Gary A E. 3-Demensional submicron polymerization of acrylamide by multiphoton excitation of xanthene dyes[J]. Macromolecules, 2000,33:1511-1513.
[7] 伍宣池,何建强.NaHSO3-O2-MnSO4体系引发丙烯酰胺水溶液聚合反应的研究[J].高分子通讯,1986,6:402-408.
[8] 詹从红.亚硫酸氢钠引发丙烯酰胺聚合反应的研究[D].长春:吉林大学,2006.
[9] 丁伟. 丙烯酰胺类聚合物合成及性能研究[D].大庆:大庆石油学院,2006.
[10] James P, Richard G J. Direct evidence for the interaction of the mechanisms of thermally initiated and atom transfer radical polymerization [J]. Macromolecules, 2000,33:9166-9168.
POLYMERIZATION EFFICIENCY OF POLYACRYLAMIDE INITIATED BY BISULFITE
Zhao Qingmei1, Zhao Lin2, Tang Qi1, Ma Chao2
(1.CollegeofChemistryandEnvironmentalEngineering,YangtzeUniversity,Jingzhou434023,Hubei,China; 2.CollegeofPetroleumEngineering,YangtzerUniversity,Jingzhou434023,Hubei,China)
Sodium bisulfate and potassium bisulfate were used as initiators for acrylamide in the process of synthesizing polyacrylamide. The optimum reaction temperature was confirmed as 30 ℃ and the optimum reaction time was 4 h. Contrast the polymerization efficiency of bisulfite initiator with oxidation-reduction initiator system and peroxide initiator through IR, comparison of the relative molecular mass and viscosity, bisulfite was confirmed as a suitable initator for acrylamide. Experiments confirmed that bisulfite was the suitable copolymerization initator for acrylamide with 2-acrylamido-2-methylpropanesulfonic acid and acrylic acid.
polymerization; initiator; bisulfite; acrylamide
2014-09-15;修改稿收到日期:2015-01-27。
赵庆美(1979-) ,女,在读博士,讲师,从事研究方向为有机高分子合成。E-mail: 442632931@qq.com。
国家重大科技专项基金(2011E-2407);中国石油科技创新基金(2013D-5006-0207)。
TQ316.3
A
*通信联系人, E-mail:linzhao2000@126.com。
