多普勒超声阻力指数联合肿瘤标记物对卵巢癌的诊断价值
2015-04-19郑明阳王莉
郑明阳 王莉
卵巢癌是女性生殖器三大恶性肿瘤之一,在妇科肿瘤中其发病率次于宫颈癌和子宫体癌,居第三位,而其致死率却占首位,严重危害妇女生命,且其发病率有逐年上升趋势[1]。早期卵巢癌确诊很少,就诊时约70%已处于晚期[2]。I期卵巢癌的5年生存率可达85%~94%,Ⅱ期大约为70%,Ⅲ期或Ⅳ期<30%,因此如何对卵巢癌做出早期诊断、及时手术治疗尤为重要[3]。本文应用超声阻力指数(RI指数)联合血清肿瘤标记物CA125、CA199、CA72-4诊断卵巢癌,以探讨联合检查在诊断卵巢癌的临床价值。
1 资料与方法
1.1 一般资料 选取2011年5月-2014年5月在本院治疗的92例卵巢肿瘤患者作为研究对象,所有患者入院前均未接受任何治疗。入院后均进行血清肿瘤标记物CA125、CA199、CA72-4及阴式彩超及多普勒彩超血流阻力指数检查。其中恶性卵巢肿瘤42例(恶性组),均为术后病理证实。年龄21~62岁,平均(52±11.5)岁;其中浆液性囊腺癌20例,黏液性囊腺癌8例,子宫内膜样腺癌10例,透明细胞癌2例,混合上皮性癌1例,内胚窦癌1例;卵巢良性肿瘤(对照组)50例,年龄19~71岁,平均(50±13.5)岁,其中浆液性囊腺瘤26例,黏液性囊腺瘤11例,成熟畸胎瘤5例,子宫内膜异位囊肿6例,纤维瘤2例。
1.2 仪器与方法 血清肿瘤标记物检查:术前清晨取肘静脉血4 mL,离心分离血清待检。肿瘤标记物CA125、CA199、CA72-4采用电化学发光法,应用罗氏COBAS6000电化学发光仪及配套试剂检测。严格按照说明书要求进行操作,以CA125≥35 U/mL,CA19≥27 U/mL,CA72-4≥6.9 U/mL为判断阳性标准。超声检测:采用GE公司的voluson E8机型,阴道超声探头频率为5~9 Hz。经阴道探头探测子宫及附件区,必要时结合经腹部探头。仔细扫描附件区肿物的大小、囊壁厚度、间隔、乳头或实质区大小、回声及声影情况,彩色多普勒探测肿块血流,至少获得三个心动周期以上的频谱图形,测定RI值,在同一肿物内部和周边获得多个动脉波形,采用最小的RI值,以RI≤0.4判断为恶性。
1.3 统计学处理 数据统计采用SPSS 13.0统计软件处理,计量资料以(±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 恶性组及对照组肿瘤标记物及RI比值检测结果与对照组相比,恶性组的CA125、199、724水平均明显增高,差异有统计学意义(P<0.05);恶性组与对照组RI值相比差异具有统计学意义(P<0.05),见表1。
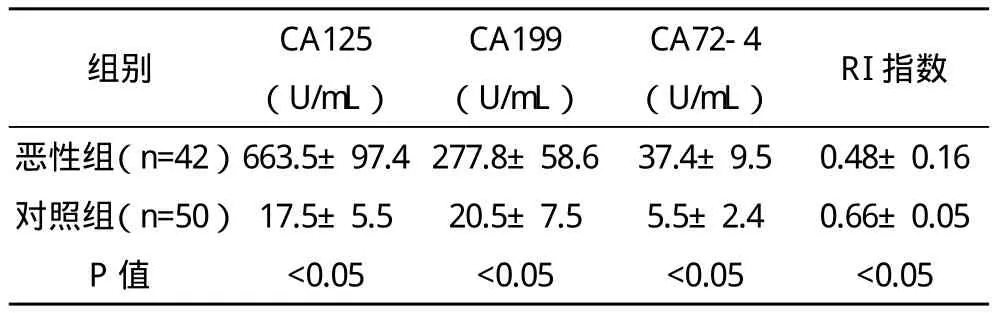
表1 两组肿瘤标记物及RI值比较(x-±s)
2.2 肿瘤标记物及RI值检测结果比较 根据肿瘤标记物及超声RI值判断肿物性质与术后病理结果进行对比,联合两种方法检查结果明显优于单独检测,见表2。
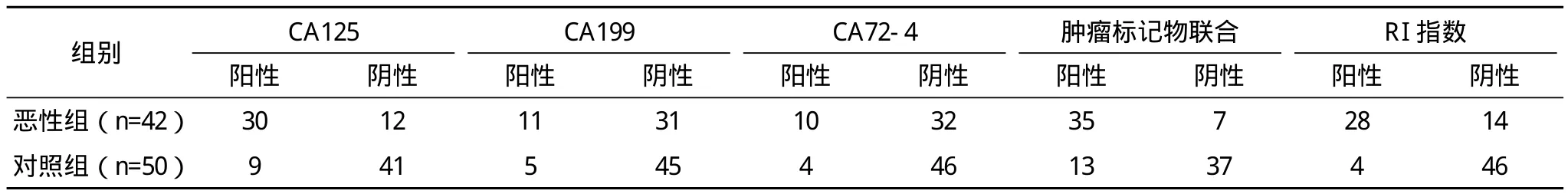
表2 肿瘤标记物及RI值检测结果与病理关系 例
2.3 两种检测方法及联合应用在卵巢癌诊断中的比较 单独检测CA125、CA199、CA72-4其敏感度分别是:71%、35%、31%。单独检测RI敏感度为66.7%,特异性为92.0%;联合肿瘤标记物及超声RI值能使敏感度达到95.7%,特异度达到96.2%,见表3。

表3 两种检测方法及联合应用在卵巢癌诊断中的比较 %
3 讨论
卵巢癌是妇科常见的恶性肿瘤之一,由于卵巢位于盆腔深部、卵巢恶性肿瘤病程隐匿,早期无明显典型症状,早期诊断困难,同时缺乏有效的早期筛查方法,大多数患者确诊已属于中晚期,5年存活率极低,有效的筛查办法是临床致力寻找的目标[4]。超声检查在目前现有的卵巢癌早期筛查方法中得到认可,经阴道彩超探头频率高,更接近盆腔,避免腹壁脂肪等干扰明显改善图像质量和分辨率,能更加清晰的显示肿瘤的内部结构及血流信号,利于小病灶的检出。卵巢癌彩超特点表现为盆腔肿块形态不规则,成囊实混合性,内部回声不均匀,囊壁有乳头状回声,包膜不完整,伴有腹水声像,CDFI血流丰富,RI低阻力,表现为高血流速度和低阻力特征,肿瘤内部血流频谱选择最低的RI和PI才代表发育异常的新生血管网,作为恶性肿瘤的参考[5]。目前彩色多普勒超声通过检测肿瘤组织血流变化及阻力指数来作为诊断恶性肿瘤的新指标[6]。卵巢癌组织生长快,常伴有丰富新生的异常血管,形成血管壁缺乏平滑肌、动静脉瘘、血管末端形成静脉池,因此不同的血流信号及阻力指数对卵巢肿瘤性质具有一定的鉴别作用,但良恶性肿瘤血流情况存在相当程度的交叉[7]。血流参数常用阻力指数或搏动指数表示,目前多普勒血流参数在诊断中尚无统一的标准,一般以阻力指数≤0.4,搏动指数<1作为针对恶性卵巢肿瘤的临界参考指标[8]。但不能简单套用,笔者的结果显示,阻力指数其单独检测敏感度为66.7%,特异性为92%,因其敏感度不高,容易造成漏诊。因此需要与其他检测方法联合应用提高准确性。有研究认为将经阴道彩色多普勒超声和卵巢肿瘤标记物检测相结合,卵巢癌的诊断率将提高[9]。
目前为止,卵巢癌肿瘤标记物临床应用最广、研究的最为活跃的就是CA125。CA125在上皮性卵巢癌细胞中高度表达,并能分泌到血液中,因此,血清CA125检测对卵巢恶性肿瘤特别是上皮性癌的诊断价值较高。但CA125在子宫内膜癌及某些良性疾病如子宫内膜异位症、卵巢囊肿、卵巢过度刺激综合征等良性疾病均会升高。另外恶性肿瘤时肿瘤标志物也不一定总是升高,例如大约20%卵巢癌缺乏CA125的表达[10]。有人指出血清CA125水平虽然在大多数卵巢恶性肿瘤患者中升高,但仅在不足一半的早期患者中升高[11]。笔者的研究结果显示,在卵巢癌的患者中CA125的敏感度为71%。虽然CA125标志物已广泛应用于卵巢癌的临床诊断、疗效观察和疾病检测,但单独用于临床仍灵敏度较低,特异性也不高,限制了其在临床的作用,多与其他肿瘤标记物联合应用,临床需要的是多种有效的肿瘤标准物组合[12]。
CA199是由结直肠癌细胞系相关抗原制备的单克隆抗体,约50%的卵巢上皮肿瘤中阳性表达,其在卵巢交界性肿瘤中低表达而在恶性肿瘤中高表达,卵巢黏液性囊腺癌阳性表达率可达76%,目前逐渐将其用于卵巢交界性与恶性肿瘤方面的辅助诊断并越来越受到关注[13]。CA72-4作为一种较新的肿瘤标记物应用于胃癌和卵巢癌的辅助诊断的报道在国内外陆续可见,CA72-4在多种恶性肿瘤中均有表达,在不同的卵巢肿瘤类型和卵巢癌的分期中的表达情况有所不同,是卵巢上皮性癌尤其是黏液性卵巢癌较好的血清学标记物,有研究指出,其在卵巢黏液性囊腺癌中的阳性率高于CA125[14]。CA72-4针对黏液性卵巢癌的诊断较为准确,即使在交界性黏液性肿瘤阳性率也较高,但单独检测CA72-4的敏感性和特异性尚不能用于临床确诊,联合检测CA72-4和CA125可提高卵巢癌的阳性检出率。Donach等[15]指出,CA72-4联合CA125检测能使原发性卵巢癌的诊断敏感度提高到80%,因此血清学的单一检测在卵巢癌的诊断的应用价值各有千秋,需要联合检测提高敏感性。而笔者研究显示联合肿瘤标记物及超声RI值能使敏感度达到95.7%,特异度达到96.2%。因此,超声与肿瘤标记物的联合检测能明显提高卵巢癌诊断的敏感度及特异度,可以很好的避免误诊使患者增加心理负担、进行过于积极的手术干预及不必要的治疗,也可以避免漏诊带来的延误手术及治疗时机。
综上所述,因卵巢恶性肿瘤是多因素诱导,多基因参与、多阶段发生的复杂病理过程,任何单一方法在确诊卵巢癌上都存在一定的局限性,单独检测均会出现假阴性、假阳性,造成漏诊,联合肿瘤标记物及超声检查能提高诊断敏感性,降低漏诊率。对单独肿瘤标记物或超声血流检测出现阳性的病例,要密切随访、联合检测,以能对卵巢癌早期发现早期诊断。因此联合检测对卵巢癌的早期发现早期诊断具有重要的临床意义。
[1]栾晓蕊,李卫平,狄文.卵巢癌早期诊断的血清肿瘤标记物研究进展[J].国际妇产科杂志,2009,36(6):458-461.
[2]刘莹,张颖.卵巢癌临床治疗回顾及展望[J].中国医学创新,2013,10(12):153-154.
[3]钱林华,高燕,李惠东,等.超声联合CA125、CA199诊断早期上皮性卵巢癌的临床价值[J].天津医科大学学报,2010,16(3):502-505.
[4] Paul D P Pharoah.The Potential for risk stratification the management of ovarian cancer risk[J].Int J Gynecol Cancer,2012,22(4):16-17.
[5]曲延俊,赵小阳,董丽娜,等.彩色多普勒超声检查对卵巢癌腹膜及淋巴结转移的诊断价值[J].实用妇产科杂志,2010,26(8):605-607.
[6]柳冰蕾,陈婷婷,关钥,等.阴道彩超诊断卵巢肿瘤内血流指数预测良恶性的前瞻性研究[J].中外医学研究,2011,9(28):37-38.
[7]许祯杰,徐风亮,徐日,等.血清肿瘤标记物临河彩色多普勒超声诊断卵巢癌的价值[J].中国实用医刊,2013,40(6):26-28.
[8]海赛苹,杨丽春.彩色多普勒血流显像联合血清CA125对卵巢恶性肿瘤早期诊断的研究进展[J]临床超声医学杂志,2009,11(7):475-477.
[9]覃利菊.卵巢癌诊断和治疗的现状及进展[J].中外医学研究,2013,11(19):147-149.
[10]吕讷男,姚洪文,吴令英.血清CA125在卵巢上皮性癌中的应用研究进展[J].临床肿瘤学杂志,2010,15(11):1041-1045.
[11]钱明,袁君君,廖莉娅,等.HE4与CA125检测对卵巢癌诊断的效果评价[J].中国医学创新,2011,8(27):15-16.
[12] Fung E T.A recipe for proteomics diagnostic test development:the OVA1 test,from biomarker discovery to FDA clearance[J].Clin Chem,2010,56(2):327-329.
[13]杜春芳,赵霞,贾薇,等.卵巢癌早期诊断血清学标记物研究新进展[J].现代肿瘤医学,2013,21(12):2866-2869.
[14]冯敏清,林仲秋.CA72-4在肿瘤诊治中的应用价值[J].国际妇产科学杂志,2011,38(6):534-536.
[15] Donach M,Yu Y,Artioli G,et al.Combined use of biomarkers for detection of ovarian cancer in high-risk women[J].Tumor Biol,2010,31(3):209-215.
