泡核桃壳提取物体外抗肿瘤作用研究
2015-04-18刘成娇夏盟恺
刘成娇,夏盟恺,李 杨,王 莹
(大理学院药学与化学学院,云南大理 671000)
漾濞泡核桃(Juglans sigillata)别名漾濞核桃、茶核桃、铁核桃,主要分布于云南、贵州、四川西部、西藏及雅鲁藏布江下游等地〔1〕。《中药大辞典》中记载核桃楸皮和核桃楸果具有清热、解毒、明目和止痛等功效〔2〕。药理活性研究表明胡桃楸的不同部位,包括茎枝、皮、根、叶和核桃青皮的提取物均具有抗肿瘤作用〔3-6〕。而对于核桃成熟果实内皮(核桃壳)的抗肿瘤作用研究较少。云南省大理州漾濞县为核桃之乡,大量种植泡核桃。在核桃仁的深加工中,被废弃的核桃壳大部分被用作农户燃料,造成了资源的极大浪费。本研究观察了泡核桃壳提取组分对3株肿瘤细胞的抑制作用,从而为今后泡核桃壳药用价值的开发提供理论依据。
1 实验材料
1.1 材料
1.1.1 药品与试剂 RPMI-1640、新生牛血清、MTT、PBS购于Beijing solarbio science&technology co.ltd;顺铂(Cisplatin,DDP)购自云南生物谷灯盏花药业有限公司;青霉素、链霉素购自河南新乡华星药厂;二甲基噻唑二苯基四唑溴盐为Amresco公司生产。
1.1.2 细胞株 人卵巢癌细胞SKOV-3、人肝癌细胞HepG-2、人胃癌细胞MGC-803均由中国科学院昆明动物研究所提供。
1.2 仪器 BB16UV/BB5060UV型CO2培养箱为德国Heraeus公司生产;IX-7型倒置相差显微镜为日本Olympus公司生产;IX-31型光学生物显微镜为日本Olympus公司生产;连续波长酶标仪为BIOTek公司生产;METFLERAE240型电子分析天平为梅特勒—托利多仪器(上海)有限公司生产;1.0R型低温高速离心机为德国Heraeus公司生产。
2 方法
2.1 抗肿瘤活性成分的分离提取 泡核桃壳经10%NaOH浸泡24 h后,用冰醋酸调pH为中性,加2、4、6倍乙醇沉淀得到HTKD(D)、HTKE(E)、HTKF(F)提取物,所占生药百分率分别为7.55%、3.34%和1.32%,精密称取D、E、F组分,用无血清培养基RPMI-1640配制成浓度为300μg/mL的原液,0.2μm微孔滤膜过滤除菌,再倍比稀释成150、75、37.5、18.75 μg/mL药液待用。
2.2 阳性对照药物的配制 阳性药选用DDP,取1 mg/mL的DDP溶于无血清的RPMI-1640中,5倍稀释,终浓度分别为 50、10、2、0.4 μg/mL。
2.3 体外细胞的培养 SKOV-3、HepG-2和MGC-803均用含10%灭活胎牛血清的RPMI-1640培养基在37℃、5%CO2条件下培养,取对数生长期细胞用于实验。
2.4 改良MTT法测3种不同提取物对癌细胞的影响 取对数生长期的肿瘤细胞(SKOV-3、HepG-2、MGC-803),将贴壁细胞浓度调整为6×104个/mL,以90μL/孔种入96孔培养板中。同时设立空白组、阴性对照组及阳性对照组(DDP),每组至少设5个复孔。置于37℃、5%CO2培养箱中培养24 h,受试组分别加入10μL不同浓度的样品。加药后将96孔板置37℃、5%CO2培养箱中培养24 h后,弃培养液,PBS洗板3次,再加90μL含5%血清RPMI-1640培养液,同时每孔加10μL浓度为5 mg/mL的MTT,继续培养4 h后,弃去培养液,每孔加100μL DMSO溶解,570 nm波长下测定吸光度值(OD)。
2.5 数据处理 计算核桃壳3个组分在不同测试浓度下OD值的均数及标准差,并用下述公式计算细胞的抑制率。细胞抑制率=(对照组OD值-给药组OD值)/对照组OD值×100%,细胞的半数抑制浓度(IC50)值由GWBASIC软件计算得到。SPSS分析量效相关系数。
3 结果
3.1 核桃壳提取物对3株肿瘤细胞作用24 h时的半数抑制浓度 与阳性对照药顺铂相比较,核桃壳提取物 D、E、F对肿瘤细胞SKOV-3、HepG-2 和MGC-803均有一定的抑制作用,但作用较弱,IC50值均远远大于阳性药,差异有统计学意义(P<0.01),其中提取物D对HepG-2的作用呈双向性,因而未能求得IC50值。在3个组分中核桃壳提取物E对3株肿瘤细胞的IC50值均最小。见表1。
表1 核桃壳提取物D、E、F对3株肿瘤细胞作用24 h时的IC50(±s)
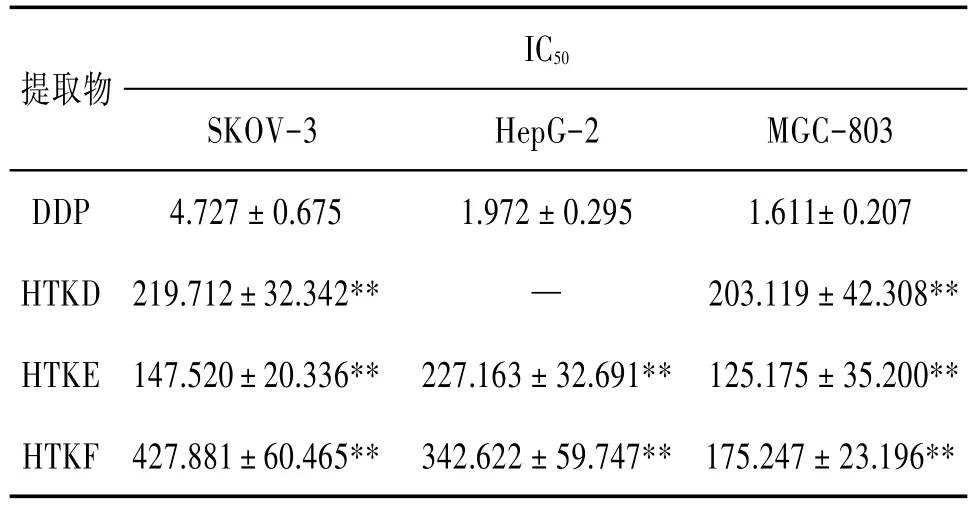
表1 核桃壳提取物D、E、F对3株肿瘤细胞作用24 h时的IC50(±s)
注:与对照组比较,*P<0.05,**P<0.01。
提取物DDP HTKD HTKE HTKF MGC-803 1.611±0.207 203.119±42.308**125.175±35.200**175.247±23.196**SKOV-3 4.727±0.675 219.712±32.342**147.520±20.336**427.881±60.465**IC50 HepG-2 1.972±0.295—227.163±32.691**342.622±59.747**
3.2 核桃壳提取物对3株人癌细胞作用的量效关系分析 图1~3显示了各组分抑瘤作用的量效关系。作用24 h后,各组分对肿瘤细胞的抑制作用均呈现出良好的剂量依赖性(除了组分D对HepG-2的作用),量效相关系数见表2;随着组分D、E、F浓度的增加,抑制率亦增加。在高浓度(300μg/mL)下,组分E对3株癌细胞的抑制作用优于D和F,对癌细胞的抑制率超过60%。见图1~3。组分D在较低浓度对肝癌细胞HepG-2不仅没有抑制作用,反而表现出促进细胞生长的作用,浓度在75μg/mL时其促生长作用最明显。

表2 核桃壳提取物对3株人癌细胞作用的量效相关系数

图1 核桃壳提取物D、E和F对SKOV-3细胞增殖的抑制作用
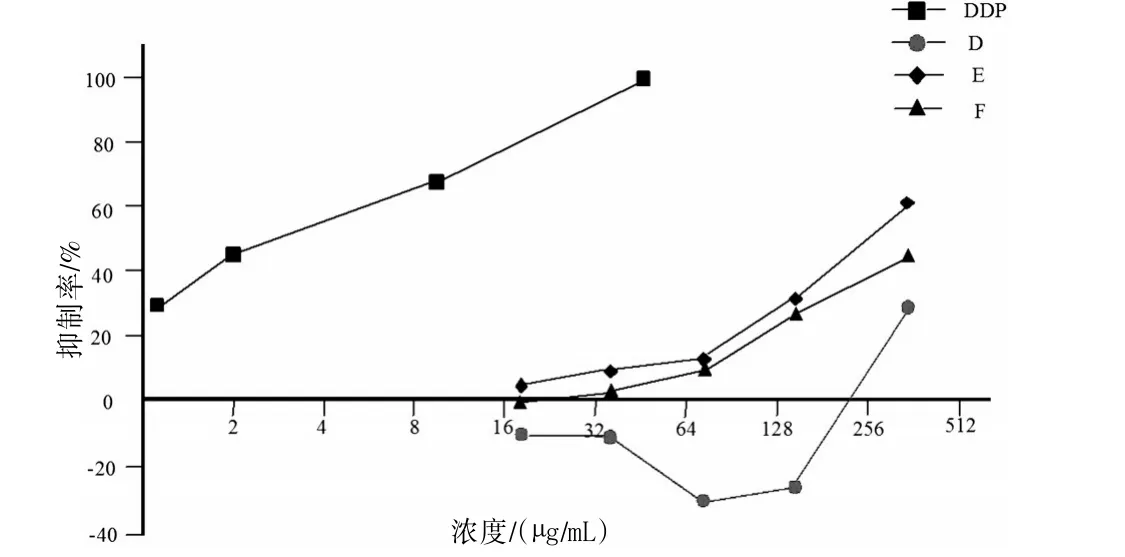
图2 核桃壳提取物D、E和F对HepG-2细胞增殖的抑制作用
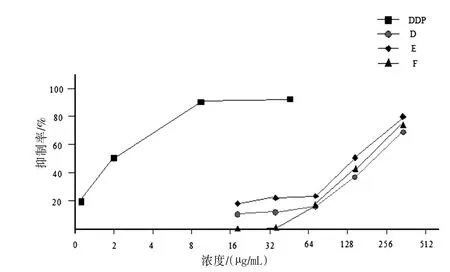
图3 核桃壳提取物D、E和F对MGC-803细胞增殖的抑制作用
4 结论
实验结果表明,从泡核桃壳中提取得到的3个组分对于不同癌细胞体外增殖均有一定抑制作用,但作用明显弱于阳性对照药顺铂,这可能是由于供试药品均是天然植物药的粗提物,有效成分含量较少所致,另外从组分D对HepG-2的双向作用来看,也可能因为供试药品中抑制和促进肿瘤生长的物质混合存在,因而影响了作用效果。其中组分E对3种癌细胞体外抑制作用较D和F强。E在高浓度(300 μg/mL)时,对3株人卵巢癌细胞SKOV-3、肝癌细胞HepG-2和人胃癌细胞MGC-803的抑制率分别达到了61.83%、62.83%和81.47%,组分E的IC50值也均小于D和F,提示主要药效物质可能存在于组分E中。
提取物D对HepG-2的作用呈双向性,高浓度(300μg/mL)具有抑制作用,当浓度小于150μg/mL时又表现出促进肿瘤生长的作用,周孟清等〔6〕也发现,核桃壳提取物小剂量对小鼠免疫功能有促进作用,大剂量作用反而不明显。这可能是因为天然植物药药效物质复杂、存在某些药效作用相反的成分所致。天然植物药的研究与开发,在资源、能源危机已日益突出的今天,具有广阔的前景和深远的意义。本实验对泡核桃壳的抗癌作用进行初步研究,为其在药效价值的开发利用上奠定实验基础。
〔1〕李寅珊,刘光明,李冬梅.GC-MS法鉴定漾濞泡核桃壳中挥发性化学成分〔J〕.安徽农业科学,2011,39(25):1527-1528.
〔2〕江苏新医学院.中药大辞典:下册〔M〕.上海:上海人民出版社,1977:1663.
〔3〕文姝,张红梅,金礼吉,等.胡桃楸提取液诱导Hela细胞凋亡的研究〔J〕.中国微生态学杂志,2002,14(2):81-82.
〔4〕季宇彬,汲晨锋,马宏图.青龙衣冷、热乙醇提取物对H22小鼠肿瘤细胞膜生化功能影响的研究〔J〕.中国中药杂志,2005,30(7):531.
〔5〕周萍,许兴景,王敏,等.泡核桃壳棕色素的提取和稳定性研究〔J〕.安徽农业科学,2011,39(7):3912-3913.
〔6〕周孟清,谢申伍,吕治钢,等.薄皮核桃壳醌类物质微波辅助提取及初步小鼠试验〔J〕.饲料工业,2013,34(21):20-23.
