干热法及大分子拥挤体系制备的共价复合物的物化性质*
2015-04-18齐军茹翁静宜冯纪璐刘倩茹杨晓泉
齐军茹 翁静宜 冯纪璐 刘倩茹 杨晓泉
(华南理工大学 轻工与食品学院, 广东 广州 510640)
干热法及大分子拥挤体系制备的共价复合物的物化性质*
齐军茹 翁静宜 冯纪璐 刘倩茹 杨晓泉
(华南理工大学 轻工与食品学院, 广东 广州 510640)
通过干热法和大分子拥挤体系分别制备大豆7S球蛋白-葡聚糖共价复合物,讨论不同反应体系制备的产物的物化性质差异.根据糖基化产物在7S等电点(pH=4.8)和中性条件(pH=6.5)下的溶解性将其分成两组分,对其接枝度、蛋白质二级结构、内置荧光和浊度进行分析.结果表明:在大分子拥挤环境下,7S在液相环境中发生了一定程度的水解,生成小分子的肽链,有利于多糖的共价接入;MC48(pH=4.8时制得,大分子拥挤体系)中主要是接枝程度较高的糖基化产物,MC65(pH=6.5时制得,大分子拥挤体系)中含有的糖基化产物接枝度较低,且程度不均匀;干热法制备得到的DH48(pH=4.8时制得)和DH65(pH=6.5时制得)接枝度较低,差异性不及大分子拥挤环境显著.SDS-PAGE、圆二色光谱、内置荧光分析结果表明,大分子拥挤环境下制得的MC48和MC65物化性质差异显著,而干热法制得的DH48和DH65的物化性质差异不明显.
大豆7S球蛋白;葡聚糖;物化性质;大分子拥挤体系;Maillard反应
从食品工业的效益角度来看,Maillard反应是一种高效、安全的蛋白质物性修饰方法[1- 3].多糖与蛋白质的共价接枝可以大大提高蛋白质的功能特性,如热稳定性、乳化特性、凝胶特性、发泡特性以及抗氧化性等[4- 9].到目前为止,常用来进行Maillard反应的主要是干热法,它通过控制一定的温度和湿度使蛋白质和多糖发生共价复合反应[10- 12].然而,干热法通常需要长达数天或者数周的反应时间,反应程度难以控制,容易导致产物发生过度的褐变,因此在大规模工业生产中并不可行,反应得到的产物没有商业价值[13].从经济性的角度而言,一种反应时间短、操作简单的糖基化方法才是业界所希望的.
文献[14]中报道了一种新型的糖基化加工方法——利用大分子拥挤环境完成Maillard反应.大分子拥挤环境是生命科学领域的新概念,已被应用到当前其他研究领域中.近年来,科学家们已充分证明,pH值、溶液中的离子强度、溶液的组成和分子拥挤程度都是影响Maillard反应的重要因素[15].在反应体系中,高浓度的大分子物质遵循分子排斥容积理论,能促进反应向着结合的方向进行[16].同时,在大分子拥挤环境中,蛋白质的聚集程度也被大大降低[12,14].除了干热法之外,还有许多其他的方法也能进行糖基化反应.例如,笔者曾利用80%的乙醇反应体系促进大豆酸沉蛋白与葡聚糖的共价复合反应[17],Xu等[18]采用干热法制备了7S球蛋白-葡聚糖共价复合物,Zhang等[14]采用大分子拥挤环境来促进7S球蛋白和葡聚糖的Maillard反应等.
笔者前期的研究结果表明,在大分子拥挤环境中,高浓度的葡聚糖能有效地抑制大豆7S球蛋白的热聚集行为[14].然而,与干热法相比,大分子拥挤环境下制得的共价复合物不够稳定,而且糖基化程度不均匀,糖基化产物整体的物化性质较差.以往的研究也表明,不同方法制备的糖基化产物的物化性质有显著差异,但截至目前,尚未有人探讨造成这种差异的根本原因.另外,蛋白质与多糖共价复合的一个主要优点是产物的物化性质在包括等电点的酸性范围内能得到有效的改善,因此,关注等电点处共价复合物的物性和结构以得到真正具有优异功能的糖基化产物,应该是蛋白质-多糖复合物制备的核心问题,并更具有研究意义.而且,等电点处获得的糖基化产物与传统中性范围得到的糖基化产物的差异很可能是进一步深化蛋白质-多糖共价复合物的应用的关键.
文中采用传统干热法和大分子拥挤体系制备得到糖基化产物,并根据pH4.8(7S球蛋白等电点)和pH6.5(中性)下的溶解度将产物分离分级,系统地研究了两种制备体系下所得共价复合物的物化性质的差异,探讨等电点处获得的糖基化产物具有优异功能的本质原因,并为不同条件下得到的糖基化产物的应用提供理论依据.
1 实验材料和方法
1.1 实验材料
大豆粕购于山东禹王有限公司,用杜马斯燃烧法测得其蛋白质含量为55.923%±0.158%(质量分数,下同);葡聚糖(分子质量67 ku)、2,4,6-三硝基苯磺酸(TNBS)购于美国Sigma-Aldrich公司;其他化学试剂如无特殊注明均为国产分析纯.
1.2 实验仪器
Alpha-4型冷冻干燥机,德国CHRIST公司生产;DYCZ-30型垂直板电泳仪,北京六一仪器厂生产;UV2300型紫外可见分光光度计,上海天美公司生产;Nano-ZS型激光动态力度扫描仪,英国Malvern公司生产;F-7000型荧光分光光度计,日本Hitachi公司生产;MultiMode SPM型原子力显微镜,美国Veeco公司生产;MOS-450型圆二色性光谱仪,法国BioLogic Science公司生产.
1.3 实验方法
1.3.1 大豆7S球蛋白的制备
大豆7S球蛋白按文献[19]的方法分离制备.
1.3.2 大豆7S球蛋白糖基化产物的制备
(1)大分子拥挤体系制备
将7S与葡聚糖(DEX)分别按50 g/L和150 g/L的质量浓度分散于蒸馏水中(pH=7.0),充分溶解后置于4 ℃冰箱中水化过夜,再在95 ℃恒温下加热搅拌6 h,冰浴结束反应.用1 mol/L的HCl调节pH值至4.8,搅拌2 h后于10 000g下离心30 min.得到的上清液回调pH值至7.0,冷冻干燥后得到组分MC48.沉淀以1∶10的比例复溶回调pH值至6.5,10 000g下离心30 min,上清液冷冻干燥后得到组分MC65.
(2)干热法制备
将7S与DEX按1∶1的质量比混合后分散于磷酸盐缓冲溶液(10 mmol/L,pH=6.8)中.冷冻干燥后,将冻干粉末放入干燥器中(底部放置过饱和的KBr溶液),置于60 ℃的烘箱中反应4 d.干热后的粉末重新分散到蒸馏水中,用1 mol/L的HCl调节pH值至4.8,搅拌2 h后于10 000g下离心30 min.得到的上清液回调pH值至6.5,冷冻干燥后得到组分DH48.沉淀以1∶10的比例复溶后,回调pH值至6.5,10 000g下离心30 min,冷冻干燥后得到组分DH65.
采用Dumas法测得冻干的MC48、MC65、DH48和DH65样品中蛋白质含量分别为4.21%、70.33%、15.45%和48.19%(干重,换算系数为5.71).
1.3.3 SDS-PAGE分析方法
依据Laemmli[20]的方法进行SDS-PAGE(十二烷基硫酸钠-聚丙烯酰氨凝胶电泳)分析.分离胶含量为12%(体积分数,下同),浓缩胶含量为5%,电极缓冲液(含SDS)为Tris-甘氨酸缓冲液(pH值约为8.3),上样量为10 μL.加样后电流设定为40 mA,样品进入浓缩胶后改为80 mA,当电泳跑至距离电泳槽橡胶底边约1.5 cm时,关闭电源.分别用考马斯亮蓝R-250试剂和过碘酸雪夫(PAS)染色法对凝胶胶片进行蛋白质及糖染色.
1.3.4 接枝度的测定
将0.5 mL待测样品(蛋白质含量1 g/L)、0.5 mL NaHCO3溶液(质量浓度40 g/L)、0.5 mL SDS溶液(质量浓度100 g/L)、0.5 mL TNBS溶液(质量浓度1 g/L)均匀混合,在40 ℃条件下避光反应2 h,加入1 mol/L的HCl溶液0.25 mL和0.01 mol/L的HCl溶液2.25 mL以终止反应,并于340 nm处测定其吸光度A.
接枝度(DG)的计算公式如下:
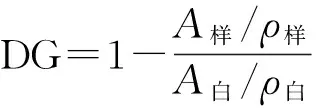
式中,A样和ρ样分别为糖基化产物的吸光度及蛋白质含量(g/L),A白和ρ白分别为大豆7S球蛋白的吸光度及蛋白质含量(g/L).
1.3.5 内置荧光光谱分析方法
内置荧光光谱分析参照文献[21]中的方法.用5 mmol/L的磷酸标准缓冲液(pH=7.0)配制糖基化产物及对照样待测液(蛋白质含量为1 g/L),在激发波长334 nm处用荧光分光光度计对样品进行发射波长扫描(350~500 nm),记录各样品的荧光光谱.电压为600 MV,激发和发射狭缝宽均设置为5 nm.
1.3.6 浊度的测定
浊度测定根据Damodaran等[22]的方法.分别称取一定量的大豆7S球蛋白、混合物和糖基化产物溶于不同pH值的水溶液中(样品蛋白质含量为2 g/L),于540 nm处测定吸光值.
1.3.7 圆二色光谱分析方法
用0.01 mol/L的磷酸盐标准缓冲液(pH=7.0)溶解一定量的待测样品(蛋白质含量为0.1 g/L),扫描波长设定为190~250 nm,所用样品池的光程为2 mm.圆二色光谱(CD)测定时所用的分辨率为0.5 nm,扫描速度为100 nm/min,灵敏度为10 °/m,实验温度为25 ℃.实验值取6次扫描的平均值.
2 结果与讨论
2.1 SDS-PAGE结果及分析
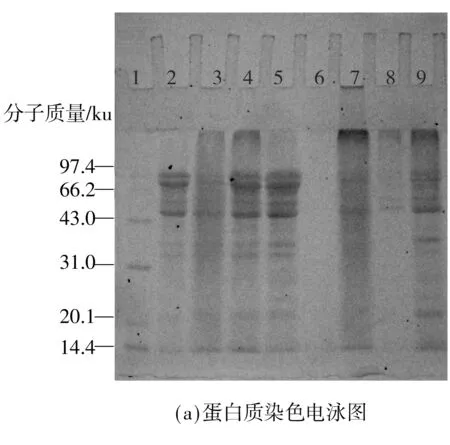
采用SDS-PAGE分析蛋白质-多糖共价复合物的形成,结果如图1所示.图1(a)中泳道2(蛋白质染色)和图1(b)中泳道2(糖染色)都是典型的7S球蛋白特征条带.图1(a)和1(b)中泳道6-9的分离胶的顶部均有多分散性条带形成.蛋白质染色和糖染色的一致性说明,在组分MC48、MC65、DH48和DH65中,7S球蛋白和葡聚糖之间均发生了共价交联,生成了高分子质量的共价复合物.泳道5中的特征条带与7S球蛋白的(泳道2)无异,说明没有经过加热处理的7S球蛋白-葡聚糖混合物不会发生聚合反应.在液相环境和干热状态下,7S球蛋白经加热处理后,α、α′和β亚基条带明显减弱(见泳道3、4),而在分离胶的顶部有新的大分子质量物质产生,这说明单纯的加热处理使得7S球蛋白发生自聚集反应;泳道3中亚基条带变淡程度比泳道4中明显,说明液体环境下7S球蛋白自聚集程度更加显著.
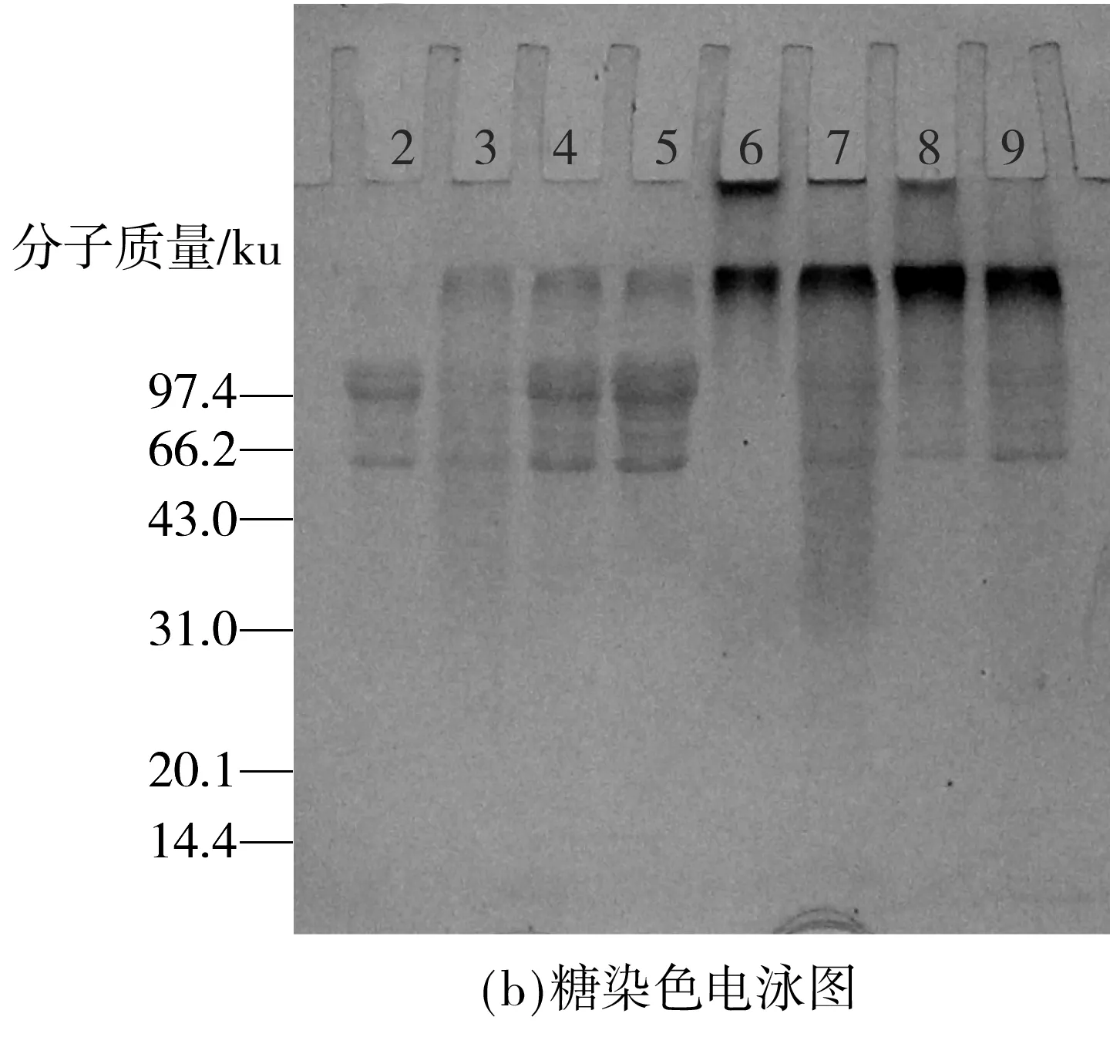
图1 不同反应条件下的蛋白质和糖染色的电泳图谱
Fig.1 Electrophoretograms with protein and carbohydrate staining under different reaction conditions
1—对照物;2—7S;3—7S,水浴(95 ℃,6 h);4—7S,干热(60 ℃,4 d);5—7S+葡聚糖混合物(未加热);6—MC48;7—MC65;8—DH48;9—DH65
大分子拥挤体系中,在样品上样量相同的条件下,糖染色的特征条带颜色程度相当(见图1(b)中泳道6和7),而蛋白质染色(见图1(a))泳道6的颜色明显较泳道7浅.由于葡聚糖不带电荷,未接枝的葡聚糖自身在凝胶电泳中不能向下移动,因此不会干扰糖染色,这说明糖染色电泳图中的泳道6对应的是接枝到7S球蛋白的葡聚糖,并且在MC48中,共价接枝在7S球蛋白上的葡聚糖比例要高于组分MC65.共价接枝结合了更多的葡聚糖链,使得MC48在7S球蛋白等电点下的溶解性提高,变为可溶组分.同时,图1(a)中泳道6和7的α、α′和β亚基条带明显减弱,条带的下端有小分子物质生成,这说明在液体环境下7S球蛋白发生了一定程度的水解,这与图1(a)中泳道3的结果相对应,进一步说明7S球蛋白在液相环境下会分解成小分子的肽链,而经过糖基化反应和pH4.8、pH6.5环境下的沉淀分离后,留在组分MC48中的主要是接枝程度较高的大分子质量糖基化产物,留在组分MC65中的则是不同接枝程度的较小分子质量的糖基化产物.
对比大分子拥挤环境,干热法制备得到的组分DH48和DH65在电泳条带上的差异不及大分子拥挤环境下的两种组分显著,这说明DH48和DH65的糖基化程度差异不及MC48、MC65的显著,7S球蛋白上共价结合的葡聚糖数目相差不大.
2.2 接枝度测定结果及分析
Maillard反应基于反应过程中发生的Amadori重排,使蛋白质分子中游离氨基基团连接到多糖分子的还原端.文中用接枝度来表征体系游离氨基的变化,从而表征蛋白质与多糖的Maillard反应的程度.
图2所示为不同反应条件下糖基化产物的接枝度变化.由图可知,大分子拥挤环境下制备的糖基化物接枝度均高于干热条件下制得的产物.MC48、MC65、DH48和DH65的接枝度分别为46.02%、21.58%、18.03%和8.03%.结合SDS-PAGE电泳图谱分析可知,在大分子拥挤环境下,7S球蛋白在液相环境中加热处理后发生了一定程度的水解,分子结构的展开为糖链的共价接枝提供了更多的位点,使接枝度提高.
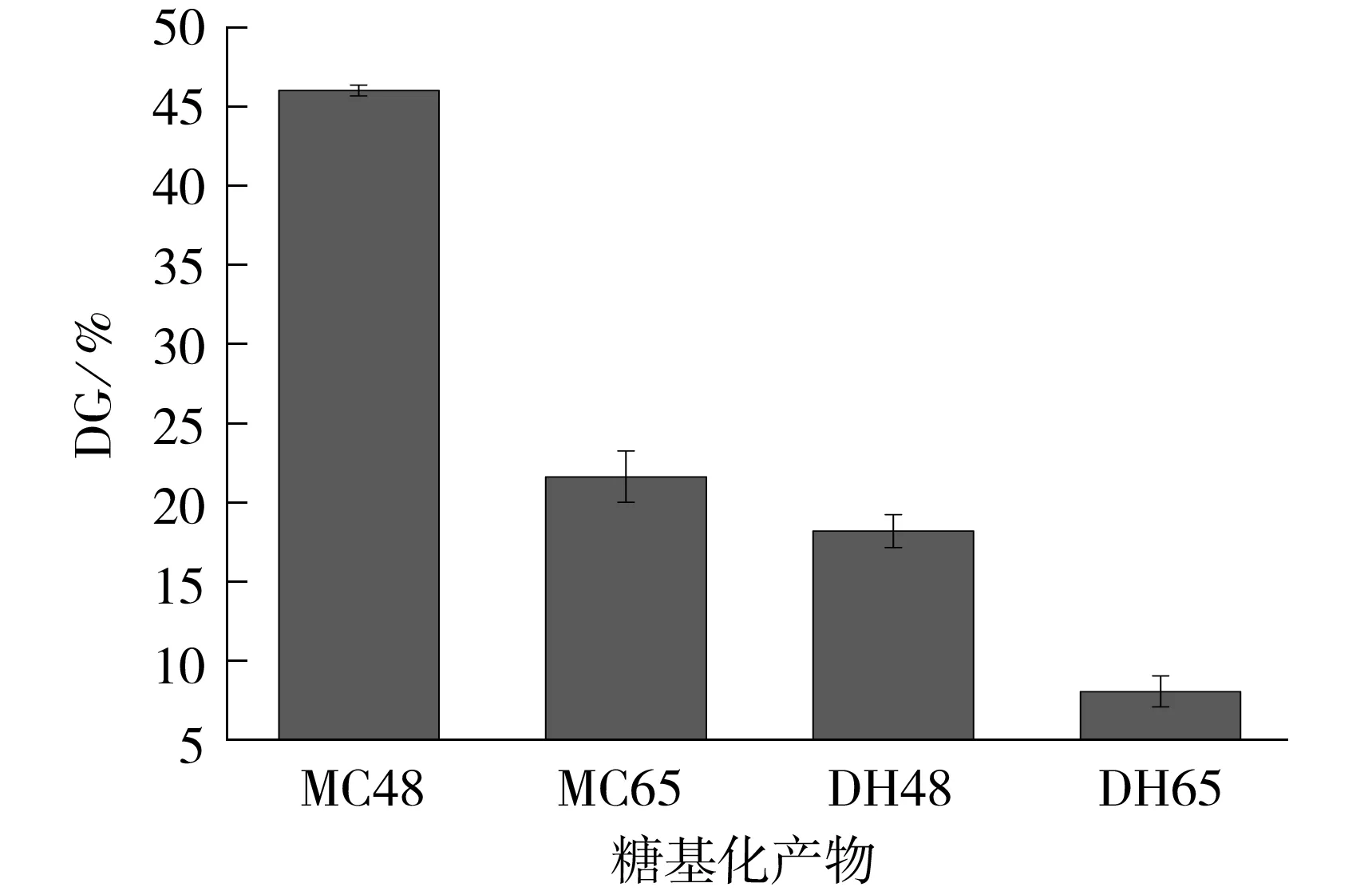
图2 不同反应条件下的糖基化产物的接枝度
Fig.2 DG of glycosylated products under different reaction conditions
2.3 浊度结果及分析
大豆7S球蛋白聚集至一定程度的蛋白质溶液,其颗粒直径会变大,导致浊度升高[23].图3显示了两种方法制备得到的共价复合物以及它们的对照样在不同pH值下的浊度变化.由图3(a)和3(b)可知,大豆7S球蛋白在等电点(pH=4.8)处附近的浊度最高,单纯加入葡聚糖后,浊度有所下降,这说明单纯加入多糖对大豆7S球蛋白的聚集有一定的削弱作用;而糖基化物的浊度与大豆7S球蛋白相比有明显的降低趋势,这说明多糖共价接枝在蛋白质分子表面能有效减少大豆7S球蛋白的聚集,这与张曦[24]的实验结果一致.这是因为蛋白质分子表面共价结合亲水性较强的多糖分子会使得大豆7S球蛋白整体的亲水性提高,溶解性增强,浊度降低.同时由于多糖的空间排阻效应削弱了蛋白质分子间的静电结合作用,最终达到减少蛋白质分子聚集的效果.

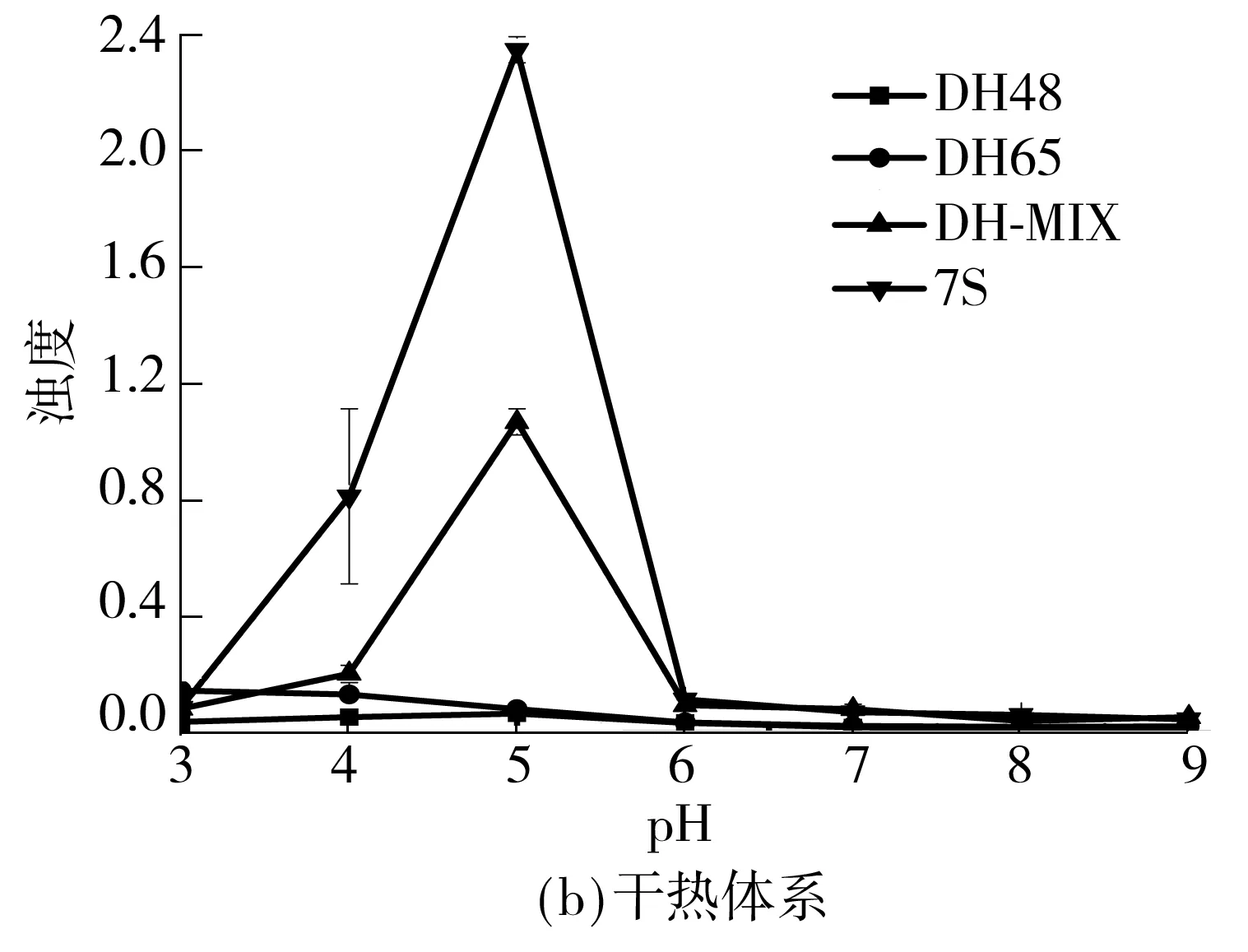
图3 共价复合物和对照样的浊度
在大分子环境下制备得到的两种组分的浊度差异要大于干热法制得的两种组分.结合接枝度分析结果可知,在大分子环境下制得的两种组分的接枝程度差异较大,导致浊度差异显著.而干热法制备得到的组分接枝度差异不明显,导致浊度差异不显著.
2.4 内置荧光光谱结果及分析
Maillard反应中一个显著的特征是有色物质的生成,而荧光物质是Maillard反应高级阶段有色物质的前体物.通过对内源荧光强度的比较,可以进一步反映糖基化反应的程度[25].
如图4所示,在其他条件相同的情况下,大分子拥挤环境下得到的糖基化产物在43 nm处的荧光强度均大于干热法制得的产物,其中MC48的荧光强度最强,说明该组分的美拉德反应程度最高,MC65次之.干热条件下,同样是pH=4.8时制得的可溶组分的荧光强度较大,pH=6.5时制得的次之,这也与2.2节中接枝度的结果相一致.
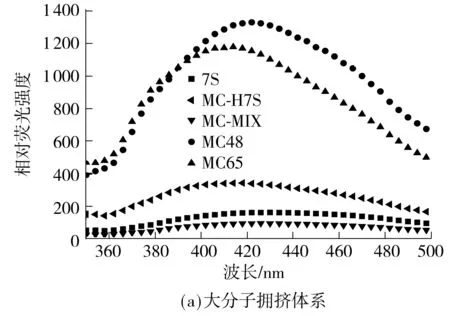
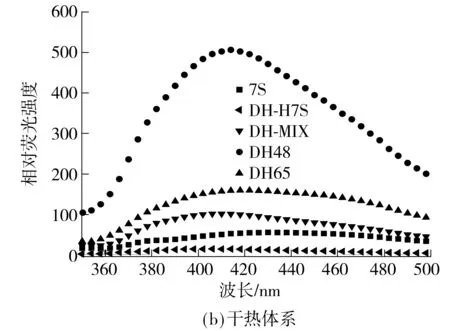
图4 共价复合物和对照样的内置荧光光谱
Fig.4 Intrinsic fluorescence emission spectra of conjugates and contrast samples
MC-H7S:大分子拥挤环境下7S热处理;DH-H7S:干热条件下7S热处理;下同
由大分子拥挤体系和干热法制得的产物差异性分析可知,干热反应体系是一种固―固非均相反应体系,只有当多糖分子中的还原性醛基有机会与蛋白质中的伯氨基接触时才会发生化学作用.在这种环境下,固相反应物间的实际接触面积较小,且反应物间的接触不均匀、不充分,反应受到限制,产物性能差别较大.在液相体系中,蛋白质与多糖之间接触的几率更大,在相对较短的反应时间下,反应的程度更高,且各组分性能较均匀[26].
2.5 蛋白质二级结构变化
采用圆二色光谱来研究不同组分蛋白质的二级结构变化.由图5(a)可知,大分子体系中,糖基化后在不同pH值下分离出的组分蛋白质的二级结构差异较大,由7S和混合物的圆二色光谱曲线能看出明显的α-螺旋和β-折叠有序结构(α-螺旋的CD谱在192 nm附近有一正峰,在208、222 nm处有2个负的特征肩峰;β-折叠在216~218 nm处有一负峰,在185~200 nm处有一强的正峰),7S加热后负峰振幅明显增大,表明7S生成了更多的β-折叠结构,王金梅[27]和王昌盛[28]的研究也表明,加热能使蛋白质的β-折叠结构增加.MC45在198 nm附近有一负峰,在220 nm附近有一小而宽的正峰,是典型的无规则卷曲特征图谱,结合之前的分析,这可能是因为MC48在糖基化反应过程中结合了更多的糖链,使得蛋白质结构较大程度地伸展开来,蛋白质的二级结构由有序转变为以无规则卷曲为主.而对比大豆7S球蛋白,MC65的负峰有少许下降,说明MC65的二级结构因为糖接枝发生了一定的变化,但效果没有MC48显著.孙常雁[29]在研究乳清蛋白-葡聚糖的CD光谱时也发现,乳清蛋白分子中接入的葡聚糖分子数量越多,蛋白质分子舒展程度越大,即越能打开蛋白质原有的有序紧密结构,最终影响其二级结构[30- 31].

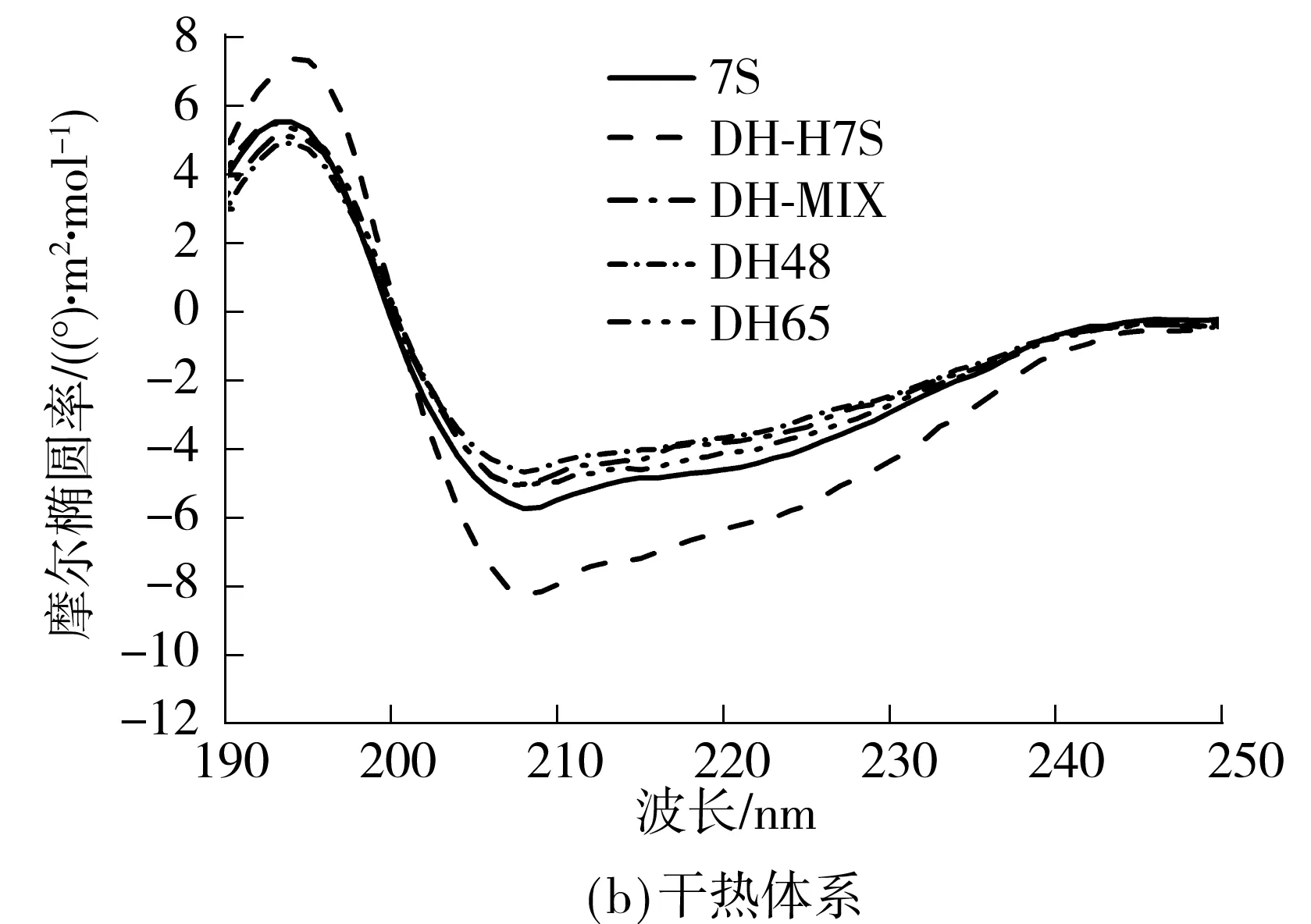
图5 不同反应条件下的糖基化产物的远紫外圆二色光谱
Fig.5 Far-UV CD spectra of conjugates and contrast samples under different reaction conditions
由图5(b)可知,干热体系各组分的CD图谱没有显著差异,说明干热条件下糖基化产物的蛋白质结构变化不大.结合接枝度结果可知,该反应体系下所得接枝产物的糖基化程度不高,这也是蛋白质二级结构没有显著变化的重要原因.
3 结论
文中用大分子拥挤体系和干热法制备7S-葡聚糖共价复合物,根据糖基化产物在7S等电点(pH=4.8)和中性条件(pH=6.5)下的溶解性差异进行分离分级.通过SDS-PAGE、圆二色光谱、内置荧光光谱、浊度等分析手段系统探讨了不同糖基化产物的物化性质差异,得出以下结论:
(1)在大分子拥挤体系下,与葡聚糖共价接枝后分别在pH=4.8和pH=6.5下沉淀分离得到的组分中,留在MC48中的主要是接枝程度较高的糖基化物,MC65中则是不同接枝程度且分子质量较小的糖基化物.换言之,MC48中接枝的多糖链能够完整地包裹在7S球蛋白分子表面,而MC65中多糖链部分包裹7S球蛋白,接枝度相对较低,由此可以推测,大分子拥挤体系得到的两组分糖基化产物在后续的物性表征中会有明显的不同.
(2)大分子环境下得到的糖基化物接枝程度高的主要原因是7S球蛋白在液体环境中发生了一定程度的水解,分解成小分子的肽链,为葡聚糖的共价接枝提供了更多的位点.
(3)SDS-PAGE、圆二色光谱、内置荧光光谱、浊度分析等的结果表明,大分子环境下制备得到的MC48和MC65物化性质差异显著,而干热法制得的DH48和DH65的物化特性差异不明显.
[1] Corzo-Martínez M,Moreno F J,Olano A,et al.Structural characterization of bovineβ-lactoglobulin-galactose/tagatose Maillard complexes by electrophoretic,chromatographic,and spectroscopic methods [J].Journal of Agricultural and Food Chemistry,2008,56(11):4244- 4252.
[2] Sun Y,Hayakawa S,Izumori K.Modification of ovalbumin with a rare ketohexose through the Maillard reaction:effect on protein structure and gel properties [J].Journal of Agricultural and Food Chemistry,2004,52(5):1293- 1299.
[3] Wu N N,Zhang J B,Bin T A N,et al.Characterization and interfacial behavior of nanoparticles prepared from amphiphilic hydrolysates ofβ-conglycinin-dextran conjugates [J].Journal of Agricultural and Food Chemistry,2014,62(52):12678- 12685.
[4] Kato A,Minaki K,Kobayashi K.Improvement of emulsi-fying properties of egg white proteins by the attachment of polysaccharide through Maillard reaction in a dry state [J].Journal of Agricultural and Food Chemistry,1993,41(4):540- 543.
[5] Kato A,Murata K,Kobayashi K.Preparation and characterization of ovalbumin-dextran conjugate having excellent emulsifying properties [J].Journal of Agricultural and Food Chemistry,1988,36(3):421- 425.
[6] Kato Y,Aoki T,Kato N,et al.Modification of ovalbumin with glucose 6-phosphate by amino-carbonyl reaction:improvement of protein heat stability and emulsifying activity [J].Journal of Agricultural and Food Chemistry,1995,43(2):301- 305.
[7] Nakamura S,Kato A,Kobayashi K.Enhanced antioxidative effect of ovalbumin due to covalent binding of polysaccharides [J].Journal of Agricultural and Food Che-mistry,1992,40(11):2033- 2037.
[8] Easa A M,Hill S E,Mitchell J R,et al.Bovine serum albumin gelation as a result of the Maillard reaction [J].Food Hydrocolloids,1996,10(2):199- 202.
[9] Matsudomi N,Nakano K,Soma A,et al.Improvement of gel properties of dried egg white by modification with galactomannan through the Maillard reaction [J].Journal of Agricultural and Food Chemistry,2002,50(14):4113- 4118.
[10] Akhtar M,Dickinson E.Whey protein-maltodextrin conjugates as emulsifying agents:an alternative to gum arabic [J].Food Hydrocolloids,2007,21(4):607- 616.
[11] Diftis N,Kiosseoglou V.Physicochemical properties of dry-heated soy protein isolate-dextran mixtures [J].Food Chemistry,2006,96(2):228- 233.
[12] Xu K,Yao P.Stable oil-in-water emulsions prepared from soy protein-dextran conjugates [J].Langmuir,2009,25(17):9714- 9720.
[13] Zhu D,Damodaran S,Lucey J A.Formation of whey protein isolate(WPI)-dextran conjugates in aqueous solutions [J].Journal of Agricultural and Food Chemistry,2008,56(16):7113- 7118.
[14] Zhang X,Qi J R,Li K K,et al.Characterization of soyβ-conglycinin-dextran conjugate prepared by Maillard reaction in crowded liquid system [J].Food Research International,2012,49(2):648- 654.
[15] Ellis R J.Macromolecular crowding:obvious but underappreciated [J].Trends in Biochemical Sciences,2001,26(10):597- 604.
[16] Zimmerman S B,Minton A P.Macromolecular crowding:biochemical,biophysical,and physiological consequences [J].Annual Review of Biophysics and Biomolecular Structure,1993,22(1):27- 65.
[17] Qi J R,Yang X Q,Liao J S.Improvement of functional properties of acid-precipitated soy protein by the attachment of dextran through Maillard reaction [J].International Journal of Food Science & Technology,2009,44(11):2296- 2302.
[18] Xu C H,Yu S J,Yang X Q,et al.Emulsifying properties and structural characteristics ofβ-conglycinin and dextran conjugates synthesised in a pressurised liquid system [J].International Journal of Food Science & Technology,2010,45(5):995- 1001.
[19] Nagano T,Hirotsuka M,Mori H,et al.Dynamic viscoelastic study on the gelation of 7S globulin from soybeans [J].Journal of Agricultural and Food Chemistry,1992,40(6):941- 944.
[20] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J].Nature,1970,227(5259):680- 685.
[21] Morales F J,Salvio F P.Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence [J].Food Chemistry,2001,72(1):119- 125.
[22] Damodaran S,Kinsella J E.Effect of conglycinin on the thermal aggregation of glycinin [J].Journal of Agricultural and Food Chemistry,1982,30(5):812- 817.
[23] Thorarinsdottir K A,Arason S,Geirsdottir M B,et al.Changes in myofibrillar proteins dsuring processing of salted cod(Gadusmorhua)as determined by electrophoresis and differential scanning calorimetry [J].Food Chemistry,2002,77(3):377- 385.
[24] 张曦.大分子拥挤环境下葡聚糖对大豆7S球蛋白的物性修饰及其功能特性研究 [D].广州:华南理工大学轻工与食品学院,2013.
[25] 王玉堃.干热过程中美拉德反应对蛋清粉凝胶性的改性研究 [D].无锡:江南大学食品学院,2011.
[26] 王玉堃.美拉德反应改进大米蛋白功能性质的研究 [D].无锡:江南大学食品学院,2008.
[27] 王金梅.大豆蛋白热聚集行为及界面、乳化性质研究 [D].广州:华南理工大学轻工与食品学院,2012.
[28] 王昌盛.大豆球蛋白自组装纤维的形成及静电屏蔽调控研究 [D].广州:华南理工大学轻工与食品学院,2011.
[29] 孙常雁.乳清蛋白肽美拉德反应产物的制备及其抗氧化作用机理研究 [D].哈尔滨:东北农业大学食品学院,2014.
[30] Jiang Z M,Dilip K R,Paula M O.Heat-induced Maillard reaction of the tripeptide IPP and ribose:structural cha-racterization and implication on bioactivity [J].Food Research International,2013(50):266- 274.
[31] Jiang Z M,Brodkorb A.Structure and antioxidant activity of Maillard reaction products fromα-lactaibumin and 3-lactoglobulin with ribose in an aqueous model system [J].Food Chemistry,2012,133(3):960- 968.
Physicochemical Properties of Covalent Conjugates Prepared in Macromolecular Crowding Environment or via Dry-Heating Method
QiJun-ruWengJing-yiFengJi-luLiuQian-ruYangXiao-quan
(School of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,Guangdong,China)
Two kinds ofβ-conglycinin-dextran conjugates were prepared respectively in the macromolecular crowding environment or via the dry-heating method,and then a comparison was made in their physicochemical property.On the basis of the solubility of glycation products at the isoelectric point ofβ-conglycinin (pH=4.8) or under the neutral condition (pH=6.5),the products were separated into two components,and then a discussion was conducted about the graft degree,secondary structure,internal fluorescence and turbidity of the two components.The results show that (1)β-conglycinin in the macromolecular crowding and liquid phase environment is hydrolyzed to a certain degree,with small peptide chains being produced,which is beneficial to the covalent access of polysaccharide; (2) MC48 obtained at pH4.8 in the macromolecular crowding environment,is mainly the glycation product of high graft degree,while MC65 obtained at pH6.5 in the macromolecular crowding environment,contains the glycation products of both low and uneven graft degree; and (3) DH48 and DH65 obtained respectively at pH4.8 and pH6.5 via the dry-heating method,are of low graft degree,and their difference is less significant than that in the macromolecular crowding environment.Moreover,it is found from SDA-PAGE,CD and intrinsic fluorescence emission spectra that there exists a significant difference in physicochemical property between MC48 and MC65,while an insignificant difference between DH48 and DH65.
β-conglycinin;dextran;physicochemical properties;macromolecular crowding environment;Maillard reaction
2015- 05- 08
国家自然科学基金青年面上连续资助项目(31370036) Foundation item: Supported by the National Natural Science Foundation of China(31370036)
齐军茹(1977-),女,博士,副教授,主要从事蛋白质物性修饰研究.E-mail: jrqi@scut.edu.cn
1000- 565X(2015)11- 0016- 07
TS 201.1
10.3969/j.issn.1000-565X.2015.11.003
