交感神经损毁导致的心肌损伤及桂枝汤的保护作用*
2015-04-17姜月华马度芳杨金龙林海青曹欣坤
姜月华, 马度芳, 杨金龙, 王 雪, 林海青, 曹欣坤, 李 晓△
(1山东中医药大学附属医院,山东 济南 250011; 2山东中医药大学第一临床医学院,山东 济南 250355)
交感神经损毁导致的心肌损伤及桂枝汤的保护作用*
姜月华1, 马度芳2, 杨金龙1, 王 雪2, 林海青1, 曹欣坤2, 李 晓1△
(1山东中医药大学附属医院,山东 济南 250011;2山东中医药大学第一临床医学院,山东 济南 250355)
目的: 观察桂枝汤对6-羟基多巴胺(6-OHDA)诱导的大鼠心脏去交感神经损伤的防治作用。方法: 54只大鼠随机均分为6组,弥可保组和桂枝汤各组分别给予弥可保和不同桂芍配伍比例的桂枝汤进行药物干预,7 d后给予6-OHDA(100 mg/kg)腹腔连续注射3 d诱导建立心脏交感神经损伤模型。免疫组化观察左心室中酪氨酸羟化酶(TH)分布,ELISA法检测心肌中TH、胆碱乙酰氨基转移酶(ChAT)和生长相关蛋白43(GAP-43)含量。检测血清中心肌酶学改变,并观察心肌形态学改变(HE染色)。结果: 6-OHDA成功诱导心脏去交感神经,模型组可见左心室中TH和GAP-43明显降低。各药物组TH高于模型组,桂枝汤各组GAP-43高于模型组和弥可保组。注射6-OHDA后,模型组出现心肌损伤,血清心肌酶含量明显升高,HE染色示心肌组织形态学异常改变。弥可保组和桂枝汤各组心肌损伤较轻,其中桂芍2∶1组和桂芍1∶1组交感神经损伤及心肌损伤最轻。结论: 去交感神经后在一定程度上可造成心肌损伤,桂枝汤(桂芍2∶1和1∶1)可有效减轻6-OHDA诱导的心脏去交感神经损伤及交感神经失支配后出现的心肌损伤。
桂枝汤; 交感神经损伤; 化学去交感神经; 心肌损伤; 6-羟基多巴胺
近年来,交感神经过度激活被广为关注,其所产生的不利影响,可以通过交感神经切除术或应用β受体阻滞剂得以减轻,其疗效在临床得到肯定。然而,关于交感神经损伤对心肌结构和功能影响的研究却相对较少。在糖尿病和心力衰竭晚期以及心肌梗死时梗死区局部心肌均存在心脏交感神经失支配现象[1-3]。因此防治心脏中交感神经损伤,维持正常的自主神经支配对于心脏病的预后有重要意义。
6-羟基多巴胺(6-hydroxydopamine,6-OHDA)可选择性破坏肾上腺素能神经末端,损伤或阻断肾上腺素能受体而造成特异性交感神经损伤,因此常被广泛用于化学去交感神经研究[4-5]。已有研究表明,完整的交感神经支配可提高清醒大鼠冠脉结扎后的生存率,而6-OHDA诱导的交感神经失支配后可使冠脉结扎大鼠死亡率增加[6]。我们既往的研究表明,桂枝汤可减轻心肌损伤,降低心肌胶原重构和心肌纤维化程度[7-8]。在糖尿病大鼠自主神经病变模型和4-甲基邻苯二酚诱导的心脏交感神经芽生模型中[9-10],桂枝汤可抑制交感神经芽生,维持心脏交感-迷走神经支配平衡。中医临床实践证明桂枝汤具有双向调节作用,因此我们推测桂枝汤在抑制交感神经芽生同时也会减轻交感神经损伤。为此,本研究以6-OHDA诱导大鼠心脏去交感神经模型,探索交感神经损伤后心肌组织的改变及桂枝汤对其保护作用。
材 料 和 方 法
1 实验试剂与药品
6-羟基多巴胺(Sigma);弥可保(methycobal;卫材药业有限公司);用于检测酪氨酸羟化酶(tyrosine hydroxylase,TH)、胆碱乙酰氨基转移酶(choline acetyl transferase,ChAT)、生长相关蛋白43(growth-associated protein 43,GAP-43)的ELISA试剂盒、兔抗大鼠TH I抗、山羊抗兔IgG II抗、5% BSA 牛血清白蛋白和DAB 显色试剂盒均由武汉博士德生物工程有限公司提供;SABC 试剂盒(北京中杉金桥)。
2 实验方法
2.1 实验动物及给药 Wistar大鼠54只,雄性,体重250~300 g,购自济宁鲁抗实验动物中心,许可证号为SCXK 鲁20080002。随机均分为6组:正常对照组、去交感神经组、弥可保组、桂枝汤2∶1组(桂芍2∶1组)、桂枝汤1∶2组(桂芍1∶2组)和桂枝汤1∶1组(桂芍1∶1组),各组9只。
弥可保配制为浓度0.03 g/L 的混悬液。桂枝汤组成药物购于山东省中医药大学附属医院,桂枝汤方组成为桂枝、白芍、炙甘草、生姜和大枣,分别按桂芍比例2∶1、1∶2和1∶1水煎煮,至终浓度为1.5 kg(生药)/L(山东中医药大学附属医院制剂室加工制作)。给药方式:弥可保组每天给予弥可保混悬液按0.15 mg/kg,桂枝汤1∶1 组按4 g/kg灌胃,桂枝汤2∶1组和桂枝汤1∶2组分别按5.5 g/kg灌胃。其余2组给予等量生理盐水灌胃。持续给药7 d后,去交感模型组、弥可保组和桂枝汤各组均腹腔注射6-OHDA(100 mg/kg 溶于0.1%维生素C 的生理盐水)制作去交感模型,正常对照组腹腔注射等量1% 维生素C的生理盐水,连续注射3d。造模期间继续上述药物灌胃。
2.2 标本的留取 注射3 d后,4%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉。腹腔抽取下腔静脉血3 mL,分离血清。由山东省中医院检验科生化室用Olympus AU 5400生化分析系统检测乳酸脱氢酶(lactate dehydrogenase,LDH)、天冬门氨酸氨基转移酶(aspartate aminotransferase,AST)、肌酸激酶(creatine kinase,CK)和心肌型肌酸激酶同工酶(MB isoenzyme of creatine kinase,CK-MB)含量。开胸取心脏,在冰上操作,在心脏后(左右心房)上1/3 处,成30°取整个心脏横截面,这个角度可以同时显示左右心房和心室,剪取左心室(矢状位均分为2 份)。剪取左心室一半组织,中性甲醛固定;另一半左心室,剪碎后加10倍PBS,T25 匀浆机(IKA)7 500 r/min,40 s匀浆2次,4 000 r/min离心10 min,留取上清液。
2.3 ELISA 10%左心室匀浆,ELISA法检测TH、ChAT和GAP-43的含量,严格按照试剂盒说明书进行操作,ELx808 酶标仪(BIO-TEK)测定450 nm 处的吸光度,根据标准曲线计算心肌中的TH、ChAT和GAP-43 含量。
2.4 HE染色 左心室进行石蜡包埋,常规切片,切片厚度4 μm,脱蜡,苏木素和伊红分别染色,并脱水封片。显微镜下观察,细胞核染成蓝紫色,细胞质染成淡红色或者红色。
2.5 免疫组化检测TH的表达 左心室进行石蜡包埋,常规切片,片厚4 μm,常规脱蜡至水,3%的H2O2室温10 min 消除内源性过氧化物酶,PBS 洗 5 min 3 次,微波修复抗原,5% BSA 室温封闭30 min,滴加兔抗大鼠TH I 抗(1∶100 倍稀释),湿盒内4 ℃过夜,PBS 洗5 min 5 次,滴加山羊抗兔IgG II抗,室温60 min,PBS 洗5 min 5 次,滴加试剂SABC,室温30 min,PBS 洗5 min 5次,DAB 显色,镜下控制显色,蒸馏水冲洗,苏木素复染,脱水,透明,中性树胶封片。以PBS 代替 I 抗作为阴性对照,以出现棕黄色颗粒沉积者判定为阳性部位。随机选取5 个视野用HPIAS-1000 高清晰度彩色病理图文分析系统(中国武汉同济医科大学千屏影像工程公司)进行半定量分析,以均值作为该样本TH的相对表达量。TH阳性面密度=阳性目标总面积/统计场总面积。
3 统计学处理
统计学处理采用SPSS 19.0进行。定量资料用均数±标准差(mean±SD)表示,在满足正态性分布的基础上进行单因素方差分析(one-way ANOVA),均数间两两比较采用LSD-t检验或Dunnett-t检验。定性资料采用Fisher确切概率法。
结 果
1 动物一般状况
除去死亡大鼠,共48只大鼠纳入实验,其中正常对照组9只,弥可保组为7只,其余4组均为8只。注射6-OHDA后,大鼠活动下降,精神萎靡,部分大鼠出现肉眼血尿。
2 左心室TH、ChAT和GAP-43含量的检测
如表1所示,模型对照组大鼠心肌匀浆中TH和GAP-43含量显著下降,分别降低25.00%和43.55%。弥可保组和桂枝汤各组的TH高于模型对照组(P<0.01)。桂芍1∶1组的TH高于弥可保组(P<0.01)。桂枝汤各组的GAP-43比模型对照组升高(P<0.01),且桂芍2∶1和桂芍1∶1组GAP-43高于弥可保组(P<0.05)。

表1 左心室TH、ChAT和GAP-43含量的比较
**P<0.01vsnormal group;△△P<0.01vsmodel group;▲P<0.05,▲▲P<0.01vsmethycobal group.

表2 各组大鼠血清心肌酶含量
*P<0.05,**P<0.01vsnormal group;△P<0.05,△△P<0.01vsmodel group; ▲P<0.05,▲▲P<0.01vsmethycobal group.
3 免疫组化
TH 是合成去甲肾上腺素的限速酶,可作为交感神经分布的标记物,同时可反应交感神经活性[11]。各组大鼠左心室TH免疫组化染色可见,与正常对照组相比,模型对照组大鼠左心室心肌中TH阳性明显减少(P<0.01),弥可保组和桂枝汤各组TH阳性密度高于模型对照组(P<0.01),且桂芍组1∶1组明显高于弥可保组(P<0.01),见图1。
4 各组大鼠血清心肌酶指标检测
注射6-OHDA后模型对照组大鼠血清中心肌酶AST、LDH、CK 和CK-MB均明显升高。弥可保组仅LDH 低于模型对照组(P<0.05)。桂枝汤组的AST、LDH、CK 和CK-MB均低于模型对照组(P<0.01)。与弥可保组比较,桂枝汤2∶1和1∶1组LDH 和CK-MB降低(P<0.05),且桂枝汤1∶1组AST和CK也低于弥可保组(P<0.01)。
5 左心室HE染色
正常对照组心肌纤维清晰,心肌排列规则,无心肌细胞变性坏死。模型对照组心肌细胞变性坏死,细胞间隙变宽,大面积心肌纤维结缔组织增生,纤维灶形成。弥可保组局部心肌变性坏死,细胞间隙变宽,间质纤维结缔组织增生,但轻于模型对照组。桂枝汤1∶2组心肌局灶性纤维结缔组织形成,桂枝汤2∶1组和桂枝汤1∶1组心肌细胞排列整齐,纤维结缔组织增生程度轻于模型对照组和弥可保组,其中桂芍1∶1组心肌纤维结缔组织增生程度最轻,见图2。
Figure 1.Immunohistochemical staining of TH positive nerve fibers in the heart (×400). A: normal group; B: model group; C: methycobal group; D: Guizhi decoction 2∶1 group; E: Guizhi decoction 1∶2 group; F: Guizhi decoction 1∶1 group. Mean±SD.n=7~9.**P<0.01vsnormal;△△P<0.01vsmodel;▲▲P<0.01vsmethycobal.
图1 免疫组化显示心肌中TH阳性神经纤维
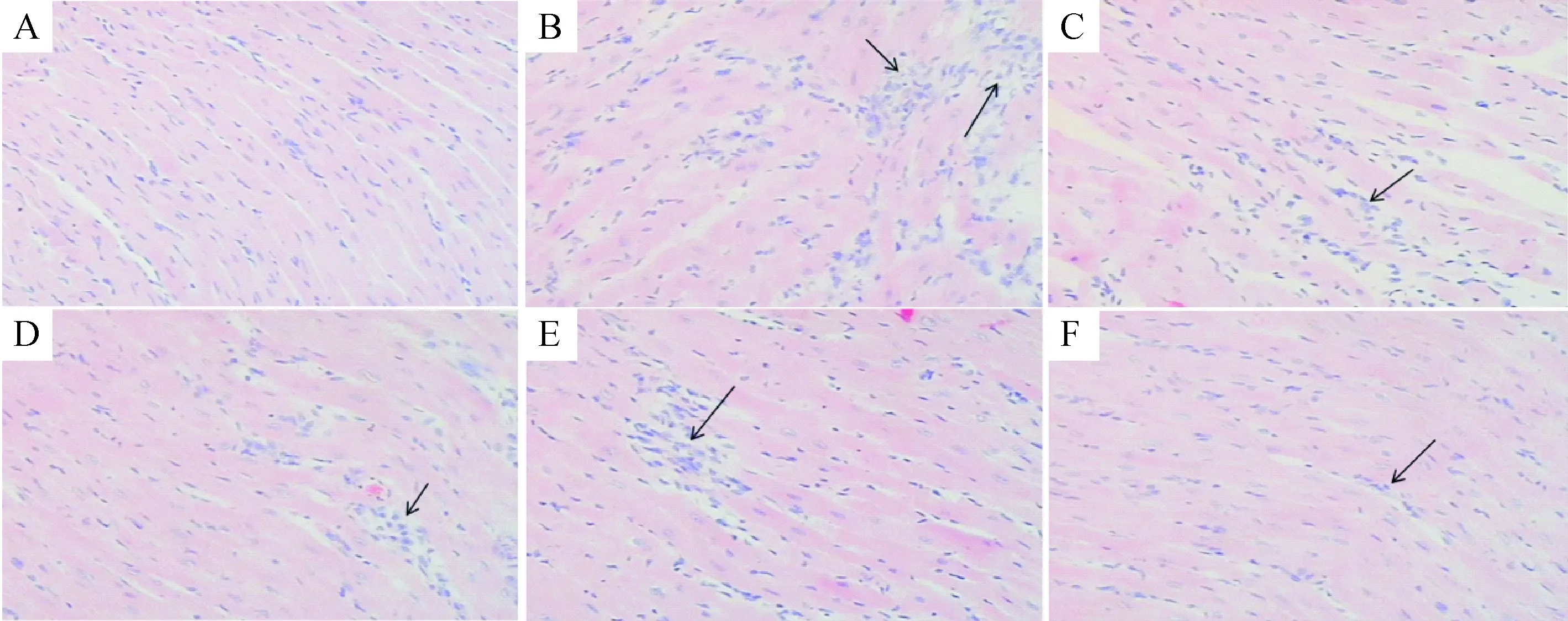
Figure 2.HE staining of myocardial tissues (×200). A: normal group; B: model group; C: methycobal group; D: Guizhi decoction 2∶1 group; E: Guizhi decoction 1∶2 group; F: Guizhi decoction 1∶1 group.
图2 心肌组织的HE染色
讨 论
桂枝汤出自《伤寒杂病论》,桂枝可温通心阳,芍药可养血敛阴,依据中医理论,桂枝汤中桂枝和白芍不同比例配伍其温阳或滋阴功效各有偏重。因此本研究中我们选用桂芍2∶1、1∶1和1∶2这3种临床常用配伍比例,研究不同桂芍配伍比例桂枝汤对自主神经损伤导致心脏中阴阳失衡的预防和治疗作用,探索桂枝汤针对心脏去交感神经损伤的最佳配伍比例。
6-OHDA是特异性交感神经损毁剂。本研究中,注射6-OHDA后大鼠左心室中TH分布密度和含量明显降低,而 ChAT没有明显变化,也验证了6-OHDA特异性损伤交感神经,对胆碱能神经无影响的特性。经弥可保和桂枝汤预灌胃大鼠的TH比模型对照组降低幅度减小,桂枝汤1∶1组和桂枝汤2∶1组TH分布高于弥可保组。GAP-43是神经发育和再生过程中与轴突生长有关的膜结合蛋白,参与轴突和突触形成,在生长的神经中GAP-43 表达增多[12-13]。 GAP-43表达增加可作为神经生长的标志[14]。本研究中,模型对照组GAP-43相比正常对照组明显降低,而桂枝汤各组GAP-43含量明显高于模型对照组,且桂枝汤2∶1组和桂枝汤1∶1组GAP-43高于弥可保组。因此,我们推测桂枝汤(桂芍2∶1和1∶1配伍时)具有显著的交感神经保护作用,其作用优于弥可保。
心肌酶谱的改变是心肌损伤的灵敏指标。 本研究发现模型对照组大鼠心肌损伤严重,心肌酶显著升高、心肌细胞变性坏死且出现心肌纤维化。在应用神经保护剂弥可保降低交感神经损伤程度后,心肌酶学和左心室形态学改变的程度也有所减轻,表明交感神经损伤与心肌损伤有关,交感神经损伤可在一定程度诱发或加重心肌损伤,保护交感神经可在一定程度上减轻神经失支配后的心肌损伤。与弥可保相比,桂枝汤桂芍1∶1和2∶1配伍预治疗可明显降低神经失支配后出现的心肌损伤,推测其对交感神经的保护作用是其减轻心肌组织损伤的原因之一。
我们认为在心脏疾病的治疗中除抑制亢进的交感神经外,还应该重视保护心脏交感神经,使心脏交感神经支配恢复到平衡点。我们之前研究证明桂枝汤原方可减轻4-甲基邻苯二酚诱导的心脏交感神经芽生[9]。而本研究显示桂枝汤可减轻6-OHDA造成的心脏去交感神经损伤。由心脏交感神经芽生和交感神经损毁2个模型可知,桂枝汤在减轻心脏交感神经芽生同时又可防治交感神经失支配,这符合中医理论中桂枝汤具有“调和营卫,平衡阴阳”的双向调节作用的特点。
[1] Machado CRS, Camargos ERS, Guerra LB, et al. Cardiac autonomic denervation in congestive heart failure: compa-rison of Chagas’ heart disease with other dilated cardio-myopathy[J]. Hum Pathol, 2000, 31(1):3-10.
[2] Hage G, Iskandrian AE. Cardiac autonomic denervation in diabetes mellitus[J]. Circ Cardiovasc Imaging, 2011, 4(2):79-81.
[3] Li W, Knowlton D, Van Winkle DM, et al. Infarction alters both the distribution and noradrenergic properties of cardiac sympathetic neurons[J]. Am J Physiol Heart Circ Physiol, 2004, 286(6):H2229-H2236.
[4] Kostrzewa RM, Jacobowitz D. Pharmacological actions of 6-hydroxydopamine[J]. Pharmacol Rew, 1974, 26(3):199-288.
[6] Botting JH, Johnston KM, Macleod BA, et al. The effect of modification of sympathetic activity on responses to ligation of a coronary artery in the conscious rat[J]. Br J Pharmacol, 1983, 79(1):265-271.
[7] 姜 萍,李 晓,姜月华. 桂枝汤对自发性糖尿病大鼠炎症因子及心肌损伤的影响[J]. 中国实验方剂学杂志, 2011, 16(13):116-119.
[8] 李 晓,姜 萍,徐云生,等. 桂枝汤对自发性糖尿病大鼠心肌胶原重构的影响[J]. 中华中医药杂志, 2009, 24(8):1068-1071.
[9] 李 晓,姜 萍,林海青,等. 桂枝汤对4-甲基邻苯二酚诱导心脏交感神经芽生的抑制作用[J]. 中国药理学通报, 2014, 30(9):1320-1325.
[10]李 晓,姜 萍,姜月华. 桂枝汤对糖尿病大鼠右心房自主神经重构的调节作用[J]. 中华中医药杂志,2014, 29(6):1991-1993.
[11]Burgi K, Cavalleri MT, Alves AS, et al. Tyrosine hydro-xylase immunoreactivity as indicator of sympathetic activity: simultaneous evaluation in different tissues of hypertensive rats[J]. Am J Physiol Regul Integr Comp Physiol,2011, 300(2): R264-R271.
[12]Mabe AM, Hoover DB. Remodeling of cardiac cholinergic innervation and control of heart rate in mice with streptozotocin-induced diabetes[J]. Auton Neurosci, 2011, 162(1-2):24-31.
[13]Tedeschi A, Nguyen T, Puttagunta R, et al. A p53-CBP/p300 transcription module is required for GAP-43 expression, axon outgrowth, and regeneration[J]. Cell Death Differ, 2008, 16(4):543-554.
[14]Chen PS, Chen LS, Cao JM, et al. Sympathetic nerve sprouting, electrical remodeling and the mechanisms of sudden cardiac death[J]. Cardiovasc Res, 2001, 50(2):409-416.
Preventive effect of Guizhi decoction on myocardial injury after chemical sympathectomy
JIANG Yue-hua1, MA Du-fang2, YANG Jin-long1, WANG Xue2, LIN Hai-qing1, CAO Xin-kun2, LI Xiao1
(1AffiliatedHospitalofShandongUniversityofTraditionalChineseMedicine,Jinan250011,China;2FirstClinicalMedicalCollege,ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China.E-mail:lixiao617@163.com)
AIM: To investigate the preventive effect of Guizhi decoction on myocardial injury after chemical sympathectomy induced by 6-hydroxydopamine (6-OHDA). METHODS: Wistar rats (n=54) were randomly divided into 6 groups. Methycobal and Guizhi decoction (with different proportions betweenRamulusCinnamomiandRadixpaeoniaeAlba at 2∶1, 1∶2 or 1∶1) were pre-administered to the rats. Immunohistochemical method was used to observe the cardiac sympathetic nerve distribution. The contents of tyrosine hydroxylase (TH), choline acetylaminotransferase (ChAT) and growth-associated protein 43 (GAP-43) in the left ventricle were measured by ELISA. The serum levels of myocardial enzymes and morphology of myocardial tissues were also observed. RESULTS: 6-OHDA successfully induced cardiac sympathetic denervation as the contents of TH and GAP-43 in the left ventricle declined significantly. Compared with model group, the content of TH was elevated in both methycobal group and Guizhi decoction groups, while the content of GAP-43 was elevated only in Guizhi decoction groups. The serum levels of myocardial enzymes and the histopathological changes of the cardiac tissues were deteriorated after injection of 6-OHDA, indicating that the myocardial injury was established. Methycobal and Guizhi decoction normalized the abnormal change. Guizhi decoctions at 2∶1 and 1∶1 showed the best efficacy. CONCLUSION: 6-OHDA- induced sympathetic denervation causes myocardial injury. Guizhi decoction with the proportions betweenRanulusCinnamomiandRadixpaeoniaeAlba at 2∶1 and 1∶1 effectively alleviate the myocardial injury after cardiac sympathetic denervation induced by 6-OHDA.
Guizhi decoction; Sympathetic injury; Chemical sympathectomy; Myocardial injury; 6-Hydroxydopamine
1000- 4718(2015)04- 0750- 05
2014- 11- 17
2015- 01- 16
国家自然科学基金资助项目(No. 81072962)
R363
A
10.3969/j.issn.1000- 4718.2015.04.031
△通讯作者 Tel: 0531-68616008; E-mail: lixiao617@163.com
