miR-26a-5p调控MCL-1在孕产妇子痫前期中表达的临床意义*
2015-04-17苟文丽赖彩琴鞠叶兰王晨虹
杨 莹, 苟文丽, 谷 寅, 程 黎, 赖彩琴, 鞠叶兰, 王晨虹△
(1广州医科大学深圳市妇幼保健院,广东 深圳 518000; 2西安交通大学医学院第一附属医院,陕西 西安 710000)
miR-26a-5p调控MCL-1在孕产妇子痫前期中表达的临床意义*
杨 莹1, 苟文丽2, 谷 寅1, 程 黎1, 赖彩琴1, 鞠叶兰1, 王晨虹1△
(1广州医科大学深圳市妇幼保健院,广东 深圳 518000;2西安交通大学医学院第一附属医院,陕西 西安 710000)
目的: 探讨microRNA-26a-5p(miR-26a-5p)调控髓细胞白血病因子1(myeloid cell leukemia -1,MCL-1)表达在孕产妇子痫前期发生发展中的临床意义。方法: 收集正常妊娠21例、妊娠期高血压孕产妇13例、轻度子痫前期15例和重度子痫前期26例共4组孕产妇血浆及胎盘组织,用real-time PCR分析其血浆及胎盘组织中miR-26a-5p及胎盘组织中MCL-1 mRNA的表达,Western blotting分析胎盘组织中MCL-1蛋白的表达,并分析其表达的临床意义。结果: 随着病情进展,miR-26a-5p在孕产妇血浆和胎盘中表达逐步增高(P<0.01),而其胎盘组织中MCL-1 mRNA的表达明显降低(P<0.01),二者呈明显负相关(P<0.01);胎盘组织中miR-26a-5p与MCL-1蛋白表达呈明显负相关(P<0.01)。孕产妇血浆及胎盘组织中miR-26a-5p表达上调与孕龄、孕妇血浆白蛋白水平及胎儿体重呈明显负相关,而与孕产妇血压和尿蛋白水平呈明显正相关(P<0.01),胎盘组织中MCL-1表达下调与此相反。结论: miR-26a-5p高表达通过下调MCL-1的表达参与子痫前期的发生与发展。
子痫前期; 微小RNA-26a-5p; 髓细胞白血病因子1
子痫前期(preeclampsia, PE)于妊娠20周后出现,以新发高血压和蛋白尿为特征,并导致全身多系统损害,是导致孕产妇及新生儿死亡的主要原因之一。在全世界范围内,PE发病率大约为5~8%[1],发病机制至今未明。但可以确定的是,胎盘功能异常在子痫前期的发生与发展中起重要作用[2]。研究发现,子痫前期孕产妇胎盘组织中存在特异性表达的microRNA,与胎盘组织细胞的凋亡和转录调控有关,相关microRNA在血液中表达稳定,易于检测[3-5]。Mayor等[6]比较了子痫前期与正常妊娠胎盘组织中差异表达的microRNA与其差异表达的靶基因,结果显示microRNA及其靶基因表达的变化均参与了子痫前期的发生。研究显示miR-26a在重度子痫前期孕妇胎盘及血清中表达明显上调[7-8],提示其可能参与了子痫前期的发生发展,而髓细胞白血病因子1(myeloid cell leukemia-1,MCL-1)可能是miR-26a所调控的靶基因[9-10]。然而,miR-26a与其靶基因在子痫前期发生发展中的作用机制研究报道甚少。本研究拟通过分析子痫前期孕产妇血清和胎盘中miR-26a-5p与其靶基因MCL-1的表达及相关性,为探索其在子痫前期发生发展中的作用提供理论依据。
材 料 和 方 法
1 患者资料、病理标本收集
收集深圳市妇幼保健院入院分娩的正常(normal)孕产妇21例,平均年龄(31.8±4.4)岁;妊娠期高血压(gestational hypertention,GH)孕产妇13例,平均年龄(30.4±3.6)岁;轻度子痫前期(mild preeclampsia,MPE)孕产妇15例,平均年龄(31.7±4.2)岁;重度子痫前期(severe preeclampsia,SPE)患者26例,平均年龄(30.8±4.0)岁。GH、MPE和SPE定义参考《妇产科学》第8版教材[11]。孕产妇患有原发性高血压病、心脏疾患、慢性肾脏病、肝炎、糖尿病、妊娠期感染性疾病或其它妊娠期并发症等不纳入本试验。留取入院时孕产妇血浆2 mL和分娩时胎盘组织30~50 g以备检测。统计其入院时孕妇年龄、孕龄、血压、24 h尿蛋白(正常组除外)、孕产次、血肌酐、白蛋白、血小板数量、孕妇体重、孕妇水肿状态、胎儿娩出时体重、多胎妊娠与否、胎儿性别等,分析各组上述指标的差异(表 1),并统计血清及胎盘组织中miR-26a-5p和MCL-1表达的相关性及与各临床指标的关系。
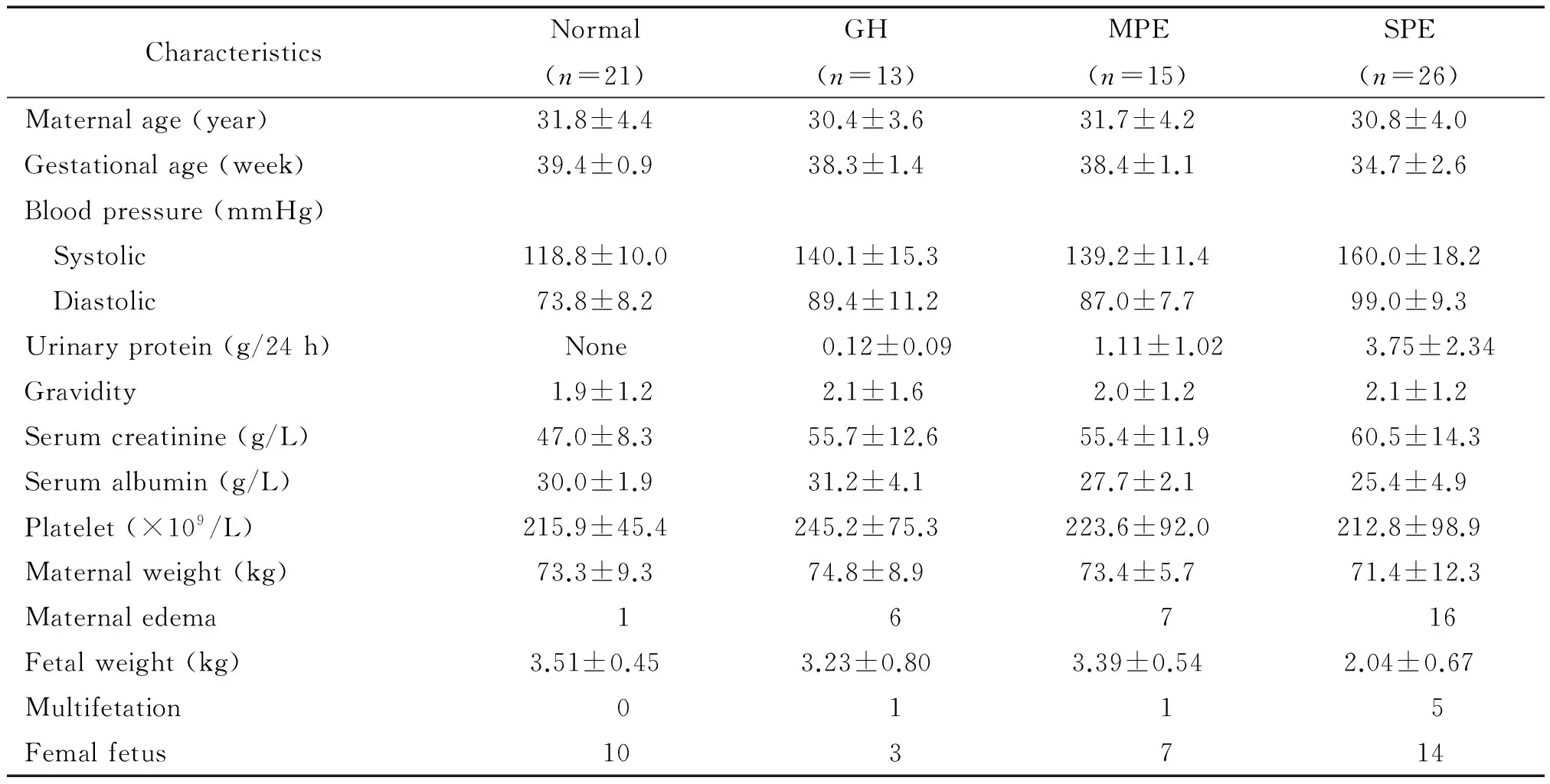
表1 4组孕产妇临床病理特征及分析
2 MicroRNA及mRNA提取及real-time PCR检测
血浆和胎盘组织总RNA提取采用TRIzol法(Invitrogen),参考试剂说明书进行操作。取1 μg总RNA,逆转录试剂盒Revert Aid First Strand cDNA Synthesis Kit(mRNA, Thermo Scientific)、Reverse Transcriptase M-MLV (RNase H)(microRNA, TaKaRa)合成cDNA,-20 ℃冰箱保存备用。miR-26a-5p的上游引物为5’-ATGGTTCGTGGGTTCAAGTAATCCAGGATAGGC-3’, 下游引物为5’-GCAGGGTCCGAGGTATTCG-3’;内参照U6的上游引物为:5’-CTCGCTTCGGCAGCACA-3’,下游引物为5’-AACGCTTCACGAATTTGCGT-3’;MCL-1的上游引物为5’-GCATCAGGAATGTGCTGCTGG-3’,下游引物为5’-GGTGGTGGTGGTGGTTGGTT-3’;内参照人18S rRNA 的上游引物为5’-CCTGGATACCGCAGCTAGGA-3’,下游引物为5’-GCGGCGCAATACGAATGCCCC-3’。用ABI-ViiA 7 Detection System荧光定量PCR仪行定量分析,对miR-26a-5p循环参数设为95 ℃ 30 s;95 ℃ 3 s,60 ℃ 34 s,共44个循环。对MCL-1循环参数为95 ℃ 30 s;95℃ 3 s,60 ℃ 34 s,共45个循环。以7500 Software 2.0.6进行扩增和熔解曲线分析。MCL-1及miR-26a-5p相对表达量分析参考文献使用2-ΔΔCt法计算[12]。
3 Western blotting 检测
MCL-1兔抗人多克隆抗体及兔抗人GAPDH抗体购自Cell Signaling。正常妊娠、妊娠高血压、轻度子痫前期、重度子痫前期孕产妇胎盘组织总蛋白提取参考KeyGene蛋白提取试剂盒说明书进行。12%的SDS-PAGE分离蛋白,并转印至PVDF膜(Millipore)。5%的脱脂牛奶封闭后,用兔抗- MCL-1抗体(1∶200)和兔抗-GAPDH抗体(1∶1 000)4 °C冰箱孵育过夜,次日用含0.1% 吐温-20的PBS(PBST)室温洗膜3~5次,每次5~10 min,然后用HRP交联的鼠抗兔II抗(1∶3 000)室温孵育1 h。再次以PBST洗膜3次后以ECL发光显色液显色,胶片夹内曝光显影,清洗胶片保存以备分析。
4 统计学处理
以SPSS 16.0软件进行数据统计分析,miR-26a-5p、MCL-1的表达及临床资料在不同组间比较采用单因素方差分析,率的比较采用卡方检验,两组间相关性比较采用Spearman秩相关分析,计量资料以均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结 果
1 孕产妇血浆及胎盘中miR-26a-5p的表达变化及胎盘组织中MCL-1的表达
妊娠期高血压、轻度子痫前期和重度子痫前期是妊娠期高血压疾病病情进展的不同阶段。通过比较SPE、MPE及GH孕产妇及正常孕产妇血浆及胎盘组织中miR-26a-5p表达变化发现,在SPE孕产妇血浆及胎盘组织中miR-26a-5p表达较MPE、GH及正常组明显升高,且随着病情进展,miR-26a-5p表达无论在血浆或胎盘中表达均呈明显上升趋势。而MCL-1 mRNA表达在SPE孕产妇胎盘组织中表达较MPE、GH及正常组明显下降,提示随着病情加重,胎盘组织中MCL-1 mRNA表达明显下降,见图1。

Figure 1.The miR-26a-5p expression in plasma/placentas and mRNA expression of MCL-1 in placentas of normal, GH, MPE and SPE pregnant women.
图1 miR-26a-5p在正常、妊娠高血压疾病、轻度子痫、重度子痫前期孕产妇血浆及胎盘组织中表达及MCL-1 mRNA在4组孕产妇胎盘组织中的表达
2 血浆及胎盘组织中miR-26a-5p表达变化及其与胎盘组织中MCL-1 mRNA表达变化的相关性分析
通过对比正常妊娠、GH、MPE和SPE 4组孕产妇血浆及胎盘组织中miR-26a-5p表达变化与胎盘组织中MCL-1 mRNA表达变化的相关性,结果发现,随着miR-26a-5p表达的增加,MCL-1 mRNA表达呈明显下降趋势,血浆中miR-26a-5p与胎盘组织中MCL-1 mRNA、胎盘组织中miR-26a-5p与MCL-1 mRNA表达呈明显负相关(P<0.01),提示随着血浆或胎盘组织中miR-26a-5p表达的增加,胎盘组织中MCL-1 mRNA的表达逐渐下降,表明在妊娠高血压疾病中,miR-26a-5p至少部分是通过影响MCL-1基因表达进而在妊娠高血压疾病的发生发展中起作用。而分析血浆及胎盘组织中miR-26a-5p表达变化结果显示两者呈明显正相关(P<0.01),提示检测血浆中miR-26a-5p表达的变化可以很好反映胎盘组织中miR-26a-5p表达量,见图2。
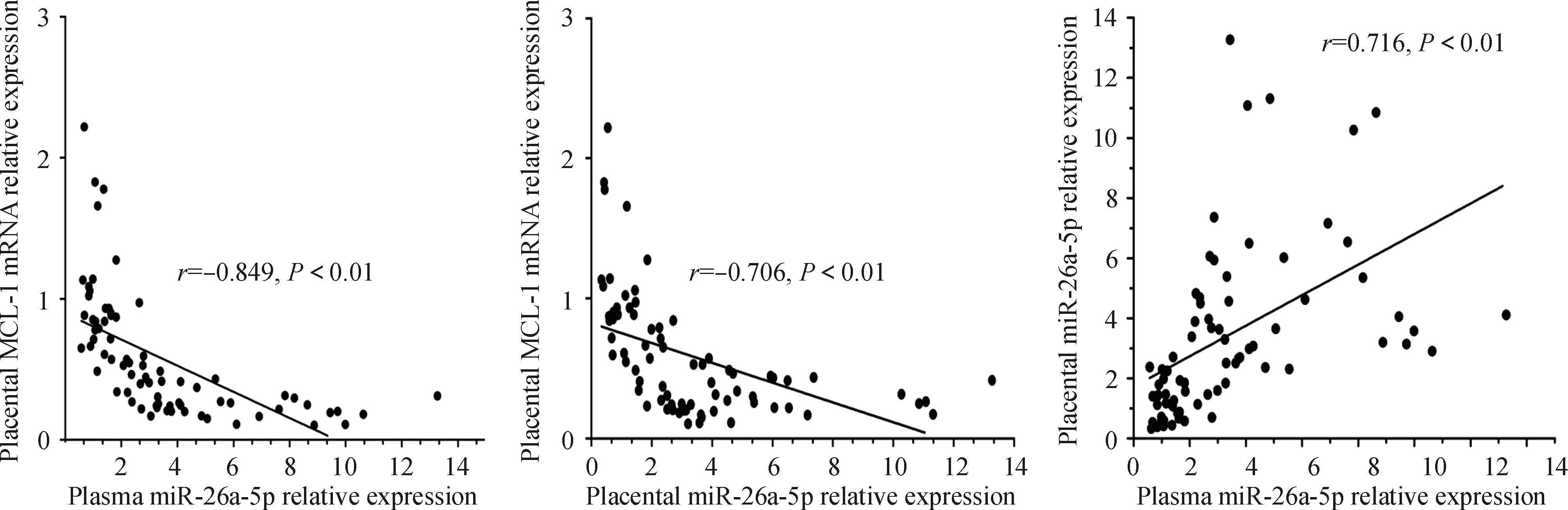
Figure 2.The correlation analysis between miR-26a-5p expression in plasma/placentas and MCL-1 mRNA expression in placentas, and the correlation analysis of miR-26a-5p expression between plasma and placentas.
图2 血浆及胎盘组织中miR-26a-5p与胎盘组织中MCL-1 mRNA表达的相关性,以及血浆与胎盘组织中miR-26a-5p表达的相关性分析
3 胎盘组织中miR-26a-5p、MCL-1 mRNA和蛋白表达及其相关性
各组随机选择5例患者进行血浆miR-26a-5p、胎盘组织miR-26a-5p、MCL-1 mRNA及蛋白表达量分析,结果发现,在normal、GH、MPE和SPE组,MCL-1蛋白表达呈明显下降趋势,提示随着病情进展,MCL-1蛋白表达明显下调;胎盘组织中miR-26a-5p表达与胎盘组织中MCL-1蛋白表达呈明显负相关,而MCL-1的mRNA和蛋白表达呈正相关。这表明miR-26a-5p通过抑制胎盘组织中MCL-1 的mRNA生成来抑制MCL-1蛋白的产生,并非诱导MCL-1 mRNA转录后翻译的抑制,进而促进了子痫前期的发生发展,见图3
4 血浆及胎盘组织中miR-26a-5p及胎盘组织中MCL-1的mRNA表达与其临床特征的相关性分析
我们分析了miR-26a-5p及MCL-1的mRNA表达变化与GH、MPE、SPE孕产妇孕龄、血压、尿蛋白量、白蛋白量及胎儿体重的相关性,结果显示,血浆及胎盘组织中miR-26a-5p的表达上调与孕产妇孕龄、白蛋白水平及胎儿体重呈明显负相关(P<0.01)。而孕产妇胎盘及血浆中miR-26a-5p表达变化与孕产妇收缩压、舒张压及尿蛋白水平呈明显正相关(P<0.01);在胎盘组织中,MCL-1 mRNA的表达下调与此相反,见表2。
讨 论
妊娠高血压疾病包括妊娠期高血压、子痫前期和子痫,其发病机制复杂,具体机制仍不清楚。近年来研究发现,PE胎盘组织与正常胎盘组织相比,存在一些特异性、差异表达的microRNA,提示microRNA表达的变化参与了子痫前期的发生与发展,丰富了我们对子痫前期发病机制的认识。我们通过比较正常妊娠、GH、MPE和SPE孕产妇血浆及胎盘组织中miR-26a-5p及其靶基因MCL-1表达的变化,表明随着病情进展,miR-26a-5p表达呈明显升高趋势,而MCL-1 mRNA及蛋白表达呈明显下降趋势,二者存在明显负相关。这提示miR-26a-5p可能通过调控胎盘组织中MCL-1基因的表达参与了子痫前期发生与发展的进程。
Choi等[8]比对正常和子痫前期孕产妇胎盘组织中microRNA表达时发现,miR-26a在SPE孕产妇胎盘组织中表达较正常平均升高2.75倍,表明其可能参与了子痫前期的发生发展。成熟的miR-26a包括其miR-26a-5p和miR-26a-3p成熟片段,我们研究发现,在GH、MPE和SPE孕产妇血浆和胎盘组织中,miR-26a-5p表达呈明显上升趋势,尤以SPE胎盘和血浆中表达升高明显,与Choi等[8]研究结果一致。我们比较了4组孕产妇胎盘组织和血浆中miR-26a-5p表达的相关性,结果显示二者呈明显正相关,提示血浆中microRNA表达可以很好地显示胎盘组织中相关microRNA表达的变化,同时也表明胎盘组织中microRNAs参与了妊娠期高血压疾病的全身性改变。那么,miR-26a-5p 调控哪些靶基因参与了子痫前期的发生和发展呢?Yang等[9]研究肝癌中miR-26a功能时发现,miR-26a在肝癌中表达下降,作为抑癌基因起作用,上调miR-26a能够明显抑制MCL-1基因表达。此外,miR-26a通过抑制MCL-1基因表达进而抑制乳腺癌细胞增殖和转移[10]。而MCL-1基因表达下调还与肿瘤细胞的凋亡有关[13]。而在妊娠高血压疾病中,随着病情进展,miR-26a-5p表达明显升高,与肿瘤性疾病表达相反。是否miR-26a表达上调够通过抑制MCL-1在妊娠高血压疾病中也发挥重要作用呢?我们发现,在妊娠高血压疾病孕产妇血浆及胎盘组织中,miR-26a-5p表达逐步升高,而胎盘MCL-1 mRNA及蛋白表达呈下降趋势,二者呈明显负相关,这就表明,miR-26a-5p高表达可能通过抑制MCL-1基因表达参与了妊娠高血压疾病的发生与发展。研究发现,MCL-1存在MCL-1S和MCL-1L可变剪切体,在子痫前期孕产妇胎盘组织中,依赖caspase-3/7凋亡蛋白酶剪切形成死亡抑制因子MCL-1S,并向死亡促进因子MCL-1S转变[14]。此外,低氧-复氧诱导胎盘绒毛膜细胞MCL-1L可变剪切体形成,能够阻断其凋亡。由于生理性低氧在胎盘滋养层细胞分化中发挥重要作用,而这种低氧可诱导抑制细胞死亡MCL-1L剪切体的形成,表明MCL-1在胎盘功能中发挥重要作用。Kalkat等[15]研究发现,MCL-1通过与BECN1蛋白相互作用抑制人胎盘滋养层细胞自噬的发生,过表达MCL-1能够减弱氧化应激所致自噬增加效应,由于自噬在胎盘生理性低氧过程中维持滋养层细胞生长发育、分化以及营养供给中起重要作用[16],因此,MCL-1表达的变化势必引起胎盘功能障碍,诱发胎盘相关性疾病的发生。

Figure 3.The protein expression MCL-1 in normal, GH, MPE and SPE pregnant women and its correlations with the expression of miR-26a-5p and MCL-1 mRNA.
图3 正常妊娠、妊娠期高血压、轻度子痫前期和重度子痫前期孕产妇胎盘组织中MCL-1蛋白表达及其与MCL-1 mRNA和miR-26a-5p表达的相关性分析
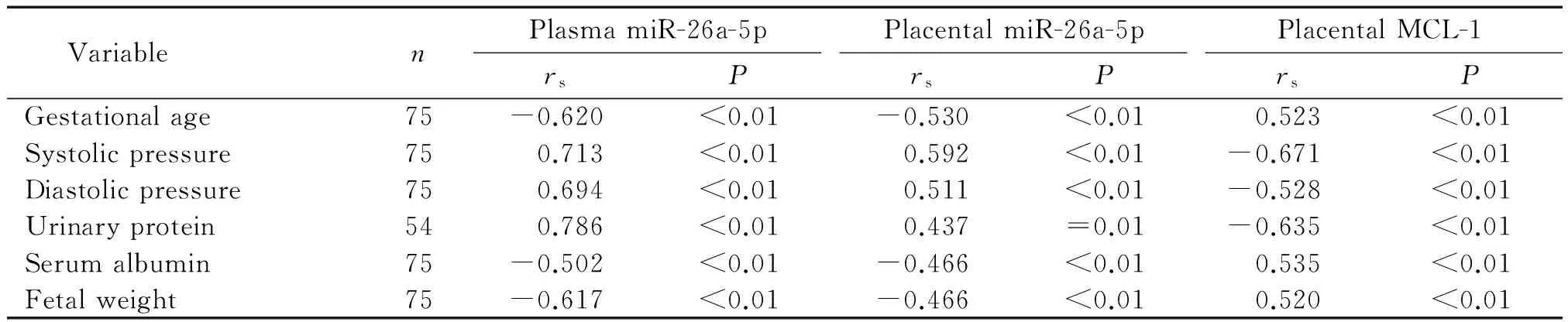
表2 血浆和胎盘组织中miR-26a-5p和胎盘组织中MCL-1 mRNA的表达变化与孕产妇临床特征的关系
此外,我们研究发现,miR-26a-5p高表达与育龄、孕产妇血清白蛋白、胎儿体重呈明显负相关,与孕产妇血压和蛋白尿呈明显正相关。研究发现,miR-26a在调控血管平滑肌细胞功能诸如细胞增殖、凋亡和表型转换中发挥关键作用[17],这就支持我们的结论,表明miR-26a-5p可能通过调控胎盘血管平滑肌细胞的功能,在子痫前期的发病中起作用。动物实验发现,mmu-miR-26a等足突细胞特异性microRNA功能缺失导致小鼠出生2周后发生显著蛋白尿,在出生后3周发生显著肾小球和肾小管损伤[18]。表明miR-26a表达变化参与了肾小球足突细胞重要的功能,在肾小球滤过屏障中发挥重要作用。我们研究显示,miR-26a-5p表达在子痫前期孕产妇胎盘和血浆中表达明显升高,而与孕产妇蛋白尿表达呈明显正相关,表明miR-26a-5p可能参与调控子痫前期孕产妇肾小球滤过膜的功能,进而导致蛋白尿增多,但需要进一步验证。
总之,在妊娠高血压疾病中,随着病情进展,miR-26a-5p表达明显增加,而胎盘组织中MCL-1 mRNA及蛋白表达明显下降,两者呈明显负相关。miR-26a-5p及MCL-1这一组合变化与孕产妇血压、低蛋白血症、蛋白尿等呈明显相关性,表明miR-26a-5p和MCL-1相互作用参与了妊娠高血压疾病的发生发展。
[1] Kanasaki K, Kalluri R. The biology of preeclampsia[J]. Kidney Int, 2009, 76(8):831-837.
[2] Enquobahrie DA, Abetew DF, Sorensen TK, et al. Placental microRNA expression in pregnancies complicated by preeclampsia[J]. Am J Obstet Gynecol, 2011, 204(2):178.e12-178.e21.
[3] Pineles BL, Romero R, Montenegro D, et al. Distinct subsets of microRNAs are expressed differentially in the human placentas of patients with preeclampsia[J]. Am J Obstet Gynecol, 2007, 196(3):261.e1-261.e6.
[4] Hu Y, Li P, Hao S, et al. Differential expression of microRNAs in the placentae of Chinese patients with severe pre-eclampsia[J]. Clin Chem Lab Med, 2009, 47(8): 923-929.
[5] Hromadnikova I, Kotlabová K, Jirásek JE, et al. Detection of placenta-specific microRNAs in maternal circulation[J]. Ceska Gynekol, 2010, 75(3): 252-256.
[6] Mayor-Lynn K, Toloubeydokhti T, Cruz AC, et al. Expression profile of microRNAs and mRNAs in human placentas from pregnancies complicated by preeclampsia and preterm labor[J]. Reprod Sci, 2011, 18(1):46-56.
[7] Wu L, Zhou H, Lin H, et al. Circulating microRNAs are elevated in plasma from severe preeclamptic pregnancies[J]. Reproduction, 2012, 143(3):389-397.
[8] Choi SY, Yun J, Lee OJ, et al. MicroRNA expression profiles in placenta with severe preeclampsia using a PNA-based microarray[J]. Placenta, 2013, 34(9): 799-804.
[9] Yang X, Liang L, Zhang XF, et al. MicroRNA-26a suppresses tumor growth and metastasis of human hepatocellular carcinoma by targeting interleukin-6-Stat3 pathway[J]. Hepatology, 2013, 58(1):158-170.
[10]Gao J, Li L, Wu M, et al. MiR-26a inhibits proliferation and migration of breast cancer through repression of MCL-1[J]. PLoS One, 2013, 8(6):e65138.
[11]苟文丽,杨慧霞. 妊娠期高血压疾病[M]// 谢 幸,苟文丽,林仲秋.妇产科学. 第8版. 北京:人民卫生出版社,2013:64-72.
[12]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods, 2001, 25(4): 402-408.
[13]朱惠明,李银鹏,候晓华,等. 凋亡素诱导肝癌细胞HepG2凋亡过程中Mcl-1 mRNA和蛋白水平的变化及其意义[J]. 中国病理生理杂志, 2009, 25(12):2353-2356.
[14]Soleymanlou N, Jurisicova A, Wu Y, et al. Hypoxic switch in mitochondrial myeloid cell leukemia factor-1/Mtd apoptotic rheostat contributes to human trophoblast cell death in preeclampsia[J]. Am J Pathol, 2007, 171(2):496-506.
[15]Kalkat M, Garcia J, Ebrahimi J, et al. Placental auto-phagy regulation by the BOK-MCL1 rheostat[J]. Auto-phagy, 2013, 9(12):2140-2153.
[16]Gong JS, Kim GJ. The role of autophagy in the placenta as a regulator of cell death[J]. Clin Exp Reprod Med, 2014, 41(3):97-107.
[17]Bai Y, Wang L, Sun L, et al. Circulating microRNA-26a: potential predictors and therapeutic targets for non-hypertensive intracerebral hemorrhage[J]. Med Hypotheses, 2011, 77(4):488-490.
[18]Ho J, Ng KH, Rosen S, et al. Podocyte-specific loss of functional microRNAs leads to rapid glomerular and tubular injury[J]. J Am Soc Nephrol, 2008, 19(11):2069-2075.
Clinical significance of miR-26a-5p-regulated MCL-1 expression in preeclampsia
YANG ying1, GOU Wen-li2, GU Yin1, CHENG Li1, LAI Cai-qin1, JU Ye-Lan1, WANG Chen-hong1
(1ShenzhenMaternalandChildHealthHospital,GuangzhouMedicalUniversity,Shenzhen518000,China;2TheFirstAffiliatedHospital,Xi’anJiaotongUniversityHealthScienceCenter,Xi’an710000,China.E-mail:szwangchenhong@vip.163.com)
AIM: To investigate the clinical significance of microRNA-26a-5p (miR-26a-5p)-regulated myeloid cell leukemia-1 (MCL-1) expression in the development of maternal preeclampsia. METHODS: Plasma and placental tissues were collected from 21 cases of normal pregnancy, 13 cases of maternal gestational hypertension, 15 cases of mild preeclampsia and 26 cases of severe preeclampsia. The levels of plasma and placental miR-26a-5p and placental MCL-1 mRNA were detected by real-time PCR. Western blotting analysis was used to determine the protein expression of placental MCL-1. The clinical significance of the above parameters was also analyzed. RESULTS: miR-26a-5p expression gradually increased(P<0.01) in the 4 groups of maternal plasma and placentas with the disease development, and the mRNA expression of MCL-1 was significantly reduced in the placentas (P<0.01), both showing a significant negative correlation (P<0.01). Meanwhile, the expression of miR-26a-5p and MCL-1 protein in the placental tissues was negatively correlated (P<0.01). The miR-26a-5p up-regulation in maternal plasma and placental tissues was negatively correlated with gestational age, maternal plasma albumin levels and fetal weight, while it was positively correlated with maternal blood pressure and urinary protein level (P<0.01), which was in contrary to the down-regulation of placental MCL-1. CONCLUSION: Up-regulation of miR-26a-5p is involved in the occurrence and development of preeclampsia by down-regulation of MCL-1.
Preeclampsia; MicroRNA-26a-5p; Myeloid cell leukemia-1
1000- 4718(2015)04- 0713- 06
2014- 11- 05
2014- 12- 30
深圳市科技研发资金项目(No. JCYJ20120821095458279)
R714.24+5
A
10.3969/j.issn.1000- 4718.2015.04.025
△通讯作者 Tel: 0755-82889999; E-mail: szwangchenhong@vip.163.com
