AMD3100 体内干预SDF-1/CXCR4 信号通路对关节软骨组织退变的影响
2015-04-15李建李彦林王鑫王国梁何川尤志敏黄赞
李建 李彦林 王鑫 王国梁 何川 尤志敏 黄赞
昆明医学院第一附属医院运动医学科(昆明650032)
近期研究表明基质细胞衍生因子-1 (stromal cell derived factor-1, SDF-1)在骨关节炎(OA)患者软骨退变的病理进程中起关键性作用[1-4]。 SDF-1 与软骨组织表面的CXCR4 受体结合, 能激活细胞外信号调节酶(Erk)及相关激酶(p38MAP kinase)的信号通路,从而诱导软骨组织基质金属蛋白酶MMP-1,3,9,13 的释放,这些因子皆能诱导关节软骨破坏[5-7]。我们前期采用AMD3100 进行体外实验, 证实AMD3100 体外阻断SDF-1/CXCR4 信号通路后可抑制人关节软骨组织分泌MMP-3,9,13 及减少II 型胶原蛋白、聚集蛋白聚糖的降解,达到延缓软骨退变的目的[8,9]。本研究进一步探讨AMD3100 于体内干预SDF-1/CXCR4 信号通路后延缓软骨组织退变的可行性。
1 材料与方法
1.1 主要试剂及仪器
Hartley 豚鼠(上海生旺实验动物养殖有限公司);AMD3100(Sigma 公司,美国);兔抗豚鼠IL-1 抗体、豚鼠抗TNF-α 多克隆抗体 (Abcom 公司);Alzet 微量泵(北京拜安吉科技有限公司); 病理切片机(Leica RM2135,德国);番红O ( Safranin O) (广州展晨);石蜡(上海华灵康复器械厂); 显微摄影系统 (徕卡Leica DM4000B,德国)。
1.2 方法
取6 月龄雄性Hartley 豚鼠36 只随机分成A、B、C 3 组, 每组12 只。 A 组为实验组: 每只背部皮下植入Alzet 微量泵,内含PBS 液稀释过的AMD3100,每天以180 μg/ml 的浓度泵入;B 组为实验对照组: 每只皮下植入Alzet 微量泵,内含PBS 液;C 组为空白对照组:不做任何处理。
常规饲养12 周后,采用戊巴比妥钠(30 mg/kg)腹腔注射处死所有Hartley 豚鼠后立即取下双膝关节软骨, 修剪成大小为3 mm × 3 mm × 1 mm 的软骨组织块,常规组织学检测,行HE 染色及番红染色。
采用Mankin 组织学评分以评价骨关节软骨的退变程度。 Mankin 评分是一种反映骨关节炎中软骨退变严重程度的方法,所得Mankin 评分分值越大,表明软骨退变程度越严重。正常软骨组织评分值为0 分,最高评分值为14 分。
采用免疫组化方法检测Hartley 豚鼠软骨组织中IL-1、TNF-α 的表达, 每张切片随机取10 个视野(200倍)进行图像分析。软骨细胞胞浆内出现棕黄色颗粒者为阳性表达。 用Image-Pro Plus 6.0 系统图像分析仪进行定量分析。
1.3 统计学分析
采用SPSS17.0 软件包进行统计学分析,计量资料用均数± 标准差表示,组间比较采用方差分析,两两比较采用LSD 检验, 检验水准α= 0.05,P <0.05 为有统计学意义。
2 结果
2.1 HE 染色结果
实验组关节软骨的基本结构(表层、移行层、深层和软骨基质钙化层)较清晰:表层有轻微增厚,软骨细胞排列较紧密, 细胞核染色比较均匀, 软骨面较为平整,细胞数目较多(图1a);而实验对照组与空白对照组可见表层细胞脱落,移形层细胞梭形改变,深层和钙化层细胞向外游离,软骨细胞排列无序,软骨面不平整,细胞核染色不均匀(图1b,1c)。表明实验组软骨退变不明显,实验对照组和空白对照组的软骨退变明显。

图1 各组组织学HE 染色观察(×50)
2.2 番红染色结果
实验组番红染色鲜红(图2a),而实验对照组和空白对照组番红染色较实验组淡 (番红染色将软骨蛋白多糖染成红色,胶原染成绿色),提示实验对照组和空白对照组蛋白多糖含量明显减少(图2b,2c)。表明实验组软骨退变不明显, 实验对照组和空白对照组软骨退变明显。
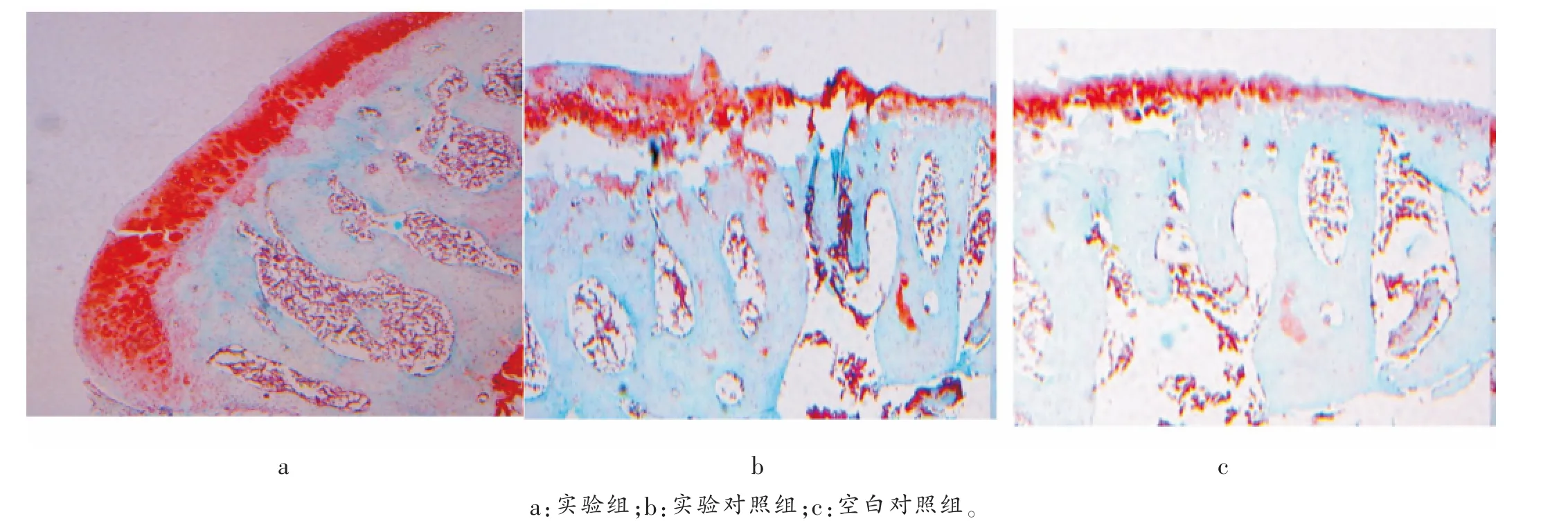
图2 各组番红染色组织学观察(×50)
2.3 Mankin 组织学评分
本实验各组软骨组织Mankin 组织学评分统计学分析结果表明: 实验组较实验对照组和空白对照组Mankin 组织学评分低,差异有统计学意义(P < 0.05),见表1,说明实验组软骨退变程度较实验对照组和空白对照组轻。

表1 各组软骨Mankin 组织学评分结果(各组均n = 12)
2.4 软骨组织内IL-1、TNF-α 的表达
免疫组化结果:实验组软骨细胞排列较整齐,阳性细胞表达较少(图3a,4a),而实验对照组及空白对照组软骨细胞排列不整齐,阳性细胞表达较多,并且可见明显的“背靠背”现象及血管侵入(图3b,3c;4b,4c),表明实验组较实验对照组和空白对照组的IL-1、TNF-α 表达量低,差异有统计学意义(P<0.05)。 见表2、图3、图4。
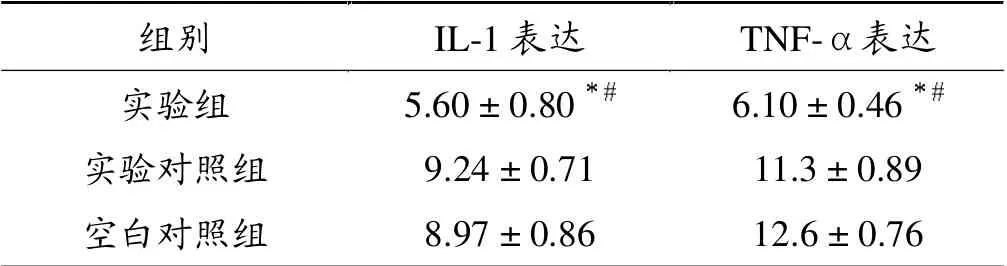
表2 各组软骨中IL-1、TNF-α 表达(各组均n = 12)
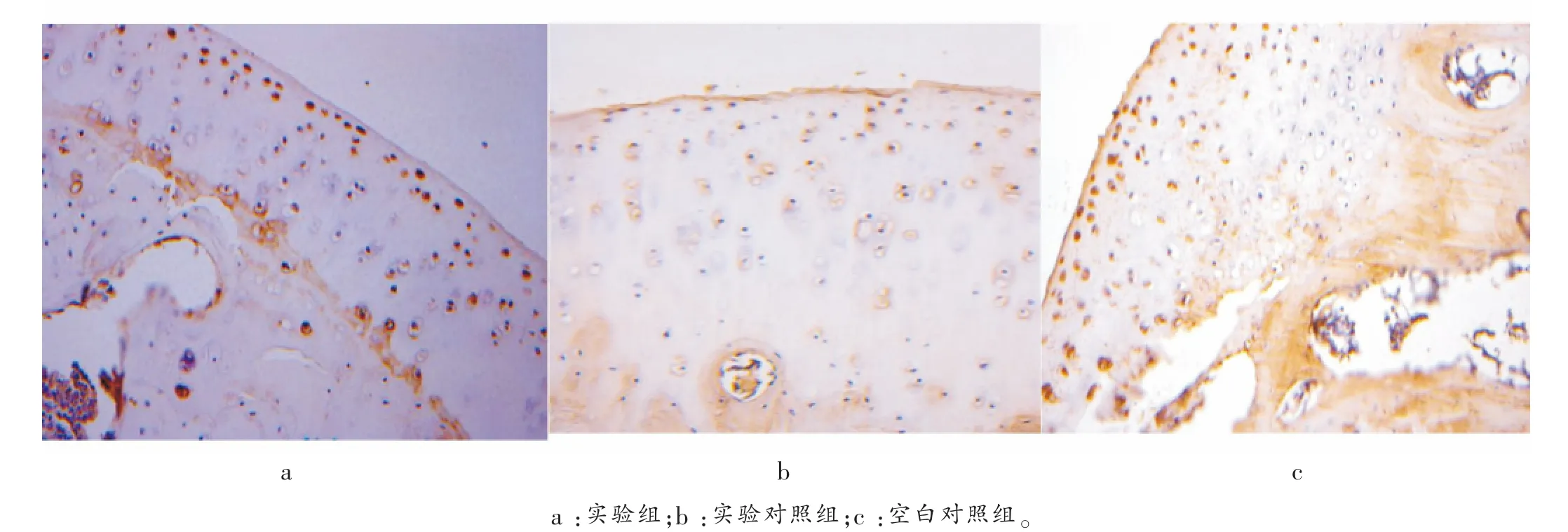
图3 各组免疫组织化学染色观察IL-1 的表达(×50)
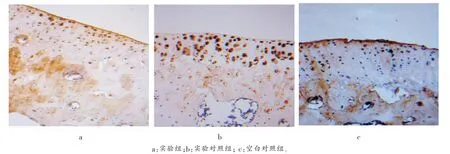
图4 各组免疫组织化学染色观察TNF-α 的表达(×50)
3 讨论
3.1 AMD3100 体内干预SDF-1/CXCR4 信号通路后对软骨组织退变的影响
我们前期采用OA 患者软骨进行体外研究发现,CXCR4 的特异性拮抗剂AMD3100 能与CXCR4 的第二胞外环状区结合,与其疏水基团的残基结合,能够特异性阻断CXCR4 与其配体SDF-1 的结合, 具有阻断SDF-1/CXCR4 信号通路的作用,从而抑制细胞外信号调节酶(Erk)及相关激酶(p38MAP kinase)的信号通路,减少基质金属蛋白酶3,9,13 的释放,其中基质金属蛋白酶3 是聚集蛋白聚糖的特异性降解酶, 且激活的基质金属蛋白酶3 还能使其他基质金属蛋白酶激活, 特别是激活基质金属蛋白酶9 后能进一步引起Ⅱ型胶原的降解, 基质金属蛋白酶9 在中性环境下具有降解变性Ⅰ、Ⅱ、Ⅲ型胶原的特异能力;基质金属蛋白酶13 是目前所知酶中最有效的Ⅱ型胶原降解酶。 由于基质金属蛋白酶3,9,13 的减少,使Ⅱ型胶原和聚集蛋白聚糖降解减少,从而延缓关节软骨组织退变[8,9]。
本实验体内给予AMD3100 后发现,实验组较实验对照组和空白对照组Mankin 组织学评分低,实验组软骨面较平整, 软骨细胞排列较紧密, 细胞核染色较均匀,细胞数目较多,基本结构较清晰,软骨蛋白多糖含量增多, 表明了实验组较实验对照组和空白对照组软骨退变轻, 进一步提示AMD3100 在体内可通过阻断SDF-1/CXCR4 信号通路, 抑制细胞外信号调节酶(Erk)及相关激酶(p38MAP kinase)的信号通路,减少基质金属蛋白酶3,9,13 的释放,使Ⅱ型胶原和聚集蛋白聚糖降解减少, 进而达到延缓关节软骨组织退变的目的。本实验也进一步说明SDF-1/CXCR4 信号通路可成为阻止关节软骨退变的靶点, 这将为OA 的靶向治疗提供实验依据。
3.2 AMD3100 体内干预SDF-1/CXCR4 信号通路对关节软骨内IL-1 和TNF-α 表达的影响
在正常情况下, 关节软骨基质的分解和合成代谢是通过分解性细胞因子和合成性细胞因子的平衡来维持的, 其中最重要的分解性细胞因子是IL-1、TNF-α,它们只有3%的同源性,IL-1 的生物活性比TNF-α 高100 倍,两者作用于不同的受体,但表现出许多相似的生物学特性,例如它们能诱导和激活磷脂酶A2,活化花生四烯酸代谢途径,促使PGE2 产生,加重关节炎症反应,增加破骨细胞的活性,抑制软骨细胞分裂和II 型前胶原mRNA 的表达、II 型胶原及蛋白多糖的合成,从而促进软骨吸收,造成OA 的发生[10,11]。 研究证实在OA患者的关节液中,IL-1、TNF-α 等细胞因子的表达水平明显升高, 其原因为IL-1、TNF-α 的基因转录启动区或增强子上均有核转录因子NF-κB 的结合位点,而NF-κB 是介导OA 软骨内环境中的细胞因子对MMPs表达调控最重要的转录因子,NF-κB 活化后可使宿主细胞IL-1、TNF-α 的基因转录增强, 使分解性细胞因子IL-1、TNF-α 的表达量升高[12],升高的IL-1、TNF-α通过刺激软骨细胞分泌MMP-1,3,9,13, 增加II 型胶原和聚集蛋白聚糖的剪切和降解,引起软骨基质降解,从而介导了OA 软骨的破坏[13-15]。
本实验发现实验组较实验对照组和空白对照组IL-1、TNF-α 表达量减少, 可能的原因为AMD3100 体内干预SDF-1/CXCR4 信号通路后致使实验组中软骨组织退变轻并引起IL-1、TNF-α 表达量减少, 进一步减少了软骨细胞分泌MMP-1,3,9,13, 减少II 型胶原和聚集蛋白聚糖的剪切和降解, 降低了软骨基质的分解代谢, 而AMD3100 具体如何通过SDF-1/CXCR4 信号通路使IL-1、TNF-α 在软骨组织中表达量减少有待于进一步探讨。
[1] Villalvilla A,Gomez R,Roman-Blas JA, et al. SDF-1signaling:a promising target in rheumatic diseases. Expert Opin Ther Targets,2014, 18(9):1077-1087.
[2] Wei F, Moore DC, Li Y, et al. Attenuation of osteoarthritis via blockade of the SDF-1/CXCR4 signaling pathway. Arthritis Res Ther,2012, 14(4):R177.
[3] Kanbe K, Takemura T, Takeuchi K, et al. Synovectomy reduces stromal-cell-derived factor-1 (SDF-1) which is involved in the destruction of cartilage in osteoarthritis and rheumatoid arthritis. J Bone Joint Surg Br, 2004, 86 (2):296-300.
[4] 李晓林,李彦林,马珂,等. SDF-1/CXCR4 信号通路在骨性关节炎病理进程中的作用. 中国组织工程研究与临床康复,2011, 15(15):2805-2808.
[5] Burrage PS, Mix KS,Brinckerhoff CE. Matrix metalloproteinases: role in arthritis. Front Biosci,2006,11:529-543.
[6] Chiu YC, Yang RS, Hsieh KH, et al. Stromal cell-derived factor-1 induces matrix metalloprotease-13 expression in human chondrocytes. Mol Pharmacol, 2007, 72(3):695-703.
[7] Masuko-Hongo K,Sato T,Nishioka K. Chemokines differentially induce matrix metalloproteinase-3 and prostaglandin E2 in human articular chondrocytes. Clin Exp Rheumatol,2005,23(1):57-62.
[8] 李彦林,王国梁,曹斌,等. 体外阻断基质细胞衍生因子1/CXC 趋化因子受体4 信号通路后人关节软骨组织Ⅱ型胶原和聚集蛋白聚糖的表达. 中国组织工程研究,2012,46:8607-8610.
[9] 李彦林,王国梁, 曹斌,等. AMD3100 体外阻断基质细胞衍生因子1/趋化因子受体4 信号通路对人关节软骨细胞分泌基质金属蛋白酶3、9、13 水平的影响. 中国修复重建外科杂志,2012,26(6):652-656.
[10] Kobayashi M,Squires GR,Mousa A,et al. Role of interleukin-1 and tumor necrosis factor alpha in matrix degradation of human osteoarthritic cartilage. Arthritis Rheum,2005,52(1):128-135.
[11] Wojdasiewicz P,Poniatowski A, Szukiewicz D. The role of inflammatory and anti-inflammatory cytokines in the pathogenesis of osteoarthritis. Mediators Inflamm,2014,2014:561459.
[12] Schmidt C,Peng B, Li Z, et al. Mechanisms of proinflammatory cytokine -induced biphasic NF -kappaB activation. Mol Cell,2003, 12(5):1287-1300.
[13] Shi J, Schmitt-Talbot E,DiMattia DA, et al. The differential effects of IL-1 and TNF-alpha on proinflammatory cytokine and matrix metalloproteinase expression in human chondrosarcoma cells. Inflamm Res,2004, 53(8):377-389.
[14] Calich AL,Domiciano DS,Fuller R. Osteoarthritis: can anticytokine therapy play a role in treatment. Clin Rheumatol,2010, 29(5):451-455.
[15] Dias CN, Vasilceac FA, Durigan JLQ, et al. Analysis of local and systemic TNF-α and IL1-α expression in the acute phase of knee osteoarthritis of rats. Cytokine, 2014, 66(2):164-165.
