不同强度耐力运动对大鼠心房Ⅰ型、Ⅲ胶原蛋白的影响及结缔组织生长因子的调节作用
2015-04-15王世强常芸马晓雯饶志坚
王世强 常芸 马晓雯 饶志坚
1 国家体育总局体育科学研究所(北京,100061)
2 上海体育学院
长期从事大强度与大运动量训练的运动员, 心房纤颤(房颤)的发生率明显高于其他项目运动员[1,2]。 耐力运动员心房纤颤的发生率在0.3%~12.8%之间[3]。过度增加的胶原蛋白会导致心房纤维化, 造成心房内折返形成和电信号传导异常, 成为诱导心房纤颤的病理基础[4]。 最近,发表在Nature Communications上的文章发现,6周的大强度游泳和跑台运动造成了小鼠心房纤维化,此为心房纤颤易感性增加的重要原因[5]。
心房纤维化是指心房中的胶原蛋白异常增加的现象。过度增加的胶原蛋白影响心肌细胞的电信号传导,促使心房纤颤发生与维持。 Ⅰ型胶原蛋白(collagen I,Col-I)和Ⅲ型胶原蛋白(collagen Ⅲ,Col-III)是心肌组织中主要的胶原蛋白:Col-I占85%,形成粗纤维,抗拉力性强;Col-III占11%,形成细纤维,抗张性强。 文献多报道运动对心室胶原蛋白的影响, 而少见不同强度的运动对心房胶原蛋白的影响[6]。结缔组织生长因子(connective tissue growth factor,CTGF) 可促进成纤维细胞的增殖,对胶原蛋白的合成和沉积具有正向调节作用, 参与了心房纤维化及心房结构重构进程[7]。不同强度运动对心房Col-I和Col-III表达的影响以及与CTGF的关系如何,尚未见相关文献报道。 本研究采用免疫荧光化学、RTPCR和Western Blot技术, 观察不同强度耐力运动后心房Col-I、Col-III和CTGF的变化, 探讨不同强度运动对心房胶原蛋白、CTGF表达的影响及其关系, 为进一步研究运动性心房纤颤的发生机制提供依据。
1 材料与方法
1.1 实验对象
8周龄SPF级健康雄性SD大鼠24只,体重为220 ± 8 g,购自北京维通利华实验动物技术有限公司,许可证号为SCXX(京)2012-0001。 所有大鼠均以啮齿类动物普通饲料喂养, 在国家体育总局体育科学研究所ABSL-3级动物房饲养, 室温为22 ± 2℃, 空气湿度为45% ± 5%,每天光照12小时。
1.2 分组和运动方案
适应性喂养3天后,所有大鼠进行一周适应性跑台训练,每天训练15 min,跑台速度为15 m/min、坡度为0°。 后随机分为安静组、中强度组和大强度组,每组8只。安静组普通饲料喂养至取材。中强度组和大强度组运动训练16周,每周运动5天,休息2天,一次运动持续1小时。 运动强度方案参照Bedford的研究[8],中强度组跑台速度为15.2 m/min、 坡度为5°(相当于58.4% ± 1.7%VO2max运动负荷强度); 大强度组跑台速度为28 m/min、 坡度为10°(相当于81.00% ± 3.5%VO2max运动负荷强度),且每次运动前,先以15 m/min速度跑5 min,随后在5 min内逐渐增至28 m/min。
1.3 取材
大鼠运动16周后24小时内进行取材。 迅速取出心脏,切取右心房,每块组织分为3份,其中一份以OCT包埋剂包埋用于做冰冻切片,另两份放入-80℃冰箱分别用于做RT-PCR和Western Blot。
1.4 RT-PCR检测CoI、CoⅢ和CTGF mRNA的表达
采用Trizol法提取总RNA, 每个样本按照2 μgRNA作为初始模板,配置20 μl的总反应体系,应用cDNA合成试剂盒(High Capacity RNA-to-cDNA Kit,美国ABI)在核酸扩增仪(Gene Amp PCR System 9700,美国ABI公司)中反转录成cDNA。 以合成的cDNA作为模板,以β-actin作为内参,配置20μl反应体系,每个样本检测3个复孔,在实时荧光定量PCR系统(7300,美国ABI)中进行扩增荧光定量,反应条件为:预变性95℃30 s,PCR反应95℃5 s,60℃31 s,40个循环。 荧光定量试剂盒为TaKaRa公司的RR820A。 根据收集的数据通过2-△△CT公式计算样本中mRNA的相对含量, 其中△△CT=(CT实验组目的基因-CT实验组内参基因)-(CT对照组目的基因-CT对照组内参基因)。 实验所需引物由上海生工生物合成(表1)。

表1 基因引物序列
1.5 免疫荧光检测Col-I、Col-Ⅲ的蛋白表达
冰冻切片入丙酮固定后PBS冲洗,山羊血清封闭30分钟,滴加一抗(兔抗Col-I、Col-III,1∶1000,购于美国Abcam公司)后4℃过夜,PBS冲洗后滴加FITC标记的二抗(1∶200,购于美国Abcam公司),PBS冲洗后甘油封片,200倍镜检。样本进行纵切,在相同拍摄条件下摄取,每个样本随机摄取4张图像, 采用Image-Pro Plus6.0图像分析软件对目标蛋白荧光强度进行定量, 以阴性对照样本中的荧光强度作为参照, 荧光强度用积分光密度(integrated optical density,IOD)表示。
1.6 Western Blot法检测心房CTGF蛋白的表达
提取总蛋白后用BCA法测定并调整蛋白浓度一致,加入上样缓冲液沸水中10 min使蛋白变性。120V恒压SDS-PAGE电泳1 h后,200 mA恒流转膜1 h。 5%脱脂奶粉(购于美国BD公司)封闭1 h,一抗(兔抗鼠Anti-CTGF,稀释比例为1∶1000,购于美国Abcam公司)置于摇床4℃过夜。 TBST洗涤3次后,加HRP标记的二抗(1:5000,购于北京欣博盛公司),室温摇床孵育1h。TBST洗膜3次,滴加ECL化学发光试剂(购于美国Millipore),室温2 min,滤纸吸干后置于保鲜膜内封存,置于暗匣内,X光片曝光约1~5 min,显影液中显影2 min,定影数十秒,条带用Quantity One软件进行图像分析。 内参为βactin(购于美国Abcam公司),计算目的蛋白与内参蛋白条带的IOD。

图1 大鼠心房Col-I和Col-III的mRNA表达
1.7 统计学分析
所得数据用GraghPad Prism 6.0软件转换作图。 所有数据均用SPSS18.0进行分析处理,结果采用平均数±标准差表示,组间差异采用单因素方差分析。
2 结果
2.1 大鼠心房Col-I和Col-Ⅲ的mRNA表达
如图1A所示,16周中等强度和大强度运动都促进了大鼠心房Col-I mRNA的表达。 与安静组相比, 中强度组Col-I mRNA的表达增加了84%,而大强度组Col-I mRNA的表达升高了4.19倍(P<0.05)。
如图1B所示,16周大强度运动促进了大鼠心房Col-III mRNA的表达增加,较安静组增加7%,无显著性差异。 中强度组心房Col-III mRNA的表达较安静组降低了52%(P<0.01), 与大强度组相比具有显著性差异(P<0.01)。
2.2 大鼠心房Col-I和Col-Ⅲ的蛋白表达
免疫荧光结果如图2所示,Col-I和Col-III的阳性染色为绿色,主要在细胞间质中表达。 IOD统计分析显示(图3),两种强度运动都促进了Col-I的蛋白表达。 与安静组相比,中强度组Col-I的表达增加25%,无显著性差异,而大强度组增加2.33倍(P<0.01)。与安静组相比,大强度运动组Col-III的蛋白表达增加了68%(P<0.01),中强度组略减少11%,无显著性差异。 中强度组Col-III的表达也显著低于大强度组 (P<0.01)。 通过计算Col-I/Col-III的比值发现,与安静组相比,中强度组Col-I/Col-III的比值略增加,无显著性差异。 大强度组Col-I/Col-III的比值显著高于安静组和中强度组(P<0.01)。
2.3 大鼠心房CTGF的基因和蛋白表达
如图4A所示,中强度组和大强度组CTGF mRNA的表达均高于安静组。 其中, 与安静组相比, 中强度组CTGF mRNA的表达增加25%,无显著性差异;大强度组CTGF mRNA的表达增加37%(P<0.05)。
如图4B所示,与安静组相比,中强度组CTGF的蛋白表达略有降低, 无显著性差异。 大强度组大鼠心房CTGF蛋白表达显著高于对照组(P<0.05) 和中强度组(P<0.01),分别增加22%和30%。

图2 大鼠心房Col-I和Col-III免疫荧光染色结果(×200)
3 讨论
耐力项目运动员和从事过大强度与大运动量训练的运动员可出现严重的心律失常, 甚至发生运动性猝死,其中,心房纤颤和心房扑动的发生率较为显著[9,10]。约有0.3%~12.8%的运动员存在心房纤颤, 不同项目的运动员心房纤颤的发生率不同: 年轻耐力运动员心房纤颤的发生率较低,而45~65岁之间的耐力运动员心房纤颤的检出率较高[3]。 Elosua等[11]指出一生中总的运动时间累积超过1500小时,心房纤颤的易感性显著增加。Mystad等[12]对3545名越野滑雪运动员进行调查发现,12.5%的调查对象存在心房纤颤, 心房纤颤的发生率和累积运动时间成正相关。 最近,袁斗等[13]证实长期高强度的跑台运动训练可使兔心房内径增加, 房颤的诱发率增加。 长期反复大强度运动导致心肌炎症的持续存在和累积损伤,诱发心肌纤维化,可能是运动性心律失常发生的重要病理机制。 Guasch等[14]研究发现,16周每天进行1小时大强度跑台训练,大鼠心房纤颤的易感性较安静组显著增加(64% vs 15%);天狼星红染色发现心房纤维化程度增加了60%, 显著高于安静组。 Aschar-Sobbi等[5]研究证实,6周的大强度游泳和跑台运动造成了小鼠心房纤维化,心房纤颤的易感性增加,而心室则未发生纤维化。

图3 大鼠心房Col-I、Col-III的蛋白表达及其比值
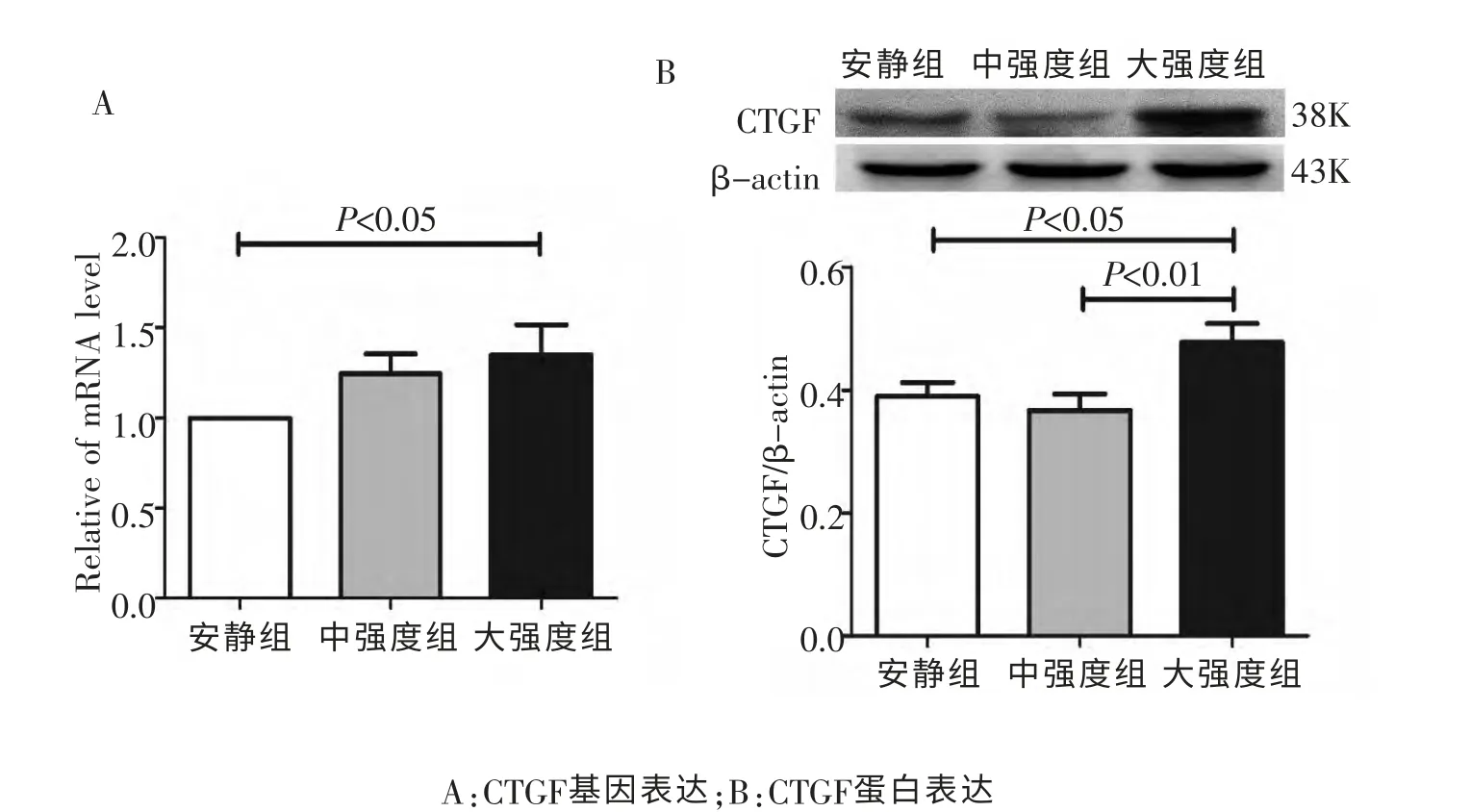
图4 大鼠心房CTGF mRNA和蛋白表达
Spach等[15]研究证实,心房纤颤的发生随心房纤维化程度的增加而增加, 表明心房纤维化是心房纤颤发生和维持的重要因素之一。 我们前期实验通过天狼星红染色计算胶原容积分数, 结果发现12周和16周的大强度运动造成了大鼠心房纤维化形成[16]。 心房纤颤病人Col-I mRNA的表达显著增加,Col-I/Col-III的比值显著升高[17]。Lofsjogard[18]研究发现心脏衰竭伴随心房纤颤的病人I 型前胶原羧基端肽(PICP)显著升高,表明Col-I的合成增加与心房纤颤的发生和维持具有一定的相关性。 王友华等[19]研究发现证实有氧训练可适度促进大鼠心室胶原纤维增生, 而过度训练则导致心室胶原纤维过度增加。 本研究发现,16周大强度运动促进了大鼠心房Col-I和Col-III mRNA和蛋白的显著表达, 通过计算发现Col-I/Col-III蛋白的比值显著增加;16周的中等强度运动则促进了Col-I的表达,但无显著性差异。相比安静组,中强度组Col-III mRNA的表达显著降低,而Col-III蛋白无明显变化,Col-I/Col-III蛋白的比值略有降低,但无显著性差异。 与本研究结果一致,王友华等[20]研究发现长期疲劳训练造成大鼠房室结Col-I表达显著增加,Col-I/Col-III的比值升高。 据此推测,长期大强度运动造成过度增加的胶原蛋白可造成心房内电传导障碍,是诱发心房纤颤的重要机制。
心房纤颤和心肌纤维化的发生与CTGF有关[21]。CTGF是一种富含半胱氨酸的分泌肽,广泛存在于多种组织器官中,成纤维细胞、平滑肌细胞、血管内皮细胞均可分泌CTGF。CTGF参与调节多种组织器官纤维化的发生发展,是最重要的促纤维化因子之一,在调节胶原蛋白的合成过程中具有重要作用。 CTGF可能通过促进心肌纤维细胞增殖并促进其分化为心肌成纤维细胞,使ECM的合成增加,诱导心肌纤维化。 体内注射CTGF抑制剂8周后发现, 大鼠Ⅰ型胶原蛋白的表达显著减少,心肌纤维化程度降低[22]。CTGF是心房纤颤发生和维持的重要因素,Li等[7]证实慢性心房纤颤病人右心房伴随明显的间质纤维化,CTGF mRNA和蛋白的含量显著高于正常对照组,且与胶原容积分数(Collagen Vomume Fraction,CVF)正相关。Adam等[23]则指出,心房纤颤病人左心房伴随间质纤维化,同时存在CTGF的高表达。 动物研究证实,采用siRNA干扰抑制CTGF后,胶原蛋白的含量显著降低,小鼠心房纤维化的程度降低。 因此,有研究提出,可以将血清CTGF的水平作为心房纤颤程度和心房纤颤消融手术预后的标志物[24,25]。
本研究发现,16周大强度运动显著促进了大鼠心房CTGF mRNA和蛋白的表达。 中强度组CTGF mRNA的表达较安静组虽也有升高趋势, 但蛋白的表达具有降低趋势, 这可能是转录后经过基因调控和修饰的结果。CTGF的激活主要受血管紧张素II(AngII)的调节[26]。研究已经证实,AngII可以上调TGF-β1的和CTGF表达,同时CTGF还受TGF-β1的正向调控[27]。过度训练可造成心肌局部和循环中AngII的显著增加[28],使用抑制AngII的药物氯沙坦可缓解过度运动造成的心肌纤维化[6,29]。本研究结果16周大强度运动诱导Col-I、Col-III含量和Col-I/Col-III比值的增加的原因可能是,过度运动造成心肌AngII和TGF-β1高表达, 正向调控下游调控因子CTGF的表达,进而促进心肌组织中成纤维细胞增殖和胶原蛋白的分泌,诱导心房纤维化的形成,参与心房纤颤的形成和维持。
4 小结
(1) 长期中等强度运动对心房Col-I和Col-III的影响不显著,而长期大强度耐力运动导致大鼠心房Col-I、Col-III的蛋白表达和Col-I/Col-III的比值显著增加,提示过度表达的胶原蛋白可能是心房发生纤维化的重要病理改变。
(2)长期中等强度运动对心房CTGF的表达无明显影响,而长期大强度耐力运动可导致大鼠心房CTGF表达增加,这可能与Col-I、Col-III含量增加、Col-I/Col-III比例升高有关, 可能是运动性心房纤颤发生的重要机制之一。
[1] 常芸. 运动性心律失常研究现状与展望[J]. 中国运动医学杂志,2015,34(1):59-68.
[2] 常芸. 运动员心脏的医务监督[M]. 第一版. 北京:北京体育大学出版社,2010.
[3] Wernhart S,Halle M. Atrial fibrillation and long-term sports practice:epidemiology and mechanisms [J]. Clin Res Cardiol,2015,104(5):369-379.
[4] Krul SP,Berger WR,Smit NW,et al. Atrial fibrosis and conduction slowing in the left atrial appendage of patients undergoing thoracoscopic surgical pulmonary vein isolation for atrial fibrillation [J]. Circ Arrhythm Electrophysiol,2015,8(2):288-295.
[5] Aschar-Sobbi R,Izaddoustdar F,Korogyi AS,et al. Increased atrial arrhythmia susceptibility induced by intense endurance exercise in mice requires TNFα [J]. Nat Commun,2015,6:6018.
[6] Benito B,Gay-Jordi G,Serrano-Mollar A,et al. Cardiac arrhythmogenic remodeling in a rat model of long-term intensive exercise training[J]. Circulation,2011,123(1):13-22.
[7] Li Y,Jian Z,Yang ZY,et al. Increased expression of connective tissue growth factor and transforming growth factor-beta-1 in atrial myocardium of patients with chronic atrial fibrillation[J]. Cardiology,2013,124(4):233-240.
[8] Bedford TG,Tipton CM,Wilson NC,et al. Maximum oxygen consumption of rats and its changes with various experimental procedures [J]. J Appl Physiol Respir Environ Exerc Physiol,1979,47(6):1278-1283.
[9] Mont L,Elosua R,Brugada J. Endurance sport practice as a risk factor for atrial fibrillation and atrial flutter[J]. Europace,2009,11(1):11-17.
[10] Calvo N,Brugada J,Sitges M,et al. Atrial fibrillation and atrial flutter in athletes[J]. British journal of sports medicine,2012,46 Suppl 1:i37-43.
[11] Elosua R,Arquer A,Mont L,et al. Sport practice and the risk of lone atrial fibrillation:a case -control study [J]. Int J Cardiol,2006,108(3):332-337.
[12] Myrstad M,Nystad W,Graff-Iversen S,et al. Effect of years of endurance exercise on risk of atrial fibrillation and atrial flutter[J]. Am J Cardiol,2014,114(8):1229-1233.
[13] 袁斗,谭琛,姚建民,等. 运动性心房颤动兔模型的建立[J].中国循证心血管医学杂志,2015,7(1):94-96.
[14] Guasch E,Benito B,Qi X,et al. Atrial fibrillation promotion by endurance exercise:demonstration and mechanistic exploration in an animal model [J]. J Am Coll Cardiol,2013,62(1):68-77.
[15] Spach MS. Mounting evidence that fibrosis generates a major mechanism for atrial fibrillation [J]. Circ Res,2007,101(8):743-745.
[16] 王世强,常芸,马晓雯,等. 不同强度耐力运动对大鼠心肌胶原蛋白的影响及MMP-1/TIMP-1的调节作用[J]. 中国体育科技,2015(5):60-66.
[17] Zhang YJ,Ma N,Su F,et al. Increased TRPM6 expression in atrial fibrillation patients contribute to atrial fibrosis [J]. Exp Mol Pathol,2015,98(3):486-490.
[18] Lofsjogard J,Persson H,Diez J,et al. Atrial fibrillation and biomarkers of myocardial fibrosis in heart failure [J]. Scand Cardiovasc J,2014,48(5):299-303.
[19] 王友华, 田振军. 不同强度动训练对大鼠心室肌胶原纤维和Cx43,Cx45 影响的实验研究 [J]. 北京体育大学学报,2009(6):47-50.
[20] 王友华,田振军,凌风东. 运动训练对大鼠房室结Ⅰ型,Ⅲ型胶原纤维组织结构及MMP-13 表达的影响[J]. 中国运动医学杂志,2009,28(2):167-171.
[21] Lavall D,Selzer C,Schuster P,et al. The mineralocorticoid receptor promotes fibrotic remodeling in atrial fibrillation[J]. J Biol Chem,2014,289(10):6656-6668.
[22] Szabo Z,Magga J,Alakoski T,et al. Connective tissue growth factor inhibition attenuates left ventricular remodeling and dysfunction in pressure overload-induced heart failure[J].Hypertension,2014,63(6):1235-1240.
[23] Adam O,Theobald K,Lavall D,et al. Increased lysyl oxidase expression and collagen cross-linking during atrial fibrillation[J]. J Mol Cell Cardiol,2011,50(4):678-685.
[24] Song ZP,Liu X,Zhang DD. Connective tissue growth factor:a predictor of recurrence after catheter ablation in patients with nonparoxysmal atrial fibrillation [J]. Pacing Clin Electrophysiol,2014,37(5):630-637.
[25] Lin X,Wu N,Shi Y,et al. Association between transforming growth factor beta1 and atrial fibrillation in essential hypertensive patients [J]. Clin Exp Hypertens,2015,37(1):82-87.
[26] Rosin NL,Falkenham A,Sopel MJ,et al. Regulation and role of connective tissue growth factor in AngII -induced myocardial fibrosis[J]. Am J Pathol,2013,182(3):714-726.
[27] Kiryu M,Niwano S,Niwano H,et al. Angiotensin II-mediated up-regulation of connective tissue growth factor promotes atrial tissue fibrosis in the canine atrial fibrillation model[J].Europace,2012,14(8):1206-1214.
[28] 田振军. 过度训练对心肌间质胶原, 心肌舒缩性能和AngⅡ变化的研究[J]. 中国应用生理学杂志,2002,18(1):63-67.
[29] Gay -Jordi G,Guash E,Benito B,et al. Losartan prevents heart fibrosis induced by long-term intensive exercise in an animal model[J]. PloS one,2013,8(2):e55427.
