Ⅲ期NSCLC患者血浆中miR-21表达及其临床意义
2015-04-14吴稚晖李文灿陈崇伟李景和
吴稚晖,李文灿,陈崇伟,李景和
(1.株洲市中心医院胸外科,湖南 株洲 412000;2.中南大学湘雅医院,湖南 长沙 410000)
Ⅲ期NSCLC患者血浆中miR-21表达及其临床意义
吴稚晖1,李文灿1,陈崇伟1,李景和2
(1.株洲市中心医院胸外科,湖南 株洲 412000;2.中南大学湘雅医院,湖南 长沙 410000)
目的 探讨化疗前血浆中microRNA-21(miR-21)表达对Ⅲ期非小细胞肺癌(NSCLC)新辅助化疗疗效的影响以及对指导Ⅲ期肺癌患者临床治疗的意义。方法以80例确诊为Ⅲ期的NSCLC患者(病例组)和30例健康志愿者(对照组)为研究对象,病例组患者化疗前采取外周血标本,通过荧光定量PCR方法观察血浆中miR-21表达与正常对照组中的表达差异;两个周期铂类药物化疗后观察化疗前血浆中miR-21表达与其化疗疗效的关系。结果病例组患者血浆中miR-21表达水平显著高于正常对照组(P<0.01);病例组患者化疗前血浆中miR-21在(PD+SD)组的表达量高于(CR+PR)组(P<0.05)。结论血浆miR-21在Ⅲ期非小细胞肺癌中高表达,其表达水平与铂类药物化疗的疗效相关,提示非小细胞肺癌Ⅲ期患者化疗前血浆中miR-21表达检测可成为预测新辅助化疗敏感性指标,为指导Ⅲ期肺癌患者临床治疗方案,为个体化治疗提供新的思路。
Ⅲ期非小细胞肺癌;血浆miR-21;新辅助化疗
肺癌是我们国家最常见的十大恶性肿瘤之一,非小细胞肺癌(NSCLC)约占肺癌的80%。肺癌的首选治疗方法是手术切除,但大部分患者临床确诊时已经到了中晚期,已经不适合手术切除了。近年来对于中晚期肺癌患者采取新辅助化疗得到越来越多的关注,Ⅲ期NSCLC手术前采用新辅助化疗可以比较早的对肿瘤进行全身和局部控制,也可能使局部肿瘤降期从而增加手术完全切除的机会。通过分子生物学手段预测新辅助化疗疗效对指导临床治疗无疑具有重要意义。近几年来对有关miRNA的研究已成为肿瘤学诊断和治疗领域的新热点,其中microRNA-21 (miR-21)在多种肿瘤细胞中的表达均出现显著异常,miR-21抑制剂可使肿瘤细胞对放疗和化疗药物的反应敏感性增加[1-2]。本研究旨在研究化疗前Ⅲ期NSCLC患者血浆中miR-21表达与正常人群的差异,及其对进行铂类药物化疗的Ⅲ期NSCLC患者近期疗效的影响,以期指导临床治疗。
1 资料与方法
1.1 一般资料 收集2013年9月至2014年4月中南大学湘雅医院和株洲市中心医院胸外科80例Ⅲ期NSCLC患者(病例组),其中40例Ⅲa期,40例Ⅲb期,均经病理组织学确诊。经患者同意,80例患者均行新辅助化疗,手术前进行两个疗程的铂类药物新辅助化疗,化疗前采取外周血标本。两个周期化疗后进行CT或其他影象学检查对患者进行疗效评价,按照WHO推荐的实体瘤客观疗效评定标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。比较(CR+PR)和(SD+PD)两组化疗前血浆miR-21表达水平的差异,探讨miR-21与铂类药物化疗敏感性的相关性。另外收集30例健康志愿者的外周血标本作为对照组。根据化疗的疗效来确定其是否能进行手术切除。
1.2 方法
1.2.1 血液样本的处理 化疗前常规静脉抽取80例患者5 ml外周血,乙二胺四乙酸(EDTA)抗凝,在常温下4 h内处理。血标本在4℃下1 200×g离心10 min,用1.5 ml无RNase的离心管分装血浆和血细胞,置于EP管中,随即置于-80℃低温冰箱存放以备用。
1.2.2 血浆总RNA提取 每份血标本取400µl血浆移至新的EP管中,提取RNA前再次离心,4°C离心10 min。按mirVana PARIS试剂盒(Ambion,USA)说明书抽提总RNA。
1.2.3 血浆miR-21检测 首先按照上海吉玛制药技术有限公司Hairpin-itTM miRNAs qPCR QuantitationKit试剂盒说明进行逆转录反应。然后开展荧光定量PCR,对目的miRNAs使用一般通用的反转录条件进行转录。miR-21正向引物:5'-ACGTTGTGTAGCTTATCAGACTG-3';miR-21反向引物5'-AATGGTTGTTCTCCACACTCTC-3;反应条件要求为:3 min 94℃,94℃20 s,62℃40 s,循环40次,所有标本需要检测3次。本实验选取miRNA-16为内对照。
1.3 统计学方法 通过2-ΔΔCt计算各组间对应基因的表达差异,△Ct为miR-21的Ct值与内参miR-16的Ct值的差值。ΔCt(NSCLC)=CtmiR-21-CtmiR-16;ΔCt(正常对照)=CtmiR-21-CtmiR-16;ΔΔCt=ΔCt(NSCLC)-ΔCt(正常对照)Mean。统计学分析以2-ΔΔCt表示miR-21表达量,对血浆miR-21相对表达量进行log10正态性转换。用SPSS13.0统计软件进行处理。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 miR-21在病例组患者与正常对照组中的表达比较 Ⅲ期NSCLC患者的血浆miRNA水平显著高于正常对照组(P<0.01),见图1。
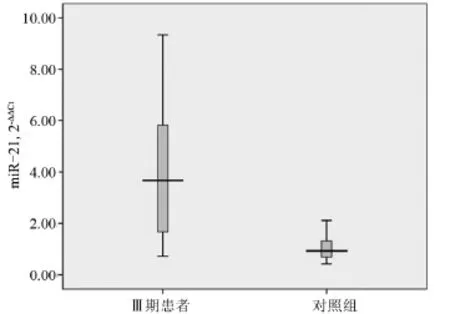
图1 Ⅲ期NSCLC患者与对照组血浆miR-21的表达
2.2 病例组患者化疗前血浆中miR-21与铂类药物化疗疗效的相关性 实时定量PCR结果分析显示,病例组患者化疗前血浆中miR-21在(PD+SD)组的表达量高于(CR+PR)组(P<0.05),见图2。结果提示Ⅲ期NSCLC患者化疗前血浆中miR-21的表达可能与Ⅲ期NSCLC患者对铂类药物的化疗敏感性相关。

图2 (CR+PR)组和(PD+SD)组血浆miR-21表达水平的差异
3 讨论
肺癌是我们国家常见的十大恶性肿瘤之一,尤其是这两年随着我们国家环境污染,雾霾天气在各地出现的频率越来越高,肺癌的发病率和死亡率越来越高。非小细胞肺癌(NSCLC)约占肺癌的80%,但由于我国目前肺癌诊断水平有限,70%~80%的患者确诊时已属中晚期。Ⅲ期NSCLC是指肿瘤没有发生远处转移,仅限于胸腔内的局部晚期肺癌。现在全世界有关Ⅲ期NSCLC肺癌的治疗问题仍存在比较多的争议。但近年来临床研究发现,Ⅲ期NSCLC肺癌绝大多数还是可以手术治疗的,其中相当部分患者术后可获长期生存,其外科手术治疗疗效明显优于内科保守治疗,因此对有条件的这类患者临床上还是要应力争手术治疗。
肿瘤的新辅助化疗也称术前化疗,是指在恶性肿瘤局部实施手术或放疗前应用的全身性化疗,在局部治疗前先以全身化疗为第一步治疗,目的在于控制原发病灶,争取手术治疗机会,并且可以抑制和杀灭隐性微转移灶,从而提高恶性肿瘤患者的远期生存率。临床上越来越多针对Ⅲa期NSCLC患者先采取新辅助化疗再进行手术,这已被NCCN列为标准治疗;而Ⅲb期NSCLC患者可以通过新辅助化疗后肿瘤降期以达到进行手术的目的。临床上新辅助化疗NSCLC首选为铂类药物。研究发现,新辅助化疗无效的患者生存期甚至低于直接手术者,因此新辅助化疗对化疗有效的患者才可能受益[3]。现在很多医院针对Ⅲ期NSCLC肺癌的治疗方案为,对化疗有效的患者有选择性的进行新辅助化疗,然后进行手术切除,以提高患者的生存率。若在新辅助化疗前通过一些基因检测预测新辅助化疗患者的预后及疗效,对实现Ⅲ期NSCLC患者的个体化治疗意义重大。
miRNA是一类进化上保守内源性非蛋白质编码的RNA分子,研究发现miR-21多种肿瘤组织中均呈过高表达[4-7]。近年来,多项研究表明在多种肿瘤中miR-21的表达与化疗药物的敏感性具有显著相关。Schetter等[8]研究发现结肠癌中miR-21高表达与治疗疗效不佳、预后差显著相关。Meng等[9]发现应用抗miR-21的AMOs(Anti-miRNA oligonucleotides)可增加胆管癌细胞对化疗药物敏感性;Li等[10]发现miR-21可用于提高恶性胶质瘤药物治疗的疗效;Hwang等[11]也在体内实验中证明反义抑制miR-21的表达可增强胰腺癌细胞对放化疗的敏感性。Gao等[12]研究观察到上调肺癌细胞A549中miR-21的表达能显著增加对顺铂的耐药性,国内研究[13]也发现miR-21在非小细胞肺癌(NSCLC)患者血浆中表达与NSCLC的TNM分期具有显著相关性,并血浆miR-21的表达可能与NSCLC铂类药物化疗敏感性相关。
我们的研究结果表明,血浆miR-21在Ⅲ期非小细胞肺癌中高表达,其表达水平与铂类药物化疗的效果有关,提示非小细胞肺癌Ⅲ期患者化疗前血浆中miR-21表达检测可成为预测新辅助化疗敏感性指标,为局部晚期非小细胞肺癌“个体化外科治疗”提供新的思路。
[1]Blower PE,Chung JH,Verducci JS,et al.MicroRNAs modulate the chemosensitivity of tumor cells[J].Mol Cancer Ther,2008,7(1): 1-9.
[2]Li Y,Zhao SG,Zhen YB,et al.AmiR-21 inhibitor enhances apoptosis and reduces G2-M accumulation induced by ionizing raduation in human glioblastoma U251cells[J].Brain Tumor Pathol,2011,28 (3):209-214.
[3]彭忠民,罗 静,王潍博,等.耐药相关基因表达对Ⅲ期非小细胞肺癌新辅助化疗的临床预测价值探讨[J].癌症,2005,23(8): 963-967.
[4]陆 晓,孙 婧,高 雯,等.非小细胞肺癌耐药细胞株A549/DDP中microRNA表达的初步研究[J].中华肿瘤防治杂志,2010,17 (9):659-663.
[5]Selcuklu SD,Donoghue MT,Spillane C.miR-21 as a key regulator of oncogenic processes[J].Biochem Soc Trans,2009,37(4): 918-925.
[6]钟 琦,房居高,黄志刚,等.喉鳞状细胞癌组织miRNA表达的初步研究[J].中华肿瘤防治杂志,2010,17(14):1073-1076.
[7]张保贵,刘炳亚,燕 敏.MiR-21与肿瘤的研究进展[J].国际外科学杂志,2011,38(4):262-267.
[8]Schetter AJ,Leung SY,Sohn JJ,et al.MiRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J].JAMA,2008,299(4):425-436.
[9]Meng F,Henson R,Lang M,et al.Involvement of human micro-RNA in growth and response to chemotherapy in human cholangiocarcinoma cell lines[J].Gastroenterology,2006,130(7): 2113-2129.
[10]Li Y,Li W,Yang Y,et al.MicoRNA-21 targets LRRFIP1 and contributes to VM-26 resistance in glioblastoma multiforme[J].Brain Res,2009,1286:13-18.
[11]Hwang JH,Voortman J,Giovannetti E,et al.Identification of microRNA-21 as a biomarker for chemoresistance and clinical outcome following adjuvant therapy in resectable pancreatic cancer[J]. PLoS One,2010,5(5):e10630.
[12]Gao W,Lu X,Liu L,et al.MiRNA-21:a biomarker predictive forplatinum-based adjuvant chemotherapy response in patients with non-small cell lung cancer[J].Cancer Biol Ther,2012,13(5): 330-340.
[13]魏 娟.血浆miRNA-21与非小细胞肺癌早期诊断及铂类药物敏感性的相关性研究[D].南京医科大学,2011.
Expression of plasma miR-21 in patients with NSCLC and its clinical significance.
WU Zhi-hui1,LI Wen-can1, CHEN Chong-wei1,LI Jing-he2.
1.Department of Thoracic Surgery,Zhuzhou Central Hospital,Zhuzhou 412000, Hunan,CHINA;2.Xiangya Hospital of Central South University,Changsha 410000,Hunan,CHINA
ObjectiveTo investigate the impact of the plasma miR-21 expression before chemotherapy on the curative effect of neoadjuvant chemotherapy for stageⅢnon small cell lung cancer(NSCLC),and its clinical significance as well.MethodsEighty patients with stageⅢNSCLC(case group)and 30 healthy volunteers(control group)were selected as research subjects.The peripheral blood of patients in case group were sampled before chemotherapy,and the miR-21 expression were observed by fluorescence quantitative PCR and then compared with the expression of control group.After 2 cycles of platinum drugs based chemotherapy,the correlation between the plasma miR-21 expression before chemotherapy and its chemotherapeutic effect were analyzed.ResultsThe expression of miR-21 in the plasma ofⅢNSCLC patients were significantly higher than those in control group(P<0.01).The plasma miR-21 expression before chemotherapy in(PD+SD)group was higher than that in(CR+PR)group(P<0.05).ConclusionThe plasma miR-21 expression is high in stageⅢ NSCLC,and its expression level is associated with the efficacy of platinum drugs based chemotherapy.Detection of plasma miR-21 expression in stageⅢNSCLC patients before chemotherapy may help predict the sensitivity of neoadjuvant chemotherapy,and then provide new ideas for clinical treatments.
StageⅢnon-small cell lung cancer;Plasma miR-21;Neoadjuvant chemotherapy
R734.2
A
1003—6350(2015)06—0803—03
10.3969/j.issn.1003-6350.2015.06.0288
2014-08-22)
株洲市2014年度医疗卫生领域指导性科技计划(编号:2014WY05)
吴稚晖。E-mail:530389278@qq.com
