战创伤性尿道狭窄动物模型的建立
2015-04-14王忠新洪宝发谭海颂
王忠新,洪宝发,谭海颂,李 钢
(1.中国人民解放军总医院海南分院泌尿外科,海南 三亚 572014;2.中国人民解放军总医院泌尿外科,北京 100853;3.中国人民解放军第309医院泌尿外科,北京 100091)
·论 著·
战创伤性尿道狭窄动物模型的建立
王忠新1,2,洪宝发2,谭海颂2,李 钢3
(1.中国人民解放军总医院海南分院泌尿外科,海南 三亚 572014;2.中国人民解放军总医院泌尿外科,北京 100853;3.中国人民解放军第309医院泌尿外科,北京 100091)
目的 应用自行设计的爆炸装置,建立战创伤性兔尿道狭窄动物模型,为战创伤性尿道狭窄的研究提供一种可靠、重复性强的动物模型。方法选取成年新西兰雄兔25只。模型组20只,分离阴茎与肛门间膜状皮肤连接,暴露球部尿道后,应用自行设计的定位爆炸装置,将定位爆炸装置前端圆孔对准并紧贴球部尿道。引爆装置,造成球部尿道半壁缺损,清创后6-0可吸收线纵向间断缝合尿道,逐层关闭切口。对照组5只,仅分离阴茎与肛门间皮肤连接。模型制作后第15天和第30天,实验组和对照组分别行尿道镜检查、逆行尿道造影和组织学检查评估模型构建效果。结果模型组95%(19/20)术后15 d尿道镜检查和逆行尿道造影均证实成功建立尿道狭窄模型。组织学检查提示狭窄段上皮细胞缺失,发生明显纤维化,尿道连续性被破坏。术后30 d尿道镜检查见狭窄处黏膜苍白、弹性消失,组织学检查见纤维化程度较15 d时有所加重。结论自行设计的定位爆炸装置,能有效建立战创性尿道狭窄动物模型,为战创伤性尿道狭窄救治研究奠定基础。
尿道狭窄;战创伤;动物模型
尿道狭窄是泌尿外科常见疾病,其可引起泌尿道感染、膀胱结石、败血症,最终甚至会导致肾功能衰竭,严重影响患者的生活质量。尿道狭窄相关的医疗花费非常庞大。2000年,美国男性尿道狭窄相关的医疗费用达1.91亿美元[1]。尿道狭窄分为前尿道狭窄和后尿道狭窄,两者不仅是狭窄的部位不同,其发病机制也不尽相同。一项单中心回顾性研究结果表明,大多数的尿道狭窄为前尿道狭窄,占92.2%,其中球部尿道狭窄占46.9%,阴茎部尿道占30.5%[2]。
目前治疗尿道狭窄的手段有尿道扩张、尿道内切开、尿道成形术等[3]。尿道内切开术总体长期成功率为20%~30%。尿道成形术目前被认为是处理尿道狭窄的最有效方法,其成功率为85%~90%[4],但其手术复杂,术后并发症及费用均较高。狭窄复发是尿道狭窄治疗面临的主要问题,就尿道内切开术而言,短于2 cm的狭窄术后1年复发率为40%,2~4 cm的狭窄术后1年复发率为50%,而长于4 cm的狭窄术后1年复发率高达80%[4]。因此,尽管尿道狭窄的治疗手段一直在进步,但尿道狭窄的治疗仍然是一个难题,因为目前缺乏一种有效的方法和修复材料来避免治疗后远期尿道狭窄的复发[5]。
如何成功构建一种具备战创伤性尿道狭窄特征性的动物模型,是进一步开展尿道狭窄治疗相关研究的前提。目前有关尿道狭窄动物模型建立及修复研究大多是基于内腔镜下建立尿道狭窄模型,未能有效模拟战创性尿道损伤的实际受伤机理,且模型构建成功率均较低。因此,本研究尝试探讨一种简单有效的构建尿道狭窄模型的方法,并通过影像学和组织学方法评估模型建立的有效性,期望为尿道狭窄的进一步研究提供一种标准化的动物模型。
1 材料与方法
1.1 模型动物选择 25只新西兰雄兔(体重3.5~4.0 kg)被随机分为模型组和正常对照组。动物麻醉采用肌肉注射盐酸氯胺酮(0.3 ml/kg)诱导,麻醉维持采用静脉给予戊巴比妥钠(0.3 ml/kg)。实验动物麻醉成功后,妥善固定四肢。会阴部皮肤备皮后,10%碘伏溶液消毒两遍。本研究所有动物实验程序均经解放军总医院海南分院动物伦理委员会论证通过。
1.2 自行设计定位爆炸装置模具 定位爆炸装置结构见图1。装置主要由一头端为一直径为6 mm左右圆形开口,尾端中心留有细孔的金属保护壳构成,其中头端圆形开口供放入爆炸物(炸药为普通鞭炮),主体头端圆形窗孔为爆炸后能量定向释放孔,并限定爆炸后尿道损伤部位和范围,尾端细孔供引线引出。

图1 爆炸装置实物图
1.3 动物模型制作过程 模型组20只新西兰雄兔,术前常规留置F8尿管,仔细分离阴茎与肛门间膜状组织结构,游离暴露球部尿道。将定位爆炸装置前端圆孔对准并紧贴球部尿道。引爆装置,造成球部尿道爆震伤,损伤区范围为直径5~10 mm的局限性半壁缺损,清理爆炸物遗留残渣,清除明显毁损尿道组织后以6-0可吸收线纵向间断缝合尿道,逐层关闭切口后,局部切口再次碘伏消毒,拔除尿管。术后1周内局部切口隔日给予碘伏冲洗消毒,预防切口感染。对照组仅切开肛门与阴茎间膜状组织结构,同法关闭切口及预防切口感染。
1.4 动物模型影像学评估 术后15 d和30 d分别进行影像学评估,包括尿道镜(Wolf.13F,5°)直视下观察受损处尿道情况和逆行尿道造影明确有无狭窄形成及狭窄的程度。逆行尿道造影过程如下:经尿道外口插入F8尿管,置管深度1 cm左右,推入造影剂(200 g/L泛影葡胺)行逆行尿道造影,显示尿道管腔情况。
1.5 组织学观察 术后15 d和30 d分别处死10只实验动物,完整取出狭窄段尿道组织以10%的甲醛液固定,梯度酒精脱水,在将透明后的组织块浸蜡包埋,切片后苏木精/伊红(HE)染色,行组织学评估。对照组实验动物在局麻下仅切开肛门与生殖器间皮肤,5-0可吸收线关闭伤口。在相同时间点行影像学评估,并取相应的球部尿道组织实施组织学检查。
2 结果
2.1 一般情况 动物模型制作过程平均用时9.8 min(8~12 min)。模型组实验动物均成功造成球部尿道范围0.5~1 cm毁损区,创面中心组织完全毁损,组织污浊,损伤区域边缘组织出现水肿及少量渗血(图2b)。尿道腔对侧尿道黏膜糜烂红肿。随访期间,未发生动物非预期死亡。所有模型动物建模后均自行排尿,未做任何形式尿液引流。模型组动物生殖器术后均明显红肿(图3a),模型动物的排尿状况均受到一定影响,起初排尿表现为尿滴沥,其中有12只模型动物伴有血尿,但随后均自行消失。1周后实验动物生殖器水肿基本消失,排尿状况较前有所改善(图3b),所有实验动物均未出现尿潴留征象,尿道损伤处未出现尿瘘。
2.2 动物模型影像学评估结果 对照组在术后15 d和30 d影像学检查均显示尿道黏膜光滑,管腔正常(图4a)。模型组19只实验动物(95%)在术后15 d尿道镜检查显示损伤处尿道内腔明显缩小,周径缩窄达50%以上,尿道腔内残存一些粗糙的点片状黏膜,散在细小出血点及坏死组织。逆行尿道造影显示损伤处尿道出现0.5~1 cm的狭窄段,管腔直径缩小50%以上(图4b)。所有模型动物均未见完全尿道闭塞。模型组动物按计划取材后其余动物术后30 d再次行影像学评估。尿道镜下可见剩余9只模型动物的球部尿道损伤区可见狭窄环,狭窄处尿道黏膜苍白、结构僵硬、弹性消失。其中模型组有1例动物随访期间一直未出现明显狭窄征象。
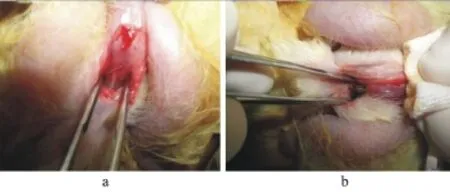
图2 模型制作过程
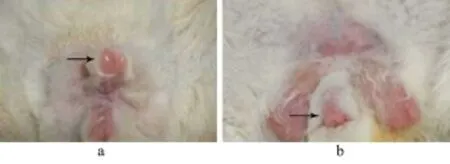
图3 术后观察
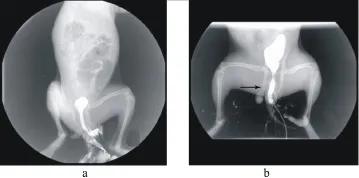
图4 逆行尿道造影
2.3 动物模型组织学评估结果 术后30 d,正常对照组5只实验动物HE染色均表现为尿道结构正常,尿路上皮细胞排列规则,平滑肌纤维分布规律(图5a)。术后15 d模型成功构建组,实验动物切片显示受损处尿道黏膜充血糜烂,局部黏膜脱落,未见正常尿路上皮细胞,增生的胶原纤维、结缔组织及炎症细胞浸润相当明显,偶可见少量凌乱的平滑肌细胞(图5b)。镜下还可见少许黑色颗粒样物质,可能为残留火药颗粒。模型失败组,实验动物切片显示损伤处尿道组织充血及炎症细胞浸润明显,但纤维化程度明显较轻,且范围局限。术后30 d,模型组明显狭窄者尿道组织学结果与前比较,出现明显的纤维化,正常尿道黏膜结构几乎完全消失,可见散在的淋巴细胞和异物巨噬细胞浸润(图5c、5d)。
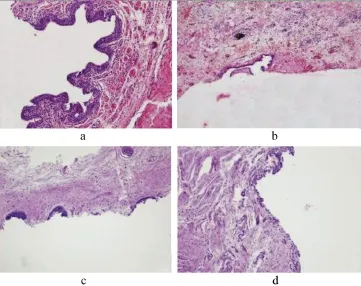
图5 尿道组织切片(HE×40)
3 讨论
尿道狭窄依据致病原因不同分为很多种,包括外伤性尿道狭窄,如骑跨伤或骨盆骨折;医源性尿道狭窄,例如导尿、腔内操作及尿道下裂手术等;感染或炎症性尿道狭窄,如淋病;先天性或自发性尿道狭窄[6]。医源性因素导致的尿道狭窄占自发性尿道狭窄的50%,占总尿道狭窄的30%[7]。就球部尿道狭窄而言,40%为自发性,35%为医源性,10%为炎症性,15%为外伤性[6]。
所有类型尿道狭窄的形成都是由于尿道上皮或尿道海绵体的损伤导致,前者的损伤最终会导致愈合过程中纤维化的发生。尿道狭窄的病理变化为正常的假复层柱状上皮被鳞状化生取代[8]。这种化生的组织容易被撕裂,从而引起尿外渗,进而导致海绵体的纤维化反应[9]。在组织刚损伤时,这种纤维化可能是无症状的,但随着时间的推移,这种纤维化过程会进一步缩窄尿道腔,从而导致梗阻性排尿症状。多数尿道狭窄伤者需要进一步外科治疗,但目前缺乏一种完全有效的治疗手段,严重影响了患者的生活质量。近年来应用组织工程技术修复重建尿道狭窄已成为研究的热点[10-11]。因此,本研究尝试应用自制的定位爆炸装置建立战创伤性尿道狭窄动物模型,为进行进一步的修复重建研究提供一种简单实用的动物模型。
球部尿道是发生前尿道狭窄最常见部位,占尿道狭窄患者近一半左右病例。因而本研究描述了一种通过在球部尿道处定位爆炸造成球部尿道狭窄的兔动物模型构建方法。实验结果表明,实验组术后有19只(95%)实验动物影像学检查可见典型尿道狭窄征象,逆行尿道造影可见长0.5~1.0 cm尿道狭窄段,尿道镜直视下可见狭窄处尿道腔缩小50%以上。Meria等[12]曾报道了一种在球部尿道通过环状电凝来建立兔尿道狭窄模型的方法,但只有50%的实验动物在术后1个月时形成尿道狭窄。既往研究表明,兔尿道具有很强的自我修复能力,这都得益于其尿道海绵体具有丰富的血供,从而导致兔尿道狭窄动物模型不易构建[13]。因为丰富的血流有利于将更多的组织创伤修复所需的生长因子运输到损伤局部,从而有利于自行修复[14]。本实验中爆炸装置对毁损区域尿道组织造成了包括热灼伤和气流冲击伤等复合损伤。既往研究经验也表明,电凝或小范围的锐性切割往往不能导致尿道狭窄形成。动物模型建立的最终目的是为了用于评价新的尿道狭窄的治疗方法,因此保证模型成功率是动物模型构建的首要目标。本研究中所采用的定位爆炸装置构建尿道狭窄动物模型,通过逆行尿道造影等影像学与组织学评估均证实了这种方法的有效性,模型构建成功率达95%。逆行尿道造影是公认的用于诊断尿道狭窄的手段,它可以明确尿道狭窄的部位、狭窄的长度和程度。
既往研究通过对比正常尿道组织和狭窄段尿道组织发现,尿道狭窄的主要病理变化特征发生在尿道海绵体组织的细胞外基质。正常的结缔组织被稠密的纤维及散在的成纤维细胞取代,Ⅲ型胶原和Ⅰ型胶原的比例下降[15]。同时,平滑肌细胞与胶原的比例也出现下降。这个现象在狭窄部位比狭窄段周围更加明显。前尿道狭窄通常继发于外伤或感染导致的海绵体纤维化。海绵体纤维化可能与一氧化氮合酶携带神经损伤或纤维结缔组织生长因子过表达有关[16]。在这个过程中,尿道海绵体发生纤维化,从而缩窄了尿道腔。如果纤维化程度更广泛,它也会影响到尿道海绵体外的组织。后尿道狭窄通畅由闭塞过程导致的后尿道纤维化过程引起,例如盆腔放射治疗导致的医源性损伤,或骨盆骨折导致的牵拉撕裂伤。这种后尿道狭窄更确切的应该是尿道的挛缩或闭塞,而不是真正的狭窄。本研究中组织学观察发现,模型动物受损处尿道组织出现了广泛纤维化,正常尿道壁组织被破坏,且这种组织学变化在模型建立1个月后并没有消失,这在组织学上与尿道狭窄组织学特征相似。很多因素会导致这种反应性纤维化,热损伤已被实验证实是导致泌尿道纤维化的主要因素[17]。本实验结果表明,爆炸毁损区域组织的热损伤等复合损伤,会造成局部尿道黏膜组织出现不同形式和程度的损伤,从而导致泌尿道屏障的不同程度的破坏,进而出现尿外渗,尿液渗入到损伤区域组织,进一步刺激尿道组织在修复过程中纤维化的发生。既往的实验研究已经证实尿外渗引起的创伤后尿道周围炎症反应是引起纤维化的重要因素。
既往报道的尿道狭窄动物模型构建方法都是通过经尿道途径,我们所描述的方法是基于尿道外损伤途径,这样更有效的模拟了创伤造成人尿道狭窄的受伤机理。本研究采用的定位爆炸法建立尿道狭窄的动物模型,经公认的标准方法包括尿道镜、逆行尿道造影影像学手段和组织学评估证实模型的成功构建,并且通过1个月的随访,证实模型的稳定性,有望为尿道狭窄的进一步研究提供一个可重复的标准化动物模型。
[1]Santucci RA,Joyce GF,Wise M.Male urethral stricture disease[J]. J Urol,2007,177(5):1667-1674.
[2]Palminteri E,Berdondini E,Verze P,et al.Contemporary urethral stricture characteristics in the developed world[J].Urology,2013, 81(1):191-196.
[3]Lee YJ,Kim SW.Current management of urethral stricture[J].Korean J Urol,2013,54(9):561-569.
[4]Hampson LA,McAninch JW,Breyer BN.Male urethral strictures and their management[J].Nat Rev Urol,2014,11(1):43-50.
[5]Tammela TL,Talja M.Biodegradable urethral stents[J].BJU Int, 2003,92(8):843-850.
[6]Mundy AR,Andrich DE.Urethral strictures[J].BJU Int,2011,107 (1):6-26.
[7]Lumen N,Hoebeke P,Willemsen P,et al.Etiology of urethral stricture disease in the 21stcentury[J].J Urol,2009,182(3):983-987.
[8]Chambers RM,Baitera B.The anatomy of the urethral stricture[J]. Br J Urol,1977,49(6):545-551.
[9]Singh M,Blandy JP.The pathology of urethral stricture[J].J Urol, 1976,115(6):673-676.
[10]Cui T,Terlecki R,Atala A.Tissue engineering in urethral reconstruction[J].Arch Esp Urol,2014,67(1):29-34.
[11]Li H,Xu Y,Xie H,et al.Epithelial-differentiated adipose-derived stem cells seeded bladder acellular matrix grafts for urethral reconstruction:an animal model[J].Tissue Eng Part A,2014,20(3-4): 774-784.
[12]Meria P,Anidjar M,Brouland JP,et al.An experimental model of bulbar urethral stricture in rabbits using endoscopic radio-frequency coagulation[J].Urology,1999,53(5):1054-1057.
[13]Choma TJ,Poppas DP,Presberg HJ,et al.CO2laser urethroplasty in the rabbit:a preclinical model[J].Lasers Surg Med,1992,12(6): 639-644.
[14]Steed DL.The role of growth factors in wound healing[J].Surg Clin NorthAm,1997,77(3):575-586.
[15]Baskin LSI,Constantinescu SC,Howard PS,et al.Biochemical characterization and quantitation of the collagenous components of urethral stricture tissue[J].J Urol,1993,150(2 Pt 2):642-647.
[16]Cavalcanti AG,Yucel S,Deng DY,et al.The distribution of neuronal and inducible nitric oxide synthase in urethral stricture formation[J].J Urol,2004,171(5):1943-1947.
[17]Anidjar M,Mongiat-Artus P,Brouland JP,et al.Thermal radiofrequency induced porcine ureteral stricture:a convenient endourologic model[J].J Urol,1999,161(1):298-303.
Construction of a traumatic urethral stricture animal model by self-designed bombing device.
WANG Zhong-xin1,2, HONG Bao-fa2,TAN Hai-song2,LI Gang3.
1.Department of Urology,Hainan Branch of Chinese PLA General Hospital, Sanya 572014,Hainan,CHINA;2.Department of Urology,Chinese PLA General Hospital,Beijing 100853,CHINA;3. Department of Urology,the 309thHospital of Chinese PLA,Beijing 100091,CHINA
ObjectiveTo establish a rabbit model of traumatic urethral stricture using a self-designed device,in order to provide a reliable and reproducible animal model for the study of traumatic urethral stricture.MethodsTwenty-five New Zealand male rabbits were used,which were divided into experiment group and control group.Of 20 rabbits in the experiment group,the skin between penis and anus was incised and the bulbar urethra was exposured.Then,half-circumferential defect of the bulbar urethral ventro-wall was made by the self-designed bombing device.Of 5 rabbits in the control group,only the skin between penis and anus was incised.Urethroscopy,retrograde urethrography and histological analysis were performed to evaluate the effect of the animal model made at 15 and 30 days in all groups.ResultsIn the experiment group,urethral stricture were confirmed by urethroscopy and retrograde urethrography in 95%(19/20)of the samples 15 days after surgery.Histological examinations showed the absence of epithelial cell in the stenosis segment,with obvious fibrosis.30 days after surgery,the urethroscopy showed the mucous membrane of the stenosis segment became pale,inelasticity.Histological examinations also showed more severe fibrosis.ConclusionAn animal model of traumatic urethral stricture can be successfully established by the self-designed device,which may provide some basis for the study of the treatment of traumatic urethral stricture.
Urethral stricture;Trauma;Animal model
R-332
A
1003—6350(2015)06—0781—04
10.3969/j.issn.1003-6350.2015.06.0281
2014-10-23)
军队临床高新技术重点项目(编号:413DG63J)
王忠新。E-mail:wangzx301@163.com
