铜胁迫对海菜花幼苗生理特征的影响
2015-04-13张志红范菲菲赵丽华
朱 健, 张志红, 范菲菲, 赵丽华
(1.贵州大学资源与环境工程学院,贵州 贵阳550025; 2.贵州省土壤肥料研究所,贵州 贵阳550006)
农业生产过程中使用的大量高铜杀菌剂、工业废水、矿山排水等多种原因导致水体中铜污染日益加剧。铜作为植物生长所必需的一种微量元素,人们对其营养功能已有较为完整的认识。但植物正常生长所需要的铜量很少,当过量铜被植物吸收后,会对植物产生毒害作用,抑制植物的生长发育甚至死亡[1-2]。
海菜花属于水鳖科,是中国特有三级重点保护高原淡水植物,其生长对水质要求很高,对水生生态系统具有重要的生态作用[3]。受水质恶化的影响,中国海菜花的分布急剧减少,而重金属对海菜花生理的影响还鲜见报道。因此,本研究模拟重金属铜对海菜花生长的生理影响,探讨铜对海菜花的毒性机制,以期为保护和恢复海菜花提供理论依据。
1 材料与方法
1.1 试验材料
供试海菜花幼苗采自贵州省贵阳市花溪区花溪河平桥段。各分析纯、生化纯试剂都用超纯水配制。
1.2 试验设计
将采集的海菜花幼苗用自来水、超纯水洗净,1/10浓度Hoagland 营养液驯养7 d。在1/10 浓度Hoagland 培养液中加入CuSO4,使添加外源Cu2+浓度分别为: 0、0.01 mg/L、0.05 mg/L、0.10 mg/L、0.20 mg/L、0.40 mg/L。选取长势一致的海菜花幼苗分别植入Cu2+溶液中进行胁迫处理。试验于温度20 ℃,相对湿度80%,光照14 h/d 的恒温温室中进行。每天添加适量的超纯水补偿损失水分,培养7 d 后测定相同叶龄叶片中叶绿素、类胡萝卜素、可溶性蛋白质以及叶片中Cu2+含量以及超氧化物歧化酶( SOD) 、过氧化物酶( POD) 和过氧化氢酶( CAT) 活性。3 次重复。
1.3 分析方法
1.3.1 叶绿素、类胡萝卜素含量测定 取处理幼苗相同叶龄相同部位叶0.5 g,以80%丙酮提取,用分光光度计测定663 nm、645 nm、470 nm 吸光度[4]。
1.3.2 SOD、POD、CAT 活性和可溶性蛋白质含量测定 取处理植株相同叶龄叶片,加入少量0.1 mol/L( pH=7.8) 的磷酸缓冲液,置冰浴研磨匀浆,离心(12 000 r/min,4 ℃,15 min) ,上清液用于酶活性与可溶性蛋白质含量的测定。SOD 活性测定采用NBT 光化还原法[4],POD 活性测定采用愈创木酚法[4],CAT 活性测定采用南京建成科技有限公司CAT 试剂盒测定。可溶性蛋白质含量测定采用考马斯亮蓝G-250 法[5]。
1.3.3 铜含量测定 将处理后的叶片自然风干,研磨,取0.05 g 样品加4 ml 硝酸、1 ml 高氯酸消解,1%硝酸定容至25 ml,电感耦合等离子体质谱测定Cu2+含量。
1.4 数据处理与分析
所得数据用SPSS13.0 进行统计分析,变化趋势图用origin7.0 绘制。
2 结果与分析
2.1 铜胁迫对海菜花幼苗叶片光合色素含量的影响
植物叶片光合色素含量与光合作用强度等因素密切相关,因此常用光合色素含量的高低来表征植物在逆境条件下受伤害的程度。由表1 可知,海菜花幼苗叶片中叶绿素a、叶绿素b、总叶绿素、类胡萝卜素随着Cu2+处理浓度的增加而逐渐降低,且均与对照差异显著( P <0.05) 。当溶液中Cu2+处理浓度达到0.4 mg/L时,海菜花幼苗的叶绿素a、叶绿素b、总叶绿素、类胡萝卜素分别比对照降低了36.7%、40.8%、37.9%、38.8%,叶片出现黄化现象。说明,高浓度的Cu2+降低了海菜花幼苗叶片中光合色素含量,减弱其光合作用强度,抑制海菜花幼苗的生长。
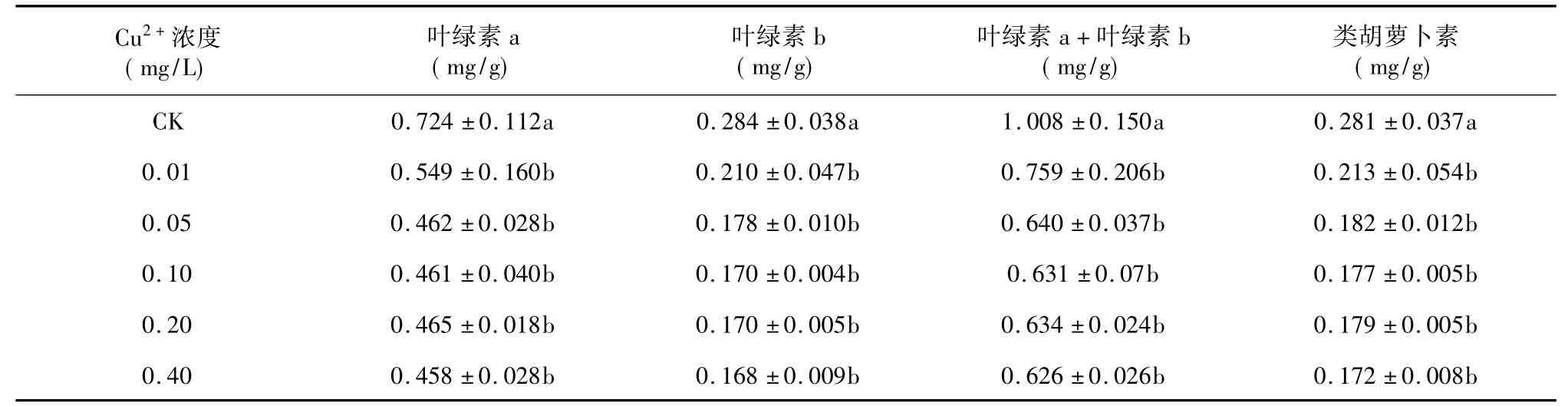
表1 Cu2+胁迫对海菜花幼苗叶片光合色素含量的影响Table 1 The contents of photosynthetic pigment of Ottelia acuminata affected by different concentrations of Cu2+
2.2 铜胁迫对海菜花幼苗抗氧化系统酶活性的影响
SOD 是植物保护系统中重要的酶之一,在消除氧化物自由基和减轻膜伤害方面起着重要作用[6]。由表2 可以看出,海菜花幼苗叶片中SOD 活性随Cu2+处理浓度的增加先升高后降低。在0.01 mg/L Cu2+处理时,SOD 活性最大,比对照提高74.8%,且与对照差异显著,超过此浓度,SOD 活性开始下降,在0.40 mg/L Cu2+处理时,达到最低,仅为对照组的16.7%,也与对照差异显著。
经Cu2+胁迫处理后,POD 活性的变化趋势与SOD 一致,随Cu2+处理浓度的升高呈现先上升后下降的趋势。Cu2+浓度为0.01 mg/L时,POD 活性达最大值,比对照高46.1%;超过此浓度POD 活性开始下降,在0.40 mg/L Cu2+时,为对照组的81.6%。
与Cu2+胁迫后SOD、POD 活性变化趋势不同,Cu2+胁迫对叶片中的CAT 活性具有明显的抑制效应。海菜花叶中CAT 活性随Cu2+处理浓度的升高而降低,各处理组均与对照组差异显著( P <0.05) 。当Cu2+处理浓度0.40 mg/L时,CAT 活性仅为对照组的58.0%。

表2 Cu2+对海菜花幼苗叶片抗氧化系统酶活性的影响Table 2 The activity of antioxidative enzyme of O. acuminata affected by different concentrations of Cu2+
2.3 铜胁迫对海菜花幼苗叶片可溶性蛋白质含量的影响
植物体内的可溶性蛋白质大多数是参与各种代谢活动的酶类,其含量是了解植物生理特征的一个重要指标。由图1 可知,海菜花幼苗叶片中可溶性蛋白质含量随Cu2+胁迫浓度的增大呈先增后降趋势,且均高于对照组,与对照差异显著( P <0.05) 。Cu2+浓度0.10 mg/L处理的可溶性蛋白质含量达到最高,比对照提高了85.3%。由此可见,铜胁迫处理后,海菜花幼苗叶片可能会产生某些抗性蛋白酶以抵御外界胁迫,减少Cu2+对植株的损伤。
2.4 铜胁迫对海菜花幼苗叶片富集铜的影响
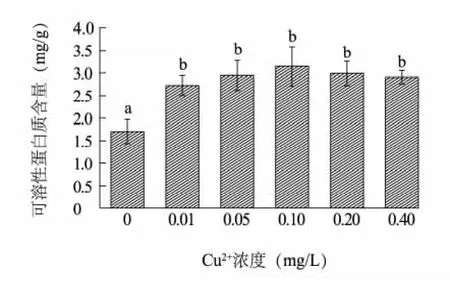
图1 Cu2+胁迫对海菜花幼苗叶片可溶性蛋白质含量的影响Fig.1 Protein contents affected by different concentrations of Cu2+
铜胁迫处理7 d 后,各处理组海菜花幼苗叶片中的Cu2+含量均高于对照组,且差异显著( P <0.05) ( 图2) 。Cu2+处理浓度0.20 mg/L时,海菜花幼苗叶片Cu2+含量达到最大值,为208.9mg/kg( 干质量) ,其含量是对照的13.66 倍。当Cu2+浓度为0.40 mg/L时,海菜花幼苗叶片中的Cu2+含量出现下降,但是叶片中的铜富集量较对照仍然很高,为对照的10.66 倍。

图2 Cu2+胁迫对海菜花幼苗叶富集Cu2+的影响Fig.2 Cu2+ accumulation in Ottelia acuminata leaves
3 讨论
植物叶片中的光合色素含量是反映植物光合作用强弱的重要指标,可以表征逆境胁迫因子对植物组织造成的影响[7-10]。本试验结果表明,Cu2+胁迫显著降低了海菜花幼苗叶片中叶绿素a、叶绿素b和类胡萝卜素含量,阻碍了叶绿素的合成,抑制海菜花幼苗的生长,这与Cu2+胁迫对多花黑麦草叶绿素的影响规律一致[11]。其原因可能是: 首先,高含量Cu2+抑制了PSⅡ的电子传递过程,减弱了光合作用强度[12],减少了叶绿素的合成;其次,Cu2+胁迫增加活性自由基的产生而氧化叶绿素,导致叶绿素含量的降低,最终引起光合速率的下降[13];再次,可能是海菜花幼苗摄入过量的Cu2+与叶绿素合成的某些酶( 原叶绿素酸酯还原酶、胆色素原脱氨酶、8-氨基乙酰丙酸合成酶) 的-SH 结合,改变了酶的构象,使酶失活,进而造成光合色素含量的下降[14]。
SOD、POD 和CAT 共同组成植物体内的抗氧化酶系统,能有效地消除氧自由基,维持细胞内固有的自由基代谢平衡[15]。随着Cu2+处理浓度的增加,SOD 和POD 活性都是先上升后下降,这与Cu2+胁迫后三叶草、狗牙根、双汇雀稗等叶片中SOD、POD酶活性变化规律一致[16]。而海菜花幼苗中CAT 活性与SOD、POD 酶活性变化规律不一样,整体表现出下降趋势。由此可见,低浓度Cu2+胁迫引起海菜花幼苗体内自由基的增加,激活了海菜花幼苗体内的SOD、POD 酶活性,而CAT 活性被抑制,歧化反应产生的H2O2不能有效的被CAT 清除,保护植物细胞抗氧化酶系统失衡,致使海菜花幼苗生理代谢紊乱,加速其细胞的衰亡,对海菜花幼苗生长产生抑制效应。
在逆境条件下,植物体内正常的蛋白质合成会受到抑制,但会被诱导出一些新蛋白质的产生;但当胁迫加重时,细胞结构受损,蛋白质合成受阻[17]。本研究中,低浓度Cu2+处理的海菜花幼苗叶片可溶性蛋白质含量升高主要是由于抗性蛋白的产生,高浓度Cu2+处理时,植物细胞受损,蛋白合成受阻,可溶性蛋白质含量下降,这与孙天国等人的研究结果一致[17]。
本研究中,在0.01 mg/L、0.05 mg/L、0.10 mg/L和0.20 mg/L的Cu2+处理时,海菜花幼苗对Cu2+的富集量随外源Cu2+浓度的增加而增大,当Cu2+浓度大于0.20 mg/L时,由于海菜花幼苗的生长受到严重抑制,根的吸收和转运能力降低,使叶片中Cu2+含量降低,这与可溶性蛋白质含量的变化趋势一致。
[1] 王娅玲,李维峰,马巾媛,等.铜水平对咖啡幼苗若干生理代谢指标的影响[J].热带农业科学,2014,34(9) :6-8,13.
[2] 韩春梅.铜胁迫对萝卜幼苗根系生理生化指标的影响[J].江苏农业科学,2010 (1) :179-180.
[3] 汪 松,解 焱.中国物种红色名录(1 卷) [M].北京: 高等教育出版社,2004:412.
[4] 李合生.植物生理生化试验原理和技术[M]. 北京: 高等教育出版社,2000:134-136,164-169.
[5] 张志良,瞿伟菁.植物生理学实验指导[M].3 版. 北京: 高等教育出版社,2005:159-160.
[6] 朱 健,龙 健,范菲菲.盐酸左氧氟沙星胁迫对小麦幼苗生长及生理特性的影响[J].东北农业大学学报,2010,41( 11) :17-21.
[7] 张治平,於丙军,汪良驹,等. 低温下ALA 对番茄光合色素和抗氧化酶活性的影响[J]. 江苏农业学报,2014,30( 1) :222-224.
[8] 陈宏州,杨敬辉,张文文,等. 油菜田日本看麦娘对高效氟吡甲禾灵抗性的生理应答[J]. 江苏农业学报,2013,29( 3) :527-532.
[9] 吕艳伟,何文慧,陈雨鸥,等. 盐胁迫对小麦幼苗光合色素含量和细胞膜的影响[J]. 江苏农业科学,2013,41(6) :74-76.
[10] 张丽娜,孙 海,李腾懿,等. Mn2+胁迫对西洋参生理特征及某些营养元素吸收与分配的影响[J]. 江苏农业科学,2014,42(4) :192-196.
[11] 刘大林,曹喜春,张 华.土壤Cu2+胁迫对多花黑麦草部分生理指标的影响[J].草地学报,2014,22(2) :319-325.
[12] 田生科,李廷轩,杨肖娥,等.植物对铜的吸收运输及毒害机理研究进展[J].土壤通报,2006,37(2) :387-393.
[13] 张丽娜,孙 海,李腾懿,等. Fe2+胁迫对西洋参某些生理指标的影响[J].西南农业学报,2013,26 (6) :2265-2270.
[14] 王广林,张金池,王 丽,等.铜锌胁迫对丁香蓼生理指标的影响[J].南京林业大学学报:自然科学版,2009,33(4) :43-47.
[15] 李铮铮,伍钧一,唐 亚,等. 铅、锌及其交互作用对鱼腥草叶绿素含量及抗氧化酶系统的影响[J]. 生态学报,2007,27(12) :5441-5446.
[16] 余顺慧,黄怡民,潘 杰,等.铜胁迫对2 种三峡库区消落带适生植物生长及铜积累的影响[J].西南农业学报,2014,27( 3) :1196-1200.
[17] 孙天国,沙 伟,刘 岩. 复合重金属胁迫对两种藓类植物生理特性的影响[J].生态学报,2010,30(9) :2332-2339.
