高效液相色谱搭载可变波长检测器测定桃果肉中糖组分
2015-04-13蔡志翔马瑞娟张斌斌沈志军郭绍雷俞明亮
严 娟, 蔡志翔, 马瑞娟, 张斌斌, 沈志军, 郭绍雷, 俞明亮
( 江苏省农业科学院园艺研究所/江苏省高效园艺作物遗传改良重点实验室,江苏 南京210014)
果品中含多种糖分,结构复杂且多为异构体,结构差异性小,采用常规方法对其分离鉴定比较困难。加之单糖既无强的紫外吸收,又无荧光基团,而且在通常情况下为电中性,植物组织中糖检测广泛应用的高效液相色谱法( HPLC) 通常需要进行衍生反应,使之具有强紫外吸收、荧光特性或其他一些可测定的物理化学性质,再使用选择性检测器如紫外检测器、荧光检测器等进行检测[1-5],但这样处理步骤复杂,可能会导致不稳定基团的分解,造成测定结果的偏差[6]。目前常采用液相色谱搭载通用型检测器,如示差折光检测器( HPLC-RID) 测定蔬菜果品中糖组分[7-10],样品不需衍生化处理,可以直接测得糖分,但相对于紫外检测器而言,示差折光检测器( RID) 灵敏度不高,且易受外界环境干扰,对温度变化非常敏感,难以平衡,流动相的波动、洗脱液比的变化等都会明显影响折射率。
可变波长检测器( VWD) 是紫外检测器的一种,几乎所有的HPLC 都配有这种检测器。VWD 选择性高,对温度、流动相的波动和组成的变化不甚敏感。液相色谱搭载可变波长检测器( HPLC-VWD)具有良好的光学性能,广泛用于对大多数有紫外吸收的化合物的检测[11-14]。然而本领域技术人员普遍认为HPLC-VWD 不适用于糖类物质的检测,这是因为糖类特别是葡萄糖等物质吸光度极其微弱,需要选用很低的波长区间进行检测,而常用测定糖类的色谱条件选择的流动相的截止波长都较高,会产生背景吸收。有文献总结称选择性检测器无法对糖类组分进行检测[15-16],而VWD 就是典型的选择性检测器。也就是说,一直存在VWD 不适用于检测糖类物质的技术偏见。谢志刚等[17]利用HPLCVWD 直接测定硫酸氨基葡萄糖氯化钾胶囊中氨基葡萄糖的含量。氨基葡萄糖是一种天然的氨基单糖,是葡萄糖中的一个羟基被氨基取代,多了一个氮元素,是直链伯胺,具有胺的性质[18],因此谢志刚等[17]报道的采用氨基柱,无需衍生化直接对氨基葡萄糖进行测定的HPLC-VWD 法,对植物组织中广泛存在的,由碳、氢、氧三元素构成的糖类物质,如蔗糖、葡萄糖、果糖等的检测不具有通用性。总之,目前为止,尚无HPLC-VWD 用于直接检测果品以及其他植物组织中各种糖类的记载。本试验拟建立一种无需衍生即可直接测定果品中糖组分的HPLCVWD 法,为测定果品和其他植物组织中糖组分含量提供一种简单有效的新方法。
1 材料与方法
1.1 材料
试验果品包括紫金红1 号桃和5 个果肉中糖类含量高低较典型的桃品种( 参照沈志军等[19]的结果,5 个桃品种分别为低蔗糖低果糖的乌鸡黑肉桃、高蔗糖的日本86、低葡萄糖的霞晖5 号,高葡萄糖高果糖高山梨醇的黑油桃、低山梨醇的金山早红) ,均取自国家果树种质南京桃资源圃,按照常规栽培方法种植,统一田间管理。另参照文献[10]、[20]、[21]、[22]选择其他4 种水果作为验证,包括含微量蔗糖、高葡萄糖高果糖、无山梨醇的葡萄巨玫瑰、以积累果糖为主的苹果红富士、以积累蔗糖为主的粉蕉广粉1 号和高山梨醇的梨丰水作为试验材料进行糖组分测定。果实洗净后用吸水纸吸干,迅速刨皮,果肉用液氮速冻后置于-20 ℃冰箱备用。
1.2 试剂与设备
本试验选择果品中常见的蔗糖、葡萄糖、果糖和山梨醇共4 种糖类为标准品,均购自Sigma 公司;乙醇试剂为分析纯。
Agilent 高效液相色谱系统: 1100 系列,CARBOSep CHO-620 ( Ca 型,6.5 mm× 300.0 mm,10 μm) 柱,VWD 和RID 2 种检测器。真空浓缩仪。
1.3 HPLC-VWD 法测定水果中糖组分
1.3.1 标准溶液配制 分别准确称取各标准品1.6 g,用超纯水溶解定容,制得浓度为160 g/L的各标准品母液;并用超纯水逐级减倍稀释,制得各级别单标溶液和混标溶液备用。
1.3.2 色谱条件 由于考虑到糖的吸光度很微弱,用VWD 检测需要选很低的波长区间,而所用溶剂和流动相的截止波长也必须要低。本试验采用色谱柱CARBOSep CHO-620 ( Ca 型,6.5 mm× 300.0 mm,10 μm) ,流动相为超纯水,其截止波长只有190 nm,样品溶剂也相应用超纯水,完全符合VWD 检测糖时要求波长低的首要条件; 同时对波长190 nm、195 nm、和200 nm 进行洗脱筛选; 流速和柱温均按照适于该色谱柱的最佳条件,即流速0.5 ml/min,柱温80 ℃;考虑到色谱柱的承载能力和检测器的灵敏度,对进样量大小作了5 μl、10 μl 和15μl 的筛选。在对VWD 和RID 2 种检测器检测结果进行比较时,色谱条件保持一致。
1.3.3 样品的制备 称取果品果肉匀浆1.0 g,加入7 ml 80%乙醇( 体积比) ,室温提取48 h,4 ℃下10 000 r/min离心10 min,取上清液定容至10.0 ml;吸取2.0 ml 提取液浓缩至干,再用0.5 ml 超纯水溶解,经0.22 μm 水系滤头过滤后进色谱柱。
1.3.4 标准曲线绘制及方法评价 在确定的色谱条件下,分别将不同浓度的糖混标溶液进样分析,所用混标浓度梯度为40.000 g/L、20.000 g/L、10.000 g/L、5.000 g/L、2.500 g/L、1.250 g/L、0.625 g/L,根据峰面积与标准物质的含量关系进行线性回归。
对方法的线性范围、最低检出限、回收率和精密度进行测定[14]。移取各糖标准品溶液0.5 ml 分别加入0.5 g 紫金红1 号桃果肉匀浆样品中,按照上述方法进行提取和HPLC-VWD 测定,重复6 次,根据结果计算加标回收率和相对标准偏差。取各级别浓度的糖单标溶液,进样测定,得到最低检出限( 以信噪比S/N=3 时的质量浓度为最低检出限) 。
1.4 HPLC-VWD 和HPLC-RID 法测定5 个桃品种糖含量
将制备好的桃样品按确立的色谱条件分别用HPLC-VWD 和HPLC-RID 进行测定,利用SPSS 软件配对样本t 检验,比较2 种检测器测定的糖含量的差异。
1.5 HPLC-VWD 法测定其他水果中糖含量
将制备好的果品样品按确立的HPLC-VWD 检测条件进行测定。
2 结果与分析
2.1 HPLC-VWD 测定方法的建立
使用HPLC-VWD 方法测定糖,最关键的是波长的选择。本试验对190 nm、195 nm、200 nm 3 个波长进行洗脱筛选,发现190 nm 分离糖组分的效果最好。同时进样量的大小对分离效果并没有太大影响,考虑到色谱柱的承载能力,将进样量定为5 μl。因此确定了HPLC-VWD 检测水果中糖组分的色谱条件为: 流动相超纯水,进样量5 μl,流速0.5 ml/min,温度80 ℃,检测波长190 nm。在此条件下各糖类物质分离效果好,色谱峰正常稳定,得到了4种糖混合标准溶液色谱图( 图1) 和紫金红1 号桃样品图( 图2) ,30 min 即可完成样品的检测。

图1 4 种糖混合标准溶液的HPLC-VWD 图Fig.1 Chromatogram of four kinds of sugars in a standard mixture by HPLC-VWD

图2 紫金红1 号桃果肉样品中糖的HPLC-VWD 图Fig.2 Chromatogram of sugars extracted from Zijinhong 1 peach flesh by HPLC-VWD
2.2 HPLC-VWD 检测方法的评价
线性回归方程、相关系数、线性范围、相对标准偏差、最低检出限和回收率见表1。在相应的线性范围内,各种糖线性关系良好,相关系数均达0.999 9以上,相对标准差为0.53% ~2.71%,回收率为92% ~103%,精密度较高,结果准确。

表1 标准曲线回归方程和方法评价结果Table 1 Linear equation between peak area and sugar content detected by HPLC-VWD and evaluation of the method
2.3 HPLC-VWD 和HPLC-RID 法测定5 个桃品种中糖含量结果的比较
5 个桃品种样品分别用HPLC-VWD 和HPLCRID 法测定的糖组分含量结果见表2。2 种方法对各种糖含量高低典型的桃品种的4 种糖测定结果都能反应出各品种糖含量的特点,即乌鸡黑肉桃明显表现为低蔗糖低果糖,日本86 为高蔗糖,霞晖5 号为低葡萄糖,黑油桃为高葡萄糖高果糖高山梨醇,金山早红为低山梨醇。5 个品种每种糖的HPLC-VWD 和HPLC-RID 法所测得结果差异不显著( P >0.05) 。

表2 HPLC-VWD 和HPLC-RID 法测定的不同桃品种糖组分含量Table 2 Sugars contents in different peach cultivars detected by HPLC-VWD and HPLC-RID
2.4 HPLC-VWD 法测定其他果品中糖含量
葡萄品种巨玫瑰、苹果品种红富士、粉蕉品种广粉1 号和梨品种丰水4 种果品样品HPLC-VWD 检测色谱图见图3,各糖组分含量见表3。各果品中糖种类和含量水平与其他文献报道的结果一致,表现为在葡萄中未检出山梨醇,苹果中果糖含量最高,香蕉中蔗糖含量最高,梨中含有丰富的山梨醇[10,20-22]。
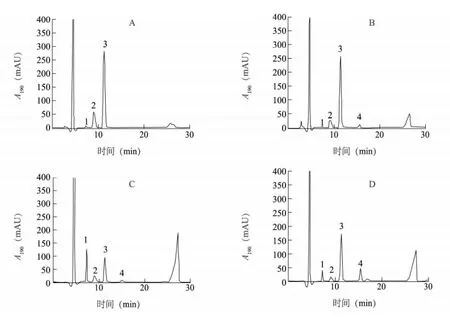
图3 4 种水果果肉样品中糖含量的HPLC-VWD 图Fig.3 Chromatogram of sugar contents in the flesh of four fruits by HPLC-VWD
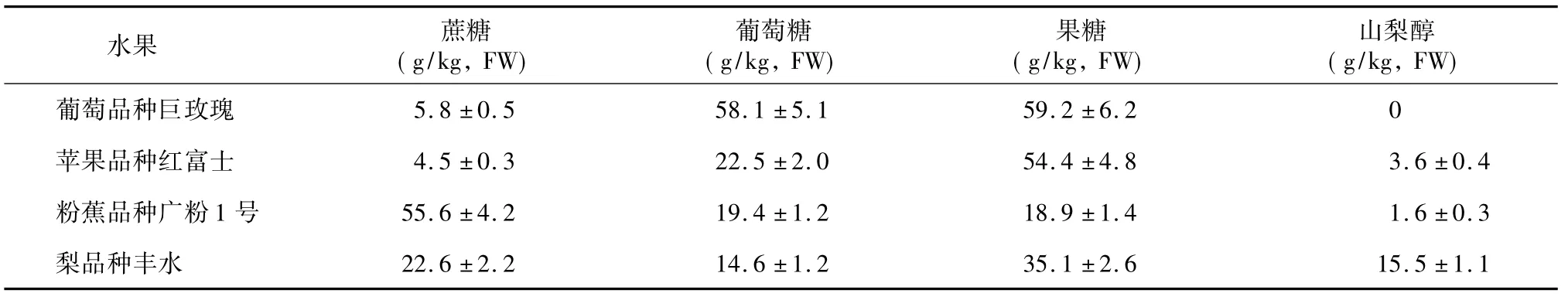
表3 4 种水果果肉样品中糖含量Table 3 Sugar contents in the flesh of four fruits
3 讨论
糖类是水果中重要的品质指标,对其检测方法需要沿着高灵敏度、快速测定及高选择性的方向发展。由于可用于糖类物质直接检测的RID 本身存在不稳定和灵敏度低的问题,而且间接测定的衍生化方法程序繁杂、反应条件较苛刻、反应速度较慢[6],因此在寻找反应条件温和、反应速度快的衍生化方法的同时[18],建立一种高效液相色谱搭载灵敏度高、稳定性好、选择性高的紫外检测器直接检测糖组分的方法将具有较大的研究意义。
因为糖类吸光度弱,需要很低的检测波长区间,要实现HPLC-VWD 直接检测糖类物质,最重要的问题是解决流动相的截止波长的问题,才能防止出现背景吸收。衍生化间接测定的HPLC 法大多采用C18和氨基色谱柱等,流动相多为盐类缓冲液,检测波长较高,造成实践中一直无法利用VWD 对糖类进行直接检测[3-5]。本研究选择的CARBOSep CHO-620 ( Ca 型,6.5 mm×300.0 mm,10 μm) 柱[23],流动相为超纯水,其截止波长为190 nm,通过试验筛选,在该检测波长下,果品中各糖类物质能很稳定地分离,在相应的范围内线性关系良好,相关系数均大于0.999 9,相对标准偏差为0.53% ~2.71%,回收率为92% ~103%;另外,为了避免葡萄糖等组分出现假波峰,定量缺乏可靠性的现象出现,特设计了不同桃品种糖组分HPLC-VWD 和HPLC-RID 2 种检测方法的比较试验,结果显示两种方法的检测结果没有显著差异,说明HPLC-VWD 可以真实稳定地对糖类进行分离和检测。
另外需要指出的是:①由于VWD 检测器和RID检测器的灵敏度在实际应用中基本接近,在本研究中未列出2 种方法的检出限比较数据; ②针对目前一些实验室常搭载DAD( 二极管阵列) 检测器进行液相测定,因此可考虑HPLC-DAD 是否也可适用于对果品糖组分的测定;③本研究所得HPLC-VWD 方法可以对果品果肉中糖组分进行分离检测,那么是否适用于其他植物组织,如花、叶、枝等糖组分的检测还有待研究,因为本方法的检测波长为190 nm,可能会受一些组织中含量较高的、在该波段有紫外吸收的物质( 如酚类等) 的影响,无法准确定性定量,因此在实际应用中,可考虑在上柱分析前结合大孔树脂等材料分离除去相应的干扰物质。
本研究利用HPLC-VWD 法,采用CARBOSep CHO-620 ( Ca 型,6.5 mm×300.0 mm,10 μm) 柱,以超纯水为流动相冲洗,流速0.5 ml/min,温度80℃,检测波长190 nm,适于果品中糖组分的直接测定。该法无需衍生反应,操作简单,精确可靠,打破了一直存在的HPLC-VWD 无法直接测定糖类物质的技术偏见,可为利用HPLC 测定水果和其他植物组织中糖组分含量提供一种新的检测方法。
[1] FU D,O’NEILL R A. Monosaccharide composition analysis of oligosaccharides and glycoproteins by high-performance liquid chromatography[J]. Analytical Biochemistry,1995,227( 2) : 377-384.
[2] HONDA S,SUZUKI S,TAGA A. Analysis of carbohydrates as 1-phenyl-3-methyl-5-pyrazolone derivatives by capillary/microchip electrophoresis and capillary electrochromatography[J]. Journal of Pharmaceutical and Biomedical Analysis,2003,30( 6) : 1689-1714.
[3] 杨兴斌,赵 燕,周四元,等. 柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J]. 分析化学研究简报,2005,33( 9) :1287-1290.
[4] 戴 军,朱 松,汤 坚,等. PMP 柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报,2007,26(2) : 206-210.
[5] 黎国庆,覃江克,陆海南,等. 柱前街生高效液相色谱法分析油茶多糖的单糖组成[J]. 食品科技,2013,38(10) : 282-285.
[6] SHAO Y,ALLURI R,MUMMERT M,et al. A stability-indicating HPLC method for the determination of glucosamine in pharmaceutical formulations[J].Journal of Pharmaceutical and Biomedical Analysis,2004,35(3) : 625-631.
[7] 胡志群,王惠聪,胡桂兵. 高效液相色谱测定荔枝果肉中的糖、酸和维生素C[J]. 果树学报,2005,22(5) : 582-585.
[8] 张秀梅,杜丽清,谢江辉. 高效液相色谱法测定菠萝果实中的糖分[J]. 食品科学,2007,28(11) : 450-452.
[9] 陈丹红. HPLC 法同时测定鸡腿菇水解液中单糖及多糖的研究[J]. 分析测试学报,2009,28(12) : 1464-1467.
[10] 姚改芳,张绍铃,吴 俊,等. 10 个不同系统梨品种的可溶性糖与有机酸组分含量分析[J]. 南京农业大学学报,2011,34(5) : 25-31.
[11] 杨 婕,张日清,金晓玲. 高效液相色谱法在木本植物内源激素含量检测中的应用[J]. 经济林研究,2010,28( 1) : 122-125.
[12] 郭锦明,戚爱棣,李庆云. HPLC-VWD 法同时测定单参及三七混合物中8 种有效成分的含量[J]. 齐鲁药事,2010,29( 1) :11-14.
[13] 颜少宾,张妤艳,马瑞娟,等. 桃果实类胡萝卜素测定方法的研究[J]. 果树学报,2012,29(6) : 1127-1133.
[14] 严 娟,蔡志翔,沈志军,等. 桃3 种颜色果肉中10 种酚类物质的测定及比较[J]. 园艺学报,2014,41(2) : 319-328.
[15] 吕 良,陈 霈. 浅谈高效液相色谱仪检测器的发展与展望[J]. 计量与测试技术,2008,35(9) : 76-77.
[16] 武开业,雷 林,吕庆华. 高效液相色谱仪检测器分类及应用[J]. 科技信息,2010(13) : 789-791.
[17] 谢志刚,李 博,陈书军,等. 高效液相色谱法快速检测氨基葡萄糖含量[J]. 分析测试学报,2012,31(5) : 575-579.
[18] 黄 方,刘 晓,周广军,等. 糖类衍生化技术的研究进展[J]. 化学通报,2003,3(1) : 1-6.
[19] 沈志军,马瑞娟,俞明亮,等. 红肉桃与其他肉色类型桃糖酸组分的比较[J]. 江苏农业学报,2012,28(5) : 1119-1124.
[20] 王海波,陈学森,辛培刚,等. 几个早熟苹果品种果实糖酸组分及风味品质的评价分析[J]. 果树学报,2007,24( 4) : 513-516.
[21] 谢兆森,王世平,许文平. 葡萄果实中的糖分积累和调控[J].植物生理学通讯,2008,44(4) : 785-789.
[22] 周兆禧,赵家桔,马蔚红,等. 3 个品种香蕉果实中糖酸组分及含量的比较分析[J]. 热带作物学报,2011,32( 8) : 1453-1456.
[23] 沈志军,马瑞娟,俞明亮,等. 桃果实发育过程中主要糖及有机酸含量的变化分析[J]. 华北农学报,2007,22(6) : 127-132.
