CT引导经皮穿刺微波消融治疗周围型肺癌27例临床分析
2015-04-13丁怀银包雪平尤庆生
仲 楼,丁怀银,曹 飞,包雪平,尤庆生
(1.南通大学附属医院胸外科,江苏 南通 226001;2.南京市肿瘤医院肿瘤介入科,江苏 南京 210000)
CT引导经皮穿刺微波消融治疗周围型肺癌27例临床分析
仲 楼1,丁怀银2,曹 飞1,包雪平1,尤庆生1
(1.南通大学附属医院胸外科,江苏 南通 226001;2.南京市肿瘤医院肿瘤介入科,江苏 南京 210000)
目的 观察不能耐受手术切除的周围型非小细胞肺癌(NSCLC)在CT引导下经皮微波消融(MWA)治疗的临床疗效。方法2010年2月至2011年7月采用MWA对27例周围型NSCLC患者的27个肿瘤进行了治疗,肿瘤的中位直径为2.9 cm。按照改良的RECIST标准进行局部疗效评价,对中位生存时间和1年、2年和3年生存率以及术后并发症进行了分析。对所有的患者进行了随访,中位随访时间23个月。结果27例患者经历了27个病灶的MWA,在术后30 d内未发生死亡。局部进展率为29.7%,中位生存时间22个月,1年、2年和3年生存率分别为70.4%、22.2%和7.4%。MWA术后气胸的发生率为44.4%、胸腔积液为29.6%、咯血为25.9%、肺内感染为14.8%。结论MWA对于不能耐受外科手术切除的周围型NSCLC疗效确切、安全可靠。
微波消融;肺癌;经皮微波消融
肺癌是严重威胁人类健康的恶性肿瘤之一,以周围型肺癌最为常见,在我国发病率呈上升趋势[1]。目前临床上认为外科切除仍是治愈肺癌的有效手段,但大多数患者确诊时已是中晚期,失去手术切除机会,而放、化疗疗效有限,对那些中晚期期肺癌同时伴有心功能、肝功能衰竭或全身状况差的患者则无法选择手术[2]。局部热消融术作为一种微创技术已应用于早期肺癌的治疗[3],其主要包括经皮射频消融(Radiofrequency ablation,RFA)和微波消融(Microwave ablation,MWA)两种方法,而MWA较RFA具消融体积大、时间短及复发率低等优势[4-7],但微波消融的疗效和安全性仍需进一步临床证实。本研究旨在对微波消融治疗肺癌的临床疗效和安全性进行评价。
1 资料与方法
1.1 一般资料 选取2010年2月至2011年7月于我院我科行微波消融治疗的周围型非小细胞肺癌(NSCLC)患者27例为研究对象,其中男性18例,女性9例,年龄51~79岁,中位年龄65岁,随访时间1~44个月,中位随访时间23.0个月。所有患者均经病理确诊多学科会诊。共检测出肺内病灶27个,病灶直径2.0~4.5 cm,中位半径3.5 cm。入选标准:周围型NSCLC,肺功能较差[一秒用力呼气容积(FEV1)<1 L,第一秒用力呼气量占用力肺活量的百分率(FEV1%) (FEV1%)<50%,最大通气量(MVV)<50%];心、肾功能差和其他伴发疾病(严重糖尿病等)不能耐受手术;拒绝手术切除;微波消融治疗前未接受过放疗、化疗和靶向药物治疗,微波消融治疗后也不接受放疗、化疗和靶向药物治疗;治疗前自愿签署微波消融治疗同意书。这项研究得到了南通大学附属医院伦理委员会批准。患者一般情况见表1。
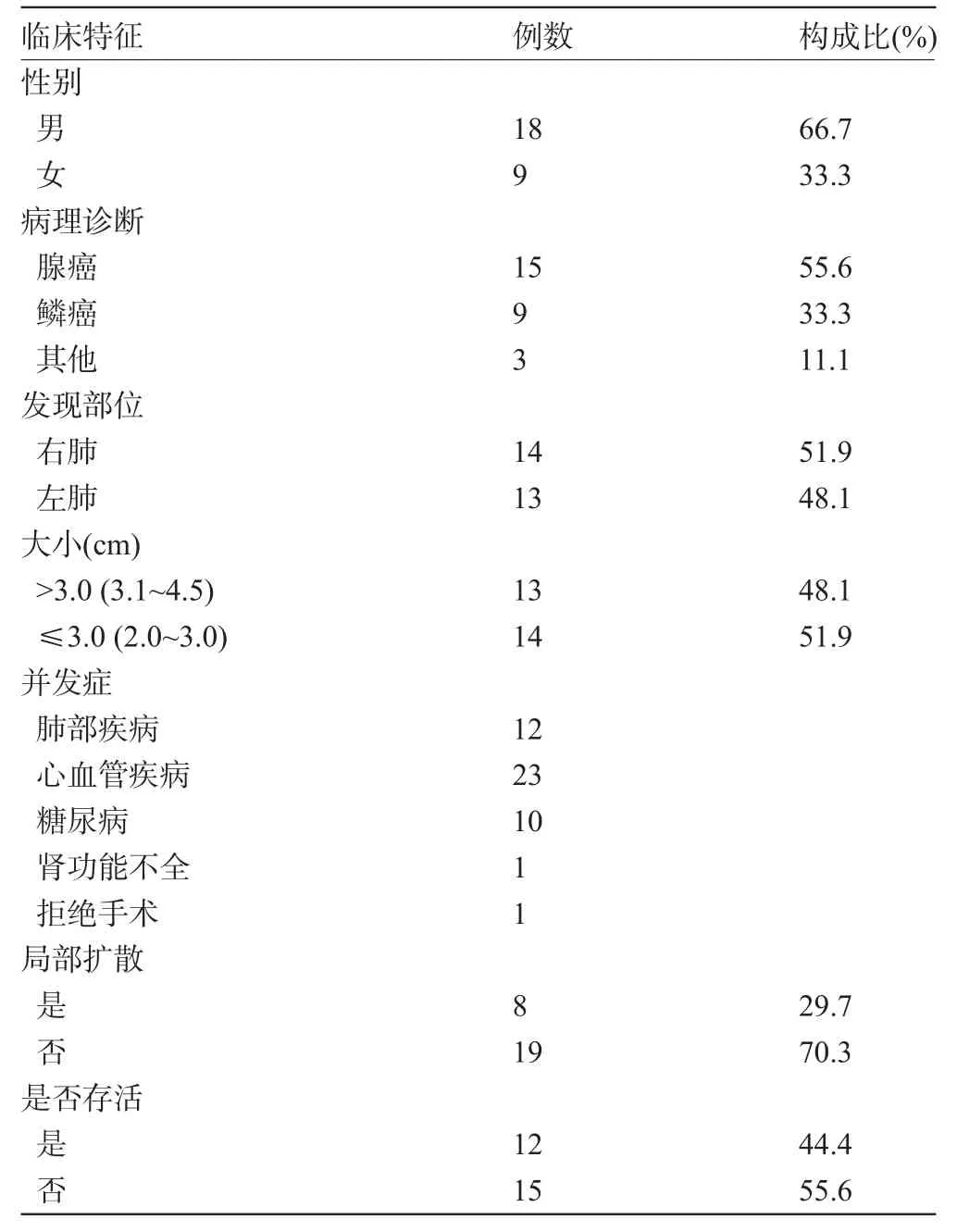
表1 患者的一般情况
1.2 方法
1.2.1 仪器 采用西门子Sensation 16排螺旋CT机,KY-2000双源微波消融治疗仪,前极1.1 cm,针长15 cm和前极1.1 cm,针长10 cm两种规格微波电极(KY2450B),产品注册证号:国食药监(准)字2011第3250282号。微波发射频率为2 450 MHz,最大输出功率100 W。微波天线长度100~180 mm,外径14~20 G,尖端为长圆锥形,采用水循环冷却系统降低天线表面温度。
1.2.2 术前准备 术前CT检查,详细了解病变部位、形态、大小等情况。检查患者凝血及心、肺功能,对有出血倾向者,术前、术后用维生素K和立止血。术前禁食12 h,术前0.5 h予以吗啡10 mg和地西泮1 0mg肌肉注射,术前15 min静注氟比洛芬酯50 mg行超前镇痛,术后8 h再静注50 mg。采用2%利多卡因局部逐层麻醉至肿瘤部位。
1.2.3 手术过程 首先根据患者术前CT图像,选择合适的体位以便将CT定位坐标尺粘附在肿瘤所在区域的体表处。然后制定治疗计划:确定病灶的位置、大小、形态以及与比邻器官的关系;选择最佳穿刺点及穿刺路径;选择合适的微波天线及数量,预设定消融功率和消融时间。麻醉满意后,将消融微波天线逐层穿刺进入体内,在CT扫描观察下将微波天线的尖端送达预定的病灶位置,进行微波消融治疗。消融输出功率一般选择50~80 W,消融时间根据瘤体大小来确定,一般设定为4~10 min[8]。消融完毕,边拔针边辅射微波凝固针道,术后消毒并包扎伤口,患者卧床休息,并密切注意患者的血压、脉搏、呼吸等情况。
1.2.4 疗效评价 所有患者在消融术后48 h内均执行CT扫描,以观察病灶周围情况以及是否有并发症发生。采用改良的实体瘤疗效评价标准(New response evaluation criteria in solid tumors,RECIST)评价此组患者的疗效[9]。该标准分为4级:完全缓解(Complete response,CR)、部分缓解(Partial response,PR)、稳定(Stable disease,SD)和进展(Progressive disease,PD)。CR需符合以下两个条件:(1)CT显示肿瘤消失(可有瘢痕)或瘤体最大径较治疗前减少大于70%;(2) CT显示病灶密度呈囊腔样改变或呈低密度,无动脉期强化;(3)PET显示葡萄糖(FDG)代谢标准摄取值(SUV值)<2.5。PR需符合以下任1个条件:(1)CT显示瘤体最大径减小大于30%;(2)CT显示病灶中央出现坏死或有液性囊腔形成;③PET显示SUV值下降或FDG吸收区缩小。SD需符合以下任一个条件:(1) CT显示瘤体最大径减小小于30%;(2)CT显示病灶仍为实性改变,中央无坏死或囊腔形成;(3)PET显示SUV值或FDG吸收区均无变化。PD需符合以下2个条件:(1)CT显示瘤体最大径增加20%以上;(2)肿块仍呈实性,并侵犯周围邻近组织;(3)PET显示SUV值或FDG吸收区均增大。本研究通过定期CT观察,评价肿瘤局部疗效。以上指标通过术后每3个月CT复查判定。随访患者计算生存期,随访时间1~44个月。
1.2.5 并发症评估 按照2009年影像引导下肿瘤消融国际工作组制定的标准对并发症进行评估,该标准分为主要并发症、轻微并发症以及副反应[10]。
1.3 统计学方法 采用SPSS17.0软件包对数据进行统计分析,组间定性资料比较采用χ2检验。采用Kaplan-Meier法计算生存期,生存率比较采用Log-rank (Mantel-Cox)检验,P<0.05为差异有统计学意义。
2 结果
2.1 局部疗效 中位随访23个月内,全组局部进展发生率为29.7%(8/27),肿瘤直径>3.0 cm者有7例发生局部进展,发生率为53.8%(7/13),而肿瘤直径≤3.0 cm者仅有1例发生局部进展,发生率为7.1% (1/14),两组比较差异有统计学意义(χ2=3.902,P= 0.048),见图1。
2.2 生存率 全组中位生存时间(MST)22.0个月,1年、2年和3年生存率分别为70.4%、22.2%和7.4%。肿瘤直径≤3.0 cm者1年、2年生存率均明显高于肿瘤直径>3.0 cm者,差异有统计学意义(85.7% vs 53.8%,28.6%vs 15.4%,P=0.035),3年生存率比较差异无统计学意义(7.1%vs 7.8%),见图2。

图1 特殊病例CT图
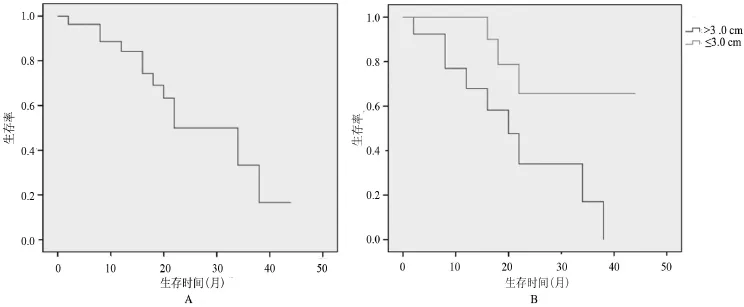
图2 生存率
2.3 并发症和副作用及处理 消融后综合征的主要症状为发热、乏力、恶心、呕吐等。在接受消融治疗后的前3 d,本组患者有9例患者出现了消融后综合征的表现,给予非甾体类解热止痛抗炎药,必要时给予糖皮质激素治疗。在接受消融治疗后,本组患者有12例(44.4%)出现气胸,在胸腔插管闭式引流下均获得治愈;8例(29.6%)患者出现胸腔积液,其中2例(7.4%)进行了胸腔插管引流;7例(25.9%)患者发生咯血,给予常规止血药物,即可有效止血,其中4例(14.8%)患者发生术中咯血,随着消融治疗的进行出血会逐渐停止;肺炎4例,通过有效抗生素治疗后使感染得到有效控制。本组患者未发生术中和围手术期死亡,住院时间3~21 d,中位住院时间5.5 d。在局麻条件下开展微波消融术,一般均有不同程度的疼痛。本组患者术中发生中度以上的疼痛5例,对于剧烈疼痛的患者可暂时停止手术,给予吗啡以及适量镇静剂即可。术后发生中度疼痛7例,对症处理给予止痛药物即可缓解。
3 讨论
大多数肺癌患者确诊时已是中晚期,失去手术切除机会,而只能选择放、化疗。目前随着放疗技术以及第三代化疗药物的出现,对肺癌的疗效有一定的提高,肺癌总的5年生存率提高到15%,较20世纪60年代的8%有了较大的进步,但是疗效仍不能令人满意[11]。微波消融术是肿瘤热疗领域中最新兴的技术,可适用于不同类型肿瘤的热消融治疗,其治疗肿瘤的原理是在影像技术(譬如CT)引导下将微波天线经皮肤穿刺进入肿瘤内,肿瘤中的极性分子(碳水化合物、蛋白质等)和带电粒子(钾、钠、氯离子)在微波的电磁辐射场作用下可出现激烈的转动,而产生摩擦生热效应,可使肿瘤组织在短时间内达到70℃~160℃的温度,足以使肿瘤内的蛋白质变性,从而诱导肿瘤细胞发生凝固性坏死,起到治疗肿瘤的目的[12-13]。
MWA在肿瘤内可以始终保持较高的温度,消融体积较大,消融所需要的时间短,热沉积效应少,可以多个MWA天线同时应用等。因此,与以往的RFA技术相比,MWA在治疗肺部肿瘤方面有更多的优势。目前MWA已成为非手术切除肺癌治疗的手段之一[14-16]。微波消融治疗的效果与微波频率的选择至关密切,目前临床上常用的微波频率是915 MHz与2 450 MHz,2 450 MHz也最为常用[17]。本组患者均采用2 450 MHz微波频率进行消融治疗,并且取得了较好的治疗效果。
本组患者在MWA治疗后中位随访23个月内,有29.7%(8/27)的患者出现了局部进展,该结果显示,微波消融治疗肺癌具有较好的局部控制率。其中7例局部进展患者的肿瘤直径>3.0 cm,另1例局部进展患者的肿瘤直径≤3.0 cm,比较差异有统计学意义(P<0.05)。由此可见,MWA对于直径小于3.0 cm的肿瘤具有更好的局部控制率,而对于较大的肿瘤局部控制率较差,可能是由于肿瘤体积过大、形态不规则,以致消融天线未能适形杀灭全部肿瘤细胞,导致肿瘤细胞残留。此外,由于较大的肿瘤内含有过多、过大的血管,或肿瘤本身靠近大血管,大血管具有热沉积效应,从而导致肿瘤组织残留。因此对于体积较大的肿瘤,应联合其他治疗手段,如MWA后再加用适形放疗和化疗等[18-19]。
从本组随访的结果看,全组患者中位随访时间为23.0个月,1年、2年和3年的生存率分别为70.4%、22.2%和7.4%,微波消融治疗周围型肺癌疗效明确。肿瘤直径≤3.0 cm者1年、2年生存率均明显高于肿瘤直径>3.0 cm者,差异有统计学意义(P<0.05),3年生存率比较差异无统计学意义(P>0.05),提示MWA可以更好的延长肿瘤直径较小的患者的生存期,与以往的报道结果相似[20-21]。
气胸是微波消融治疗后最为常见的并发症,本组患者在接受MWA后共有12例发生气胸,发生率为44.4%(12/27)。虽然气胸的发生率较高,但症状都比较轻,不需要临床处理。其他常见的并发症如胸腔积液(29.6%)、咯血(25.9%)、肺炎(14.8%)等,经对症和有效抗生素治疗后均能得到有效控制。由于在局麻情况下实施MWA,常见副作用为疼痛,经对症治疗均得以控制。本组27例患者无一例发生术中和围手术期死亡,说明微波消融治疗周围型肺癌的并发症发生率低并且可以有效控制,因此具有较高的安全性。
综上所述,在CT引导下采用微波消融术治疗周围型肺癌疗效明确,可以有效控制肿瘤的进展和延长患者的生存期,而且具有不良反应较少、安全性高等优势,有望成为不能耐受手术治疗的周围型肺癌的首选治疗方法之一。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2012,62(1):10-29.
[2]何 文,胡向东,邬冬梅,等.超声引导经皮穿刺微波消融治疗肺癌[J].中国微创外科杂志,2007,7(5):406-408.
[3]Jahangeer S,Forde P,Soden D,et al.Review of current thermal ablation treatment for lung cancer and the potential of electrochemotherapy as a means for treatment of lung tumours[J].Cancer Treat Rev,2013,39(8):862-871.
[4]Ierardi AM,Floridi C,Fontana F,et al.Microwave ablation of liver metastases to overcome the limitations of radiofrequency ablation [J].Radiol Med,2013,118(6):949-961.
[5]Liu Y,Li S,Wan X,et al.Efficacy and safety of thermal ablation in patients with liver metastases[J].Eur J Gastroenterol Hepatol, 2013,25(4):442-446.
[6]Baisi A,De Simone M,Raveglia F,et al.Thermal ablation in the treatment of lung cancer:present and future[J].Eur J Cardiothorac Surg,2013,43(4):683-686.
[7]Abbas G,Pennathur A,Landreneau RJ,et al.Radiofrequency and microwave ablation of lung tumors[J].J Surg Oncol,2009,100(8): 645-650.
[8]舒晓莉,单光莲,叶 欣.肺癌局部热消融治疗[J].国际肿瘤学杂志,2011,38(4):382-385.
[9]Fernarido HC,De Hoyos A,Landrenean RJ,et al.Radiofrequency ablation for the treatment of non-small cell lung cancer in marginal surgical candidates[J].J Thorac Cardiovasc Surg,2005,129(3): 639-644.
[10]王 强,刘瑞宝,张立成.肺癌微波消融治疗进展[J].中国肺癌杂志,2010,13(1):78-81.
[11]葛 敏.非小细胞肺癌化疗进展[J].右江民族医学院学报,2008, 6:1072-1074.
[12]Gadaleta C,Mattidi V,Colucci G,et al.Radiofrequency ablation of 40 lung neoplasms:preliminary results[J].AJR Am J Roentgenol, 2004,183(3):361-368.
[13]范卫军,叶 欣.肿瘤微波消融治疗学[M].北京:人民卫生出版社,2012:23-26.
[14]Schneider T,Heussel CP,Herth FJ,et al.Thermal ablation of malignant lung tumors[J].DtschArztebl Int,2013,110(22):394-400.
[15]郭 亚,孙亚红,宋鹏远,等.CT引导经皮穿刺微波消融肺部恶性肿瘤的临床观察[J].临床肿瘤学杂志,2013,18(7):640-643.
[16]卢 强,李小飞,韩 勇.微波消融治疗肺部恶性肿瘤的临床疗效分析[J].中国医药,2012,7(5):557-559.
[17]Nakahara Y,Mochiduki Y,Miyamoto Y,et al.Prognostic significance ofthe lymphocyte-to-neutrophilratio in percutaneous fine-needle aspiration biopsy specimens of advanced nonsmall cell lung carcinoma[J].Cancer,2005,104(6):1271-1280.
[18]郭 亚,孙亚红,宋鹏远,等.CT引导下经皮微波消融治疗周围型肺癌的临床研究[J].微创医学,2013,8(5):551-553.
[19]郭晨阳,胡鸿涛,李海亮.CT引导经皮穿刺微波治疗周围型肺癌[J].当代医学,2009,15(35):674-676.
[20]Liu H,Steinke K.High-powered percutaneous microwave ablation of stage I medically inoperable non-small cell lung cancer:a preliminary study[J].J Med Imaging Radiat Oncol,2013,57(4): 466-474.
[21]朱良明,李前生,蔺玉霞,等.经皮微波热凝固疗法治疗周围型肺癌的近期疗效评价[J].中国微创外科杂志,2006,6(2):115-116.
Clinical evaluation of CT-guided percutaneous microwave ablation for 27 patients with inoperable non-small cell lung cancer.
ZHONG Lou1,DING Huai-yin2,CAO Fei1,BAO Xue-ping1,YOU Qing-sheng1.1.Chest Surgery, Affiliated Hospital of Nantong University,Nangtong 226001,Jiangsu,CHINA;2.Department of Intervention,Nanjing Tumor Hospitol,Nanjing 210000,Jiangsu,CHINA
ObjectiveTo retrospectively evaluate the clinical efficacy of CT-guided percutaneous microwave ablation(MWA)for treating inoperable periphera non-small cell lung cancer(NSCLC).MethodsFrom February 2010 to July 2011,27 patients with inoperable NSCLC(27 tumors)underwent CT-guided MWA.The median diameter of tumor was 2.9 cm.Treatment outcomes were evaluated using modified response evaluation criteria in solid tumors criteria based on follow-up contrast-enhanced CT studies.Median overall survival and 1-,2-,3-year overall survival rates,and postoperative complications were also summarized.All the patients were followed up for a medium of 23 months.ResultsTreatment was completed in all cases with no mortality in 30 days.During the follow-up,local progression was 29.7%,and median overall survival was 22 months.The 1-,2-,and 3-overall survival rates after MWA were 70.4%,22.2%and 7.4%,respectively.The complications after MWA included pneumothorax(44.4%), pleural effusion(29.6%),hemoptysis(25.9%),pulmonary infection(14.8%).ConclusionCT-guided MWA is a well-tolerated,safe and effective method for the treatment of inoperable periphera NSCLC.
Microwave ablation;Lung cancer;Percutaneous microwave ablation
R734.2
A
1003—6350(2015)07—0988—05
10.3969/j.issn.1003-6350.2015.07.0353
2014-07-26)
仲 楼。E-mail:1556924653@qq.com
