新疆维吾尔族女性乳腺癌新辅助化疗疗效多因素分析
2015-04-13何益腾朱丽萍
何益腾,宋 牧,陈 晶,于 冰,朱丽萍
(1.新疆医科大学第二附属医院肿瘤外科,新疆 乌鲁木齐 830063;2.新疆医科大学肿瘤医院乳腺外科,新疆 乌鲁木齐 830011)
新疆维吾尔族女性乳腺癌新辅助化疗疗效多因素分析
何益腾1,宋 牧1,陈 晶1,于 冰1,朱丽萍2
(1.新疆医科大学第二附属医院肿瘤外科,新疆 乌鲁木齐 830063;2.新疆医科大学肿瘤医院乳腺外科,新疆 乌鲁木齐 830011)
目的 探讨相关因素在新疆地区维吾尔族女性乳腺癌新辅助化疗(NAC)疗效中的意义。方法收集新疆医科大学第二附属医院及肿瘤医院2010年1月至2014年6月87例行NAC的维吾尔族女性乳腺癌患者的全部病历资料。NAC前均行肿块空心针穿刺活检病理确诊,并用免疫组化(IHC)方法明确患者雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her-2)状态和肿瘤增殖指数(Ki-67)。分析患者年龄、绝经状态、体质指数(BMI)、肿块大小、腋窝淋巴结状况、临床分期、NAC周期数、分子分型对NAC有效率(CR+PR)和病理完全缓解(pCR)的预测作用。结果在87例患者中NAC总有效率为85.06%(74/87),疾病稳定(SD)率为11.49%(10/87),疾病进展(PD)率为3.45%(3/87);pCR率为14.94%(13/87)。激素受体阴性、Ki-67指数>20%、体重指数(BMI)<25 kg/m2、非LuminaA型患者NAC疗效更好。NAC周期数>4个周期为预测pCR的独立变量(P=0.004,OR=0.081;95%CI:0.015~0.441)。结论ER阴性、PR阴性、NAC周期>4个周期者pCR率更高。ER阴性、PR阴性、Ki-67指数>20%、非LuminaA型、BMI<25 kg/m2者NAC后临床有效率更高。NAC周期>4周期为预测pCR的独立因素。
新疆地区;维吾尔族;乳腺癌;新辅助化疗;病理完全缓解
乳腺癌目前已成为威胁女性健康第一位的肿瘤。新疆地区由于经济、文化、教育、宗教、民族等特点,影响着本地区维吾尔族女性乳腺癌的特点。有文献报道新疆地区维吾尔族女性与上海地区女性乳腺癌患者有发病年龄更小、临床分期更晚、基底细胞样类型更多等特点[1]。
乳腺癌新辅助化疗(NAC)能使不可手术局部进展期患者变为可手术,肿瘤降期,增加保乳手术成功率,使腋窝淋巴结受浸者降期,把腋窝淋巴结清扫变成前哨淋巴结活检术,消灭潜在的微小转移灶,降低血行转移发生率。同时NAC期间也可以观察肿瘤对化疗药物的敏感性。有研究表明,NAC后有更好疗效者和获得完全缓解(pCR)者提示预后更好[2]。本文通过收集新疆维吾尔族女性乳腺癌患者病历资料找出与NAC疗效相关的多种因素,分析其与NAC疗效的相关性,找出能预测pCR率的因素,提高NAC疗效,使患者能有更好的获益。
1 资料与方法
1.1 一般资料 收集新疆医科大学第二附属医院及肿瘤医院2010年1月至2014年6月行NAC的新疆维地区吾尔族女性乳腺癌患者87例,年龄26~68岁,中位年龄47岁,临床分期为Ⅱ~Ⅲ期。全部患者均行以蒽环和紫杉类为基础的联合化疗方案。NAC后行改良根治术、保乳手术或乳房单切术。
1.2 方法 全部患者NAC前均在超声引导下行18 G空心针穿刺活检,病理确诊为乳腺癌,通过免疫组织化学(IHC)的方法获取雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(Her-2)、肿瘤增殖指数(Ki-67)信息。通过查体、B超、乳腺钼靶、MRI检查评估疗效,术后常规病理评估pCR。NAC前后根据患者肿块大小、腋窝淋巴结状况的变化分为临床缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)组。
1.2.1 纳入标准与排除标准 (1)纳入标准:①病历资料完整的新疆地区维吾尔族女性患者;②至少行1周期以蒽环和紫杉类为基础的NAC,化疗结束后均行手术治疗;③临床分期为Ⅱ~Ⅲ期患者;④肝肾功能正常者;⑤未曾接受过其他化疗、放疗或内分泌治疗;⑥Karnofsky评分>70分。(2)排除标准:①临床Ⅰ、Ⅳ期患者;②新辅助化疗后未行手术者;③合并其他恶性肿瘤患者
1.2.2 评估方法
1.2.2.1 临床分期评估 TNM分期采用《美国AJCC癌症分期手册》第六版分期方法。临床疗效评价采用实体瘤疗效评价标准(RECIST),目标病灶的评价:CR:所有目标病灶消失;PR:基线病灶长径总和缩小≥30%;PD:基线病灶长径总和增加≥20%或出现新病灶;SD:基线病灶长径总和有缩小但未达PR或有增加但未达PD。CR+PR为有效,SD+PD为无效。体质指数(BMI)=体重(kg)÷身高2(m),BMI<25 kg/m2表示正常体重或低体重,≥25 kg/m2表示超重或肥胖。
1.2.2.2 组织病理判读 采用Miller-Payne病理评价系统:l级,浸润癌组织的数量无变化;2级,浸润癌组织数量减少比例≤30%;3级,浸润癌组织数量明显减少比例介于30%~90%;4级,浸润癌组织数量减少比例≥90%,仅有少数残余的癌细胞散在分布;5级,所有切片均无浸润性癌残存,可见残存的导管内癌成分,即为pCR。
1.2.2.3 免疫组化结果评定方法 ER、PR以核内出现棕黄色颗粒为阳性标记,根据着色细胞的比例及着色的强度分为4级,阳性细胞占全片内肿瘤细胞的百分比<10%为(-);百分比10%~25%为(+)、染色为较弱的淡黄色为(+);百分比25%~75%、染色为黄色或深黄色为(++);百分比>75%、染色棕黄色为(+++)。如果表达状态为(-)则定义为受体表达阴性,若表达为(+)~(+++)则定义为受体表达阳性。HER-2根据肿瘤细胞着色百分比和细胞膜着色强度打分,分为0、+、++和+++,阳性标准(+++)为>30%的肿瘤细胞膜呈现完整而均匀的着色,HER-2免疫组化检测呈++的患者行荧光原位杂交检测HER-2基因的扩增情况。评判标准:HER-2基因信号与17号染色体信号的比值阳性>2.2为有扩增。HER-2免疫组化+++或荧光原位杂交有扩增判断为阳性。Ki-67计数核阳性肿瘤细胞的百分比,采取整张切片平均计数法(≤20%为低表达,>20为高表达)。
1.2.2.4 分子分型 采用2013年乳腺癌St. Gallen共识,包括:①LuminaA型:ER和(或)PR阳性、Her-2阴性、Ki-67<14%;②LuminaB型:ER和(或)PR阳性、Her-2阴性、Ki-67>14%;ER和(或)PR阳性、Her-2阳性、任何Ki-67;③Her-2过表达型:ER和(或)PR阴性、Her-2阳性;④三阴型:ER和(或)PR阴性、Her-2阴性。
1.3 统计学方法 采用SPSS17.0统计分析学软件进行χ2检验或Fisher精确检验法,全部因素首先采用单因素分析,有关因素再行Logistic二元回归模型行多因素分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 总体疗效 对87例患者疗效评价,总有效率(CR+PR)为85.06%(74/87),SD为11.49%(10/87),PD为3.45%(3/87),pCR为14.94%(13/87)。
2.2 临床病理特征与NAC疗效 首先行单因素分析发现,年龄、肿瘤大小、淋巴结状态、Her-2表达、是否绝经、NAC周期、临床分期与临床有效(CR+ PR)无关。年龄、肿瘤大小、淋巴结状态、Ki-67表达状态、Her-2表达、是否绝经、是否超重、临床分期与pCR无关,NAC周期>4周期者pCR率高于NAC周期≤4周期者(P=0.002),见表1。
2.3 NAC后临床有效率(CR+PR)ER阴性>ER阳性 (P=0.001),PR阴性>PR阳性(P=0.027),Ki-67指数高表达>Ki-67指数低表达(P=0.000),非LuminaA型>LuminaA型(P值分为:0.015、0.007、0.000),BMI指数<25 kg/m2者大于BMI指数≥25 kg/m2者(P=0.048)。

表1 乳腺癌临床指标与临床有效的关系(例)
2.4 NAC后pCR率 ER阴性>ER阳性(P= 0.008),PR阴性>PR阳性(P=0.007),不同分子分型间CR+PR和pCR率差异有统计学意义,LuminaA型和其他亚型比较CR+PR率更低,差异有统计学意义,但pCR率差异无统计学意义,见表2和表3。
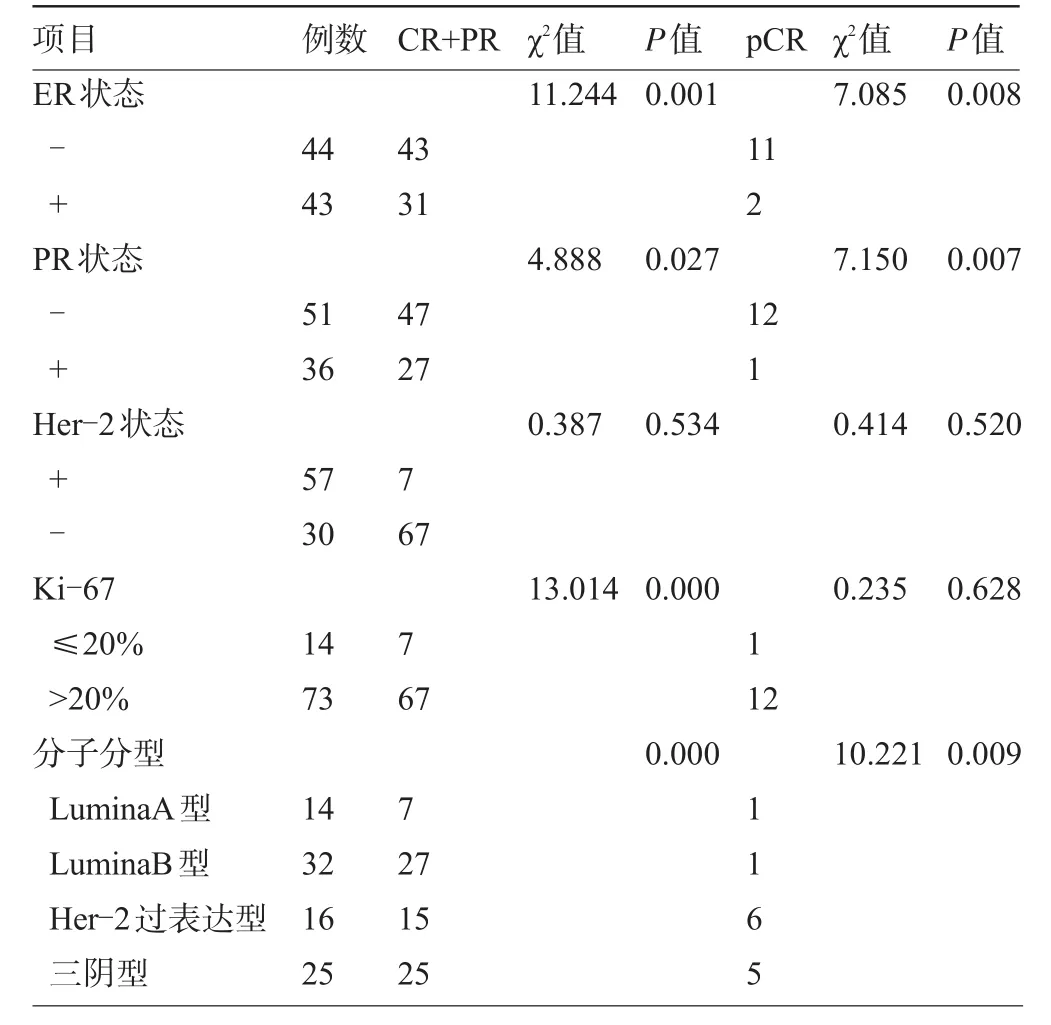
表2 生物学标志和分子分型与临床有效的关系(例)

表3 LuminaA型与其他亚型NAC疗效的比较(例)
2.5 多因素分析结果 单因素分析后找出与CR+PR和pCR有关的因素,再进行Logistic二元回归多因素分析,发现NAC周期>4周期为预测pCR的独立变量(P=0.004,OR=0.081;95%CI:0.015~0.441),结果见表4、表5。
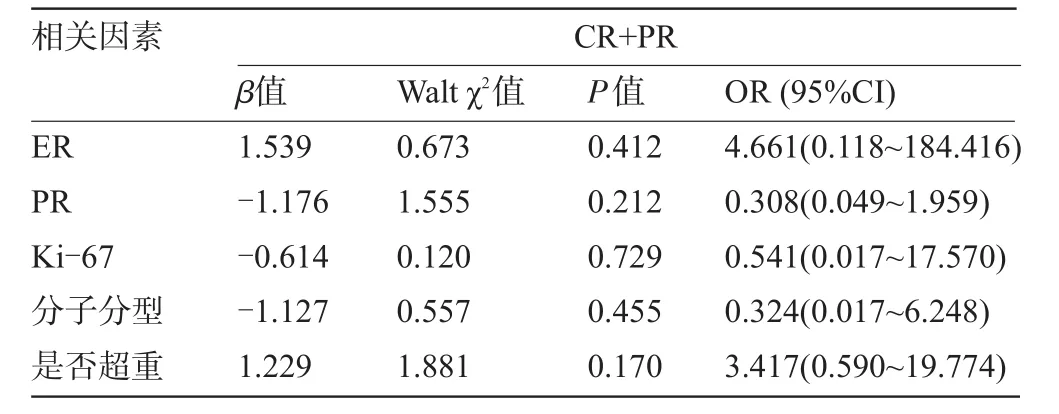
表4 相关因素与乳腺癌NAC后临床有效的多因素分析

表5 相关因素与乳腺癌NAC后pCR的多因素分析
3 讨论
近年来由于术前NAC能使乳腺癌降期,有助于患者选择保乳术来替代乳房切除术,故在临床上得到广泛应用。对于局部进展期乳腺癌,术前治疗能提高病灶的局部控制率,增加可切除率。和辅助治疗相比,这种系统性的化疗疗效也预示着患者更好的生存。除了提高保乳手术的成功率,新辅助化疗的应用和疗效判断尚不清楚,但可以使医生有机会评估体内某种药物治疗的敏感性,获得临床完全缓解与病理完全缓解的患者比没有获得的患者治疗效果更好[3]。NSABP-27、EORTC10901等试验均证实获得pCR是无进展生存期(PFS)和总生存期(OS)的重要预测因子,但经过化疗后降期的乳腺癌患者的PFS和OS并没有改善。
本文研究对象是新疆地区维吾尔族女性乳腺癌患者这一群体,针对新疆维吾尔族女性乳腺癌患者发病年龄小、临床分期晚、三阴性比例高、预后差等特点,总结出与新辅助化疗pCR率有关的因素,为临床预测患者新辅助化疗疗效提供帮助。
一份关于中国成年女性肥胖与乳腺癌风险的研究报道中指出,成年女性超重或肥胖较正常体重者患乳腺癌的风险系数OR为1.99(95%CI:1.42~2.79),而在近5年内超重或肥胖的女性其患乳腺癌风险系数OR则升高为3.04(95%CI:1.18~7.86)[4]。也有研究认为BMI与乳腺癌预后存在相关性,超重和肥胖会增加肿瘤的复发转移风险和死亡风险。Litton等[5]研究报道:单因素分析发现肥胖比正常体重和低体重在NAC后pCR率差异有统计学意义,多因素分析未发现明显相关性。但超重和超重联合肥胖组显示有更低的pCR率(分别为OR=0.59,95%CI:0.37~0.95;和OR=0.67,95%CI:0.45~0.99)。本研究中单因素分析显示BMI指数正常和超重相比NAC有效率更高,但未提示有更好的pCR率,可能与样本量不足有关。
近年来对乳腺癌某些生物学因子的表达与新辅助化疗疗效间的关系各家报道不一致,可能与化疗方案不同有关。但越来越多的研究发现ER阴性、PR阴性、HER2过表达可获得高pCR,可预测新辅助化疗的药物敏感性[6-9]。联合激素受体和Her-2按分子分型比较表明,对于HER2过表达同时ER、PR均阴性和三阴性患者,与其他分子亚型比较差异有统计学意义。本研究显示乳腺癌患者的分子分型与CR+PR及pCR有关。ER阴性、PR阴有更好的有效率及pCR率。分子分型中:LuminaA型较其他三种亚型NAC有效率更低,与相关报道一致。但LuminaA型较其他三种亚型进行比较pCR率差异无统计学意义,可能与研究样本量不足及化疗周期和化疗方案差异有关。
Ki-67是一种与细胞增殖有关的核抗原,能很好地反应肿瘤增生活性,是检测肿瘤细胞增殖活性最可靠的指标之一。Ki-67指数的高表达提示肿瘤的高侵袭性,并与预后不良有关。有研究发现Ki-67阳性与阴性表达者cPR分别为40%和20%(P=0.02),高表达与cPR具有显著相关性[10],说明肿瘤细胞增殖活性高者对化疗更敏感。这与本研究的结论一致。本文研究发现,Ki-67指数>20%者与Ki-67指数≤20%者有更好的临床有效率,但未发现与pCR率有关。
一项多个随机对照研究结果显示,采用NAC 3个周期的pCR率为10%左右,6个周期的pCR率在20%左右。也有研究显示,采用蒽环和紫杉类方案化疗3个周期的pCR率(分别为7.7%和10%)显著低于6个周期(分别为18.6%和36%,均P<0.05)[11-12]。本研究结果显示,NAC周期>4个周期时,pCR率显著增加(P=0.002)。德国的一项新辅助化疗研究显示[13]:在GepaarTrio试验中,接受6个周期TEC方案化疗的患者PCR率为21%,而8个周期TEC方案化疗的PCR率为23.5%,两者之间差异无统计学意义。本研究通过单因素分析后发现,ER、PR、化疗周期数、分子分型与pCR率有关,再进行多因素Logistic二元回归分析显示,化疗周期数>4周期为pCR的独立预测因子。提示NAC周期数>4周期能获得更好的pCR率。与本研究并不矛盾,因此,笔者认为在患者能耐受的情况下,适当延长化疗周期至6个周期,会增加pCR率。
本研究通过单因素分析及多因素分析方法显示,NAC周期>4周期为pCR的独立预测因子。Her-2过表达型、三阴型比LuminaA、B型的在pCR率方面的差异无统计学意义,与相关文献报道有差别。由于样本量的不足,还有待进一步研究。
综上所述,对于新疆地区维吾尔族女性乳腺癌患者,在有新辅助化疗指针前提下,行足量、规范的新辅助化疗可以提高乳腺癌患者的pCR率,使患者有更好的获益。
[1]钟芳芳,张 巍,王成辉,等.上海汉族和新疆维吾尔族女性乳腺癌[J].中国癌症杂志,2014,24(1):21-28.
[2]Dixon JM,Renshaw L,Bellamy C,et al.The effects of neoadjuvant anastrozole(Arimidex)on tumor volume in postmenopausal women with breast cancer:a randomized,double-blind,single-center study[J].Clinical Cancer Research,2000,6:2229-2235.
[3]ATAC Trialists'Group.Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early breast cancer:first result of the ATAC randomised trail[J].Lancet,2002,359:2131-2139.
[4]Shi J,Min Zhang,Li L,et al.Body mass index and its change in adulthood and breast cancer risk in china[J].Asian Pacific Journal of Cancer Prevention,2010,11:1213-1218.
[5]Litton JK,Gonzalez-Angulo AM,Warneke CL,et al.Relationship between obesity and pathologic response to neoadjuvant chemotherapy among women with operable breast cancer[J].Journal of Clinical Onclogy,2008,26:4072-4977.
[6]刘 钊,尉承泽,黄 焰,等.乳腺癌新辅助化疗疗效与临床特征的相关性研究[J].军事医学,2013,37(9):700-703
[7]Rouzier R,Perou CM,Symmans WF,et al.Breast cancer molecular subtypes respond differently to preoperative chemotherapy[J]. Clin Cancer Res,2005,11(16):5678-5685.
[8]Iwase T,Nakamura R,Yamamoto N,et al.The effect of molecular subtype and body mass index on neo-adjuvant chemotherapy in breast cancer patients[J].The Breast,2014,23:264-272
[9]曾晓华,刘长安,王继见,等.局部进展期乳腺癌雌、孕激素受体和HER2的表达与双周ET新辅助化疗疗效的相关性[J].中国癌症杂志,2009,19(5):358-363.
[10]Brown JR,Digiovanna MP,Killelea B,et al.Quantitative assessment Ki-67 score for prediction of response to neoadjuvant chemotherapy in breast cancer[J].Lab Invest,2014,94:98-106.
[11]Reitsamer R,Peintinger F,Prokop E,et al.Pathological complete response rates comparing 3 versus 6 cycles of epidoxorubicin and docetaxel in theneoadjuvant setting of patients with stageⅡandⅢbreast cancer[J].Anticancer Drug,2005,16(8):867-870.
[12]Steger GG,Galid A,Gnant M,et al.Pathologic complete response with six compared with three cycles of neoadjuvant epirubicin plus docetaxel and granulocyte colony-stimulating factor in operable breast cancer:results of ABCSG-14[J].Journal of Clinical Oncology,2007,25(15):2012-2018.
[13]von Minckwitz G,kummel S,vogel P,et al.Intensified neoadjuvant chemotherapy in early-responding breast cancer:phaseⅢrandomized GeparTrio study[J].J Natl Cancer Inst,2008,100:552-562.
Multi-factor analysis of response to neo-adjuvant chemotherapy in Xinjiang Uyghur females with breast cancer.
HE Yi-teng1,SONG Mu1,CHEN Jing1,YU Bing1,ZHU Li-ping2.1.Department of Oncological Surgery,the Second Affiliated Hospital of Xinjiang Medical University,Urumqi 830011,Xinjiang,CHINA;2.Department of Breast Surgery,Cancer Hospital Affiliated to Xinjiang Medical University,Urumqi 830011,Xinjiang,CHINA
ObjectiveTo assess the influencing factors of response to neoadiuvant chemotherapy(NAC)in Xinjiang Uighur females with breast cancer.MethodsThe clinical data of 87 Xinjiang Uighur females with breast cancer undergoing NAC from January 2010 to June 2014 were retrospectively studied.Estrogen receptor(ER),progesterone receptor(PR),human epidermal growth factor receptor 2(Her-2),proliferation index of Ki-67 were investigated by immunohistochemistry.The role of age,menopausal status,body mass index(BMI),tumor size,axillary lymph node status,clinical stage,number of NAC cycles,molecular subtype for evaluating pathological complete response (pCR)rate and clinical effective rate[complete response(CR)+partial response(PR)]were analyzed.ResultsAfter NAC,the total clinical effctive rate(CR+PR)was 85.06%(74/87),with stable disease(SD)rate of 11.49%(10/87), progressive disease(PD)rate of 3.45%(3/87),pCR rate of 14.94%(13/87).The clinical effective rate(CR+PR)was associated with the expression of hormone receptor(ER and PR),Ki-67 index and molecular subtype:the clinical efficacay was better with HR negative,high Ki-67 index(>20%),BMI<25 kg/m2,non-luminal A than HR positive,low Ki-67 index(<20%),BMI≥25 kg/m2,luminal A.NAC cycles>4 cycles was an independent factor for predicting pCR after NAC(P=0.004,OR=0.081;95%CI:0.015~0.441).ConclusionPatients with hormone receptor negative(ER, PR),high Ki-67 index(>20%),non-luminal A,BMI<25 kg/m2have a higher clinical effective rate(CR+PR).The pCR rate is higher with hormone receptor nagative,NAC cycles>4 cycles,and NAC cycles>4 cycles is an independent factor for predicting pCR after NAC.
Xinjiang region;Uighur;Breast cancer;Neoadjuvant chemotherapy;Pathologic complete response
R737.9
A
1003—6350(2015)07—0963—04
10.3969/j.issn.1003-6350.2015.07.0345
2014-09-28)
丁 冰。E-mail:307879852@qq.com
