肾癌患者手术前后血清miRNA-21的差异表达及意义
2015-04-13阿不都热扎克木拉提热夏提王文光哈木拉提吐送闫昆吾王玉杰
杨 益,阿不都·热扎克,木拉提·热夏提,王文光,哈木拉提·吐送,闫昆吾,王玉杰
(新疆医科大学第一附属医院泌尿外科,新疆 乌鲁木齐 830054)
肾癌患者手术前后血清miRNA-21的差异表达及意义
杨 益,阿不都·热扎克,木拉提·热夏提,王文光,哈木拉提·吐送,闫昆吾,王玉杰
(新疆医科大学第一附属医院泌尿外科,新疆 乌鲁木齐 830054)
目的 观察血清miRNA-21在肾癌患者中表达的差异,以筛选肾癌术后检测指标。方法提取32例肾癌患者(术前一次,术后6个月一次)、20例健康人群(对照组)及15例肾脏良性肿瘤患者血清,采用实时荧光定量聚合酶链反应(RT-qPCR)测量miRNA-21在各组的差异表达。结果不同民族、性别和年龄水平的肾癌术前患者,其血清miRNA-21的表达比较差异均无统计学意义(P>0.05),而血清miRNA-21在肾癌术前组、对照组及肾脏良性肿瘤组之间比较差异有统计学意义(Z=27.658,P=0.001),两两比较结果显示:肾癌术前组与对照组比较(Z=肾细胞癌;微小RNA;血清;生物标志物5.072,P=0.000)、肾癌术前组与良性肿瘤组比较(Z=-2.5,P=0.012)、良性肿瘤与对照组比较(Z=-2.439,P=0.014)差异均有统计学意义;血清miRNA-21在肾癌术前和术后6个月之间比较差异有统计学意义(Z=-2.674,P=0.007);血清miRNA-21在肾癌术前组中高表达(术前组中位数0.34,良性肿瘤组中位数0.15,对照组中位数0.06),血清miRNA-21在肾癌术后6个月的表达呈下调趋势(术前中位0.34,术后6个月中位数0.15)。miRNA-21筛查肾癌的敏感度为90%、特异度为84.4%,ROC曲线下面积(AUC)为0.92。结论血清miRNA-21在肾癌患者中高表达,其有可能成为肾癌诊断、术后检测的生化标志物。
肾细胞癌;微小RNA;血清;生物标志物
微小RNA(miRNA)是一类新的、非蛋白编码的单链RNA,通过与靶基因mRNA非翻译区(3'UTR)完全互补或部分互补结合达到靶基因翻译抑制或降解作用[1]。1993年,miRNA被首次发现。经过多年努力,miRNA作用机制及功能研究方面取得重大突破,成为生命科学领域重大前沿之一。多项研究表明[2-7],miRNA在生理、病理过程中尤其在肿瘤的发生、发展过程中均起到调节作用,其在肿瘤组织中异常表达已广泛报道:miRNA成为肿瘤重要的调节因子,对细胞增殖、细胞周期控制、逃避细胞凋亡、组织侵袭及转移、血管形成及无限复制潜力均起到重要的调节作用,并且据报道,miRNA可能成为多种癌症的肿瘤标志物[8-9]。迄今已在包括肾癌等的多种癌症中发现特定的miRNA表达谱,其表现为高、低表达[1,10-11]。但上述这些研究主要局限在通过有创的穿刺或者手术得到癌症组织与癌旁正常组织,分析其miRNA情况,而对于血清、血液miRNA研究比较少见。已有报道称,miRNA在血浆、血清和其他体液中表达有一定丰度,此外,血液中miRNA的表达量在男性、女性以及不同年龄阶段相似[12]。miRNAs不仅在血清中具有可测量的丰度,而且具有非常良好的稳定性,不易受温度、酸碱度、放置时间长短影响[13]。这些血清miRNA作为一种新的生物标志物,表现出极大的潜力。因此我们应用RT-qPCR分析比较血清miRNA-21在肾癌患者术前与术后6个月的差异,初步探讨miRNA-21能否成为肾癌术后的检测指标。
1 资料与方法
1.1 一般资料 采取随机数表法,抽取2011年11月至2012年12月新疆重大疾病资源生物样本库保存的原发性肾癌患者术前及术后6个月血清标本各32例以及肾脏良性肿瘤患者血清标本15例(所取标本均经新疆医科大学第一附属医院伦理委员会批准,并获得患者知情同意)。肾癌患者术前组、肾脏良性肿瘤组抽血前均未行放化疗、手术切除和介入等任何相关治疗。肾癌患者男性18例,女性14例;汉族20例,维吾尔族12例;年龄34~72岁,中位年龄65岁;>50岁19例,≤50岁13例。肾脏良性肿瘤组男9例,女6例;年龄22~43岁,中位年龄33岁。健康对照组来源于本院体检中心,名族、年龄、性别比例均与肾癌组相匹配。
1.2 方法 (1)使用一次性真空采血管采集血清,收集受试者空腹外周血3~5 ml,室温静置15~30 min,4℃离心10 min,小心吸取上清液到洁净1.5 ml离心管,3 h内分离血清,-80℃冰箱保存。(2)miRNA分离,按照miRcute miRNA提取分离试剂盒(离心柱型)说明书严格操作,使用紫外分光光度仪测定浓度,-80℃冰箱保存待用。(3)miRNA逆转录:首先miRNA 3'末端进行加Poly(A)处理,其次Poly(A)修饰的miRNA进行逆转录,两阶段设置37℃60 min,合成的cDNA反应液放置-20℃保存待用。(3)RT-qPCR取适量上述cDNA放入去RNase的PCR管中,参照TIANGEN BIOTECH公司SYBRGreen荧光定量PCR检测试剂盒说明书加入上下游引物、2×SYBR Green PCR Master Mix,无RNase H2O配成20µl反应体系。将配好的反应体系放入Icycler IQ/Q5 PCR仪系统中,设置反应程序参数:94℃2 min,94℃20 s,60℃34 s,共40个循环。每个样本重复2次,记录每个PCR管中荧光信号达到设定的阈值时所循环的次数即CT值。以miRNA-16为内参照,根据Schmittgen等[14]采用的相对定量法计算,F=2-△ct,△ct=ctmiRNA-21-ctmiRNA-16,F表示目标基因表达量相对于同一样本miRNA-16的变化倍数。
1.3 统计学方法 采用SPSS18.0软件进行统计学分析,资料非正态,方差不齐,多个样本比较采用非参数Kruskkal-WallisH秩和检验,两两比较采用Wilcoxon秩和检验,术前、术后比较采用自身配对Wilcoxon符号秩和检验。使用Medcalc计算敏感度、特异度及其曲线下面积(ROC)。miRNA-21与临床资料关系采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-21和miRNA-16的扩增曲线和溶解曲线 图1为miRNA-21和miRNA-16部分扩增曲线,图2为它们的溶解曲线,溶解曲线均为单峰,说明扩增产物特异,无其他产物及二聚体。
图1 miRNA部分扩展曲线
图2 miRNA部分溶解曲线
2.2 三组受试者的血清miRNA-21表达比较 肾癌术前组患者的血清miRNA-21表达为0.344 (0.211,0.511);肾脏良性肿瘤组患者的miRNA-21表达为0.15(0.062,0.364);健康对照组miRNA-21表达为0.669(0.019,0.140)。三组的血清miRNA-21表达差异有统计学意义(P<0.05);三者之间两两比较差异均有统计学意义(P<0.05)。
2.3 血清miRNA-21在肾癌患者术前与术后6个月组中的差异 肾癌术前组患者的血清miRNA-21为0.344(0.211,0.511);肾癌术后组患者的miRNA-21为0.148(0.044,0.440)。肾癌患者术前与肾癌术后6个月组差异有统计学意义(P<0.05),miRNA-21相对水平在术后降低,接近肾脏良性肿瘤组。
2.4 血清miRNA-21的表达水平对肾癌患者的诊断效率 利用Medcalc软件得出最佳诊断分界点,计算miRNA-21筛查肾癌的敏感度为90%、特异度为84.4%(见图3)。ROC曲线下面积(AUC)为0.92,95%置信区间(0.812,0.977),AUC假设检验P<0.001为差异有统计学意义。
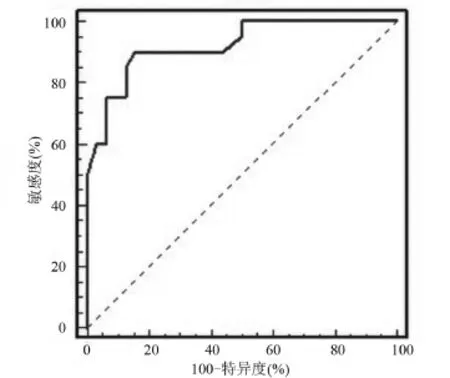
图3 miRNA-21受试者工作曲线
3 讨论
肾细胞癌(RCC)是泌尿系统常见肿瘤,占成人恶性肿瘤的3%左右,死亡率在40%以上[15-16]。通常,肾癌早期无临床症状,并缺乏早期诊断方法。目前,手术切除仍是肾癌唯一的治疗方法,根治性肾切除术后,还存在20%~40%的复发率。目前临床上仍无标准血清生物标志物,用来诊断肾癌或发现早期复发患者。据文献报道,虽然现存几种血清蛋白可用于晚期或复发性肾癌的检测[17],但不具备标准分子标记物的特异性及敏感性特征。因此寻找一种无创可行的早期诊断方法对临床工作及其重要。
本研究前期根据生物信息学及国内外研究进展做了大量筛选工作。已有文献报道,在多种肿瘤中(甲状腺癌、乳腺癌、胶质母细胞瘤、食管鳞状癌、胆管癌、大肠癌、宫颈癌),miRNA-21是表达上调最频繁的miRNA之一,其表达在肿瘤组明显高于健康对照组[18-23]。MiRNA-21参与形成RAS致癌信号,转录诱导AP1下游的RAS基因,并发挥其致癌基因的致癌作用[24]。肾癌由多种基因调控紊乱导致,其具体机制尚不清楚,可能是以一种或多种致癌基因上调作用为主导或以一种或多种抑癌基因下调作用为主导,也可能是一种或多种致癌基因与一种或多种抑癌基因的共同主导作用联合导致。张涛等[25]报道肾癌有关的下调抑癌基因有VHL(Von Hippel-Lindau)、p53和p16;与肾癌有关的上调原癌基因有myc基因家族。
本实验应用miRNA-16作为内参基因,对靶基因进行归一化处理,减少目标基因个体化差异。分析结果显示:首先,血清miRNA-21在肾癌患者的表达高于健康对照和肾脏良性肿瘤组,因此我们猜想血清miRNA-21在肾癌患者的高表达可能与肾癌的发生有关。2013年,Dey等[26]的相关文献报道,miRNA-21不仅在肾癌中表达上调,而且调节肾癌细胞的增殖和侵袭,在此基础上得知,PTEN可能是miR-21的下游靶基因,由此,miR-21在人体外的作用也得到研究证实。其次,血清miRNA-21在肾癌患者术后的表达低于术前患者。很多研究表明miRNA-21是致癌基因,其表达增大到一定阈值可能发生肾癌。本研究认为,肾癌患者术后、放化疗、免疫治疗及基因治疗后,当血清miRNA-21的表达低于某一限定值时,即可判定预后转归情况,从而达到临床评估肾癌患者治疗效果和预测复发转移的目的。根据Medcalc软件得出的诊断试验结果表明,血清miRNA-21在筛查肾癌时具有较高的敏感度和特异度,由AUC>0.9,我们得出结论:血清miRNA-21具有较高的筛查价值。
血清miRNA不仅有理由成为肾癌诊断、预测疗效的生物标志物,而且在肿瘤的基因治疗中拥有良好前景。相信不远的将来,血清miRNA成为癌症的“金标准”时代会成为现实。尽管如此,本研究仍存在一些局限性。考虑在以后实验中增加样本量、随访时间以及采用多中心挑取样本。并且本课题在确定血清miRNA-21可能致癌的表达阈值研究方面仍需更多努力。
[1]Slaby O,Jancovicova J,Lakomy R,et al.Expression of miRNA-106b in conventional renal cell carcinoma is a potential marker for prediction of early metastasis after nephrectomy[J].Journal of Experimental&Clinical Cancer Research:CR,2010,29:90.
[2]Croce CM.Causes and consequences of microRNA dysregulation in cancer[J].Nature Reviews Genetics,2009,10(10):704-714.
[3]Zimmerman AL,Wu S.MicroRNAs,cancer and cancer stem cells [J].Cancer Letters,2011,300(1):10-19.
[4]王 伟,李 覃,石理华,等.微小核糖核酸-34a在膀胱癌组织中表达的临床意义[J].中华泌尿外科杂志,2012,33(12):939-942.
[5]解 鹏,徐 锋,程 文,等.肿瘤浸润相关性微小RNA在膀胱尿路上皮癌中表达的初步研究[J].中华泌尿外科杂志,2012,33(7): 540-543.
[6]任海林,孙 岩,李世斌,等.膀胱尿路上皮癌细胞株E2F3基因与miR-17-5p和miR-20a的相互作用[J].中华泌尿外科杂志,2012, 33(4):264-267.
[7]吴 静,石志豪,方克伟.miRNA与前列腺癌关系的研究[J].中华泌尿外科杂志,2012,33(7):554-555.
[8]Corcoran C,Friel AM,Duffy MJ,et al.Intracellular and extracellular microRNAs in breast cancer[J].Clinical Chemistry,2011,57(1): 18-32.
[9]Bartels CL,Tsongalis GJ.MicroRNAs:novel biomarkers for human cancer[J].Clinical Chemistry,2009,55(4):623-631.
[10]Slaby O,Svoboda M,Michalek J,et al.MicroRNAs in colorectal cancer:translation of molecular biology into clinical application[J]. Molecular cancer,2009,8:102.
[11]Redova M,Svoboda M,Slaby O.MicroRNAs and their target gene networks in renal cell carcinoma[J].Biochemical and Biophysical Research Communications,2011,405(2):153-156.
[12]Taylor DD,Gercel-Taylor C.MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer[J].Gynecologic Cncology,2008,110(1):13-21.
[13]周素丽,郑智国,毛伟敏.血清中微小RNA作为肿瘤标记物的研究进展[J].国际肿瘤学杂志,2009,36(8):566-568.
[14]Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method[J].Nature protocols,2008,3(6): 1101-1108.
[15]Yi Z,Fu Y,Zhao S,et al.Differential expression of miRNA patterns in renal cell carcinoma and nontumorous tissues[J].Journal of Cancer Research and Clinical Oncology,2010,136(6):855-862.
[16]Chow TF,Youssef YM,Lianidou E,et al.Differential expression profiling of microRNAs and their potential involvement in renal cell carcinoma pathogenesis[J].Clinical Biochemistry,2010,43 (1-2):150-158.
[17]Ljungberg B.Prognostic markers in renal cell carcinoma[J].Current Opinion in Urology,2007,17(5):303-308.
[18]Yao T,Lin Z.MiR-21 is involved in cervical squamous cell tumorigenesis and regulates CCL20[J].Biochimica Et Biophysica Acta, 2012,1822(2):248-260.
[19]Kumar S,Keerthana R,Pazhanimuthu A,et al.Overexpression of circulating miRNA-21 and miRNA-146a in plasma samples of breast cancer patients[J].Indian Journal of Biochemistry&Biophysics,2013,50(3):210-214.
[20]Ilhan-Mutlu A,Wagner L,Wohrer A,et al.Plasma microRNA-21 concentration may be a useful biomarker in glioblastoma patients [J].Cancer Investigation,2012,30(8):615-621.
[21]Horiuchi A,Iinuma H,Akahane T,et al.Prognostic significance of PDCD4 expression and association with microRNA-21 in each Dukes'stage of colorectal cancer patients[J].Oncology Reports, 2012,27(5):1384-1392.
[22]Liu CZ,Liu W,Zheng Y,et al.PTEN and PDCD4 are bona fide targets of microRNA-21 in human cholangiocarcinoma[J].Chinese Medical Sciences Journal,2012,27(2):65-72.
[23]Cai EH,Gao YX,Wei ZZ,et al.Serum miR-21 expression in human esophageal squamous cell carcinomas[J].Asian Pacific Journal of Cancer Prevention:APJCP,2012,13(4):1563-1567.
[24]Lee SK,Calin GA.Non-coding RNAs and cancer:new paradigms in oncology[J].Discovery Medicine,2011,11(58):245-254.
[25]张 涛,罗志刚.肾癌的基因研究进展[J].当代医学,2011,17(9): 25-26.
[26]Dey N,Das F,Ghosh-Choudhury N,et al.microRNA-21 governs TORC1 activation in renal cancer cell proliferation and invasion[J]. PLoS One,2012,7(6):e37366.
Differential expression of serum miRNA-21 in patients with renal cell carcinoma before and after surgery and its significance.
YANG Yi,ABUDU·Rezake,MULATI·Rexiati,WANG Wen-guan,HAMULATI·Tusong,YAN Kun-wu, WANG Yu-jie.Department of Urology,the First Hospital of Xinjiang Medical University,Urumqi 830054,Xinjiang,CHINA
ObjectiveTo investigate the changes in expression of serum miRNA-21 in patients with renal cell carcinoma(RCC)before and after surgery,and to identify detection indexes for renal cell carcinoma after surgery.MethodsThe expression of serum miRNA-21 was detected by real-time quantitative polymerase chain reaction (RT-qPCR)in a larger cohort,including 32 RCC patients(RCC group),20 healthy individuals(control group)and 15 patients with benign renal tumor(benign tumor group).The RCC patients were detected preoperatively and 6 months postoperatively.ResultsAmong RCC patients,there was no statistically significant differences in serum miRNA-21 expression between different ethnicity,gender and age(P>0.05).Significant differences existed in preoperative RCC patients,controls and patients with benign renal tumor(Z=27.536,P<0.001).Paired comparisons showed statistically significant differences between preoperative RCC patients and the controls(Z=-5.072,P<0.001),preoperative RCC patients and patients with benign renal tumor(Z=-2.5,P<0.012),controls and patients with benign renal tumor (Z=-2.439,P<0.014).Between preoperative and postoperative RCC patients,significant difference was found (Z=-2.684,P<0.007).Serum miRNA-21 expression level revealed an up-regulation in preoperative RCC patients(preoperative RCC group,with a median of 0.34;benign renal tumor group,0.15;control group,0.06),but it a down-regulation in postoperative RCC patients(preoperative RCC group,with a median of 0.34,postoperative RCC group, 0.15).As a biochemical marker,miRNA-21 has sensitivity of 90%,specificity of 84.4%,with an area under the ROC curve(AUC)of 0.92.ConclusionThe differences of serum miRNA-21 expression in a larger cohort(32 RCC patients,20 controls and 15 patients with benign renal tumor)are statistically significant.Therefore,serum miRNA-21 is expected to become a biochemical marker for the diagnosis and post-operational determination of RCC.
Renal cell carcinoma;miRNA;Serum;Biomarkers
R737.11
A
1003—6350(2015)07—0948—04
10.3969/j.issn.1003-6350.2015.07.0340
2014-10-22)
新疆维吾尔自治区自然科学基金(编号:2013211A101)
王玉杰。E-mail:wangyj-mr@vip.sina.com
