金雀异黄素抑制肝癌干细胞样细胞的特性及对氟尿嘧啶耐药性的影响
2015-04-13唐纯娜贺更生
李 翀,唐纯娜,贺更生
(南华大学附属第一医院普外科,湖南 衡阳 421001)
金雀异黄素抑制肝癌干细胞样细胞的特性及对氟尿嘧啶耐药性的影响
李 翀,唐纯娜,贺更生
(南华大学附属第一医院普外科,湖南 衡阳 421001)
目的 研究金雀异黄素对SMMC-7721细胞系肝癌干细胞样细胞特性以及氟尿嘧啶敏感性的影响。方法不同浓度金雀异黄素处理SMMC-7721细胞系球形成细胞。肿瘤球形成法检测自我更新能力。MTT比色法测定氟尿嘧啶药物敏感性。Western blot分析干细胞标志物CD133、CD44、Gli1和ABCG2蛋白表达。结果金雀异黄素显著抑制SMMC-7721细胞肿瘤球形成,并优先抑制球形成细胞增殖活性(P<0.05)。金雀异黄素(10 μmol/L)有效逆转球形成细胞对氟尿嘧啶的耐药性。金雀异黄素降低CD133、CD44、Gli1和ABCG2蛋白表达水平。结论金雀异黄素抑制肝癌干细胞样细胞特性和氟尿嘧啶耐药性,其作用机制与抑制干细胞标志物蛋白表达和阻断Hedgehog信号传导有关。
肝细胞癌;肿瘤干细胞;金雀异黄素;多药耐药
金雀异黄素(4',5,7-三羟基异黄酮)是大豆制品的主要异黄酮化合物。过去几十年的实验研究已经有力证明,金雀异黄素对多种癌细胞包括乳腺癌、前列腺癌、卵巢癌和肝癌细胞具有抑制作用[1]。已经证明,金雀异黄素可以调节与细胞凋亡和细胞周期有关的基因,有望成为一种抑制肿瘤发生的化学预防药物[2]。此外,研究显示金雀异黄素抑制肿瘤转移的作用,展示其在抑制肿瘤发生和演进方面的多效性[3]。迄今为止,金雀异黄素对癌症抑制的作用机制并未完全阐明。
与大体肿瘤细胞不同,肿瘤干细胞被认为是肿瘤组织中一小群干细胞样特性的细胞,具有启动肿瘤生长、自我更新和耐药性的性质,从而引起肿瘤复发[4]。因此,寻找一种抑制肿瘤干细胞自我更新和逆转耐药性的药物,可能为癌症的治疗提供一种新策略。本文主要研究金雀异黄素对SMMC-7721细胞系肝癌干细胞样细胞特性以及氟尿嘧啶敏感性的影响。
1 材料与方法
1.1 细胞培养与试剂 肝癌细胞系SMMC-7721从上海中国科学院细胞库(中国上海市)购得。SMMC-7721细胞生长在添有10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养基中,置于5%CO2、37℃的培养箱培养。金雀异黄素购自美国Sigma公司,MTT购自Sigma公司。胎牛血清购自美国Hyclone公司。胰蛋白酶和二甲基亚砜(DMSO)购自美国Amersco公司。
1.2 肿瘤球形成法 参照文献[4]描述的方法,用无血清干细胞培养基[含20 ng/ml表皮细胞生长因子EGF,Peprotech)、10 ng/ml重组人碱性成纤维细胞生长因子bFGF,Peprotech)、1XB27(Invitrogen)和0.4 μg/ml胰岛素(Peprotech)]的DMEM/F12(Invitrogen)培养基悬浮肝细胞癌SMMC-7721细胞系细胞,5 000细胞/孔的密度接种6孔超低粘附培养板(BD公司)。培养6 d,在显微镜下可见肿瘤球形成细胞(SFCs),胰蛋白酶-EDTA消化,并计数。
1.3 肿瘤球形成率测定与药物处理 为了测定肿瘤球形成率,细胞以1 000个/孔的密度接种于24孔超低粘附培养板(BD公司)。培养6 d,计数肿瘤球数。肿瘤球形成率=每孔肿瘤球均数/每孔接种活细胞数(1000)×100%。为了分析金雀异黄素对SMMC-7721球形成细胞自我更新的影响,加入含金雀异黄素(10μmol/L)的干细胞条件培养基培养基。
1.4 药物敏感性试验 参照文献[5]描述的方法,应用MTT(Cell titer 96®Aqueous One Solution Cell Proliferation Assay,Promega,Beijing,China)法测定细胞对药物的耐药指数。SMMC-7721细胞系细胞或球形成细胞(2×103/孔)接种于96孔板。存在或不存在金雀异黄素(10 μmol/L)处理24 h,用图2标示浓度氟尿嘧啶处理。72 h后,用自动化酶标仪(Bio-Rad 550)在550 nm处测定吸光度。相对细胞活性以百分率表示。
1.5 Western blot分析 参照文献[6]完成Western Blot分析。增强化学发光仪(Amersham Biosciences)检测信号。一抗包括:抗Gli1(美国Cell Signaling公司)、抗ABCG2(美国Millipore公司)、抗CD133(德国Miltenyi公司)、抗CD44抗体(美国Cell signaling公司)、鼠抗人β-catenin单克隆抗体和辣根过氧化物酶-结合的羊抗鼠二抗(美国Santa Cruz生物科技有限公司)。
1.6 统计学方法 数据表示为3次独立实验数据的均值±标准差(±s)。应用Windows软件系统(SPSS Inc,Chicago,IL)的SPSS 13.0对所有数据进行分析。Student'st-检验用于比较各组间的差异。双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 金雀异黄素抑制人肝细胞癌SMMC-7721细胞系肿瘤球形成能力 肿瘤球形成法检测结果表明,干细胞条件培养基悬浮培养人肝细胞癌SMMC-7721细胞系细胞能形成肿瘤球(图1A)。SMMC-7721球形成细胞传代培养结果显示:第3代球形成细胞的肿瘤球形成率最高(图1B),称为肝癌干细胞样细胞。金雀异黄素(10 μmol/L)孵育72 h显著降低SMMC-7721细胞系细胞和肝癌干细胞样细胞的胞肿瘤球形成率(图1C、1D)。
2.2 金雀异黄素逆转肝癌干细胞样细胞氟尿嘧啶(5-FU)耐药性 MTT比色测定的结果证明,肝癌干细胞样细胞耐受常规化疗药物氟尿嘧啶细胞毒作用,金雀异黄素(10 μmol/L)预孵育能有效降低氟尿嘧啶的化疗耐药性,见图2。
2.3 金雀异黄素下调肝癌干细胞样细胞干细胞标志物蛋白表达 Western blot分析结果证实:与人肝细胞癌SMMC-7721细胞系细胞比较,肝癌干细胞样细胞高表达干细胞标志物CD133和CD44蛋白;金雀异黄素(10 μmol/L)作用24 h显著降低肝癌干细胞样细胞CD133和CD44蛋白表达水平,见图3。
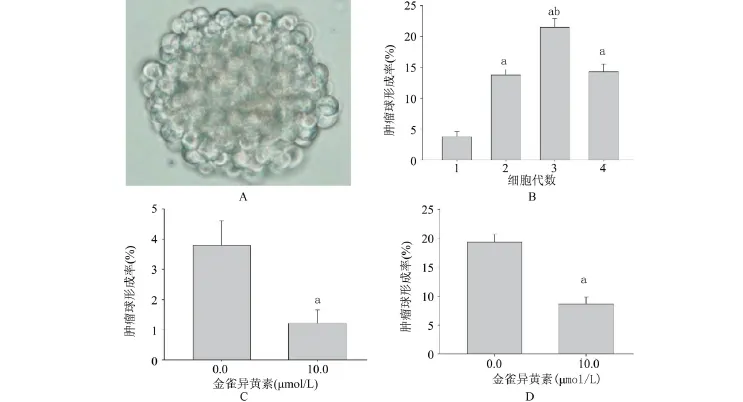
图1 金雀异黄素对SMMC-7721细胞系细胞(原代)和球形成细胞(第3代)肿瘤球形成率的影响

图2 金雀异黄素对SMMC-7721球形成细胞氟尿嘧啶敏感性的影响

图3 金雀异黄素对SMMC-7721球形成细胞干细胞标志物蛋白表达的影响
2.4 金雀异黄素抑制Gli1和ABCG2蛋白表达 Western blot分析结果证实:与人肝细胞癌SMMC-7721细胞系细胞相比,肝癌干细胞样细胞高表达Gli1和ABCG2蛋白,见图4;金雀异黄素(10 μmol/L)作用24 h明显下调肝癌干细胞样细胞Gli1和ABCG2蛋白表达。

图4 金雀异黄素对SMMC-7721球形成细胞Gli1和ABCG2蛋白表达的影响
3 讨论
金雀异黄素是大豆制品中的主要异黄酮化合物,已经发现其具有抑制多种肿瘤细胞生长的作用。肿瘤干细胞学说认为肿瘤干细胞是导致肿瘤患者复发的主要原因[7]。笔者推测,金雀异黄素抑制肿瘤干细胞特性可能是预防肿瘤发生的潜在机制。在我们的实验细胞模型中SMMC-7721球形成细胞高表达干细胞标记物CD133和CD44蛋白。本实验结果证明,金雀异黄素抑制SMMC-7721球形成细胞自我更新能力。与其抑制效应一致,金雀异黄素下调SMMC-7721球形成细胞CD133和CD44表达。
肿瘤干细胞的另一个特性是化疗耐药性[8]。我们的结果显示,金雀异黄素增强SMMC-7721球形成细胞对5-氟尿嘧啶和顺铂的化疗敏感性。化疗敏感性与ABCG2有关。金雀异黄素抑制ABCG2蛋白表达。同时,金雀异黄素抑制肿瘤球形成。我们的结果与其他报道相一致,ABCG2不仅仅在多药耐药中发挥主要作用,而且也是肿瘤干细胞特征性标记物[9]。
Hedgehog(Hh)信号传导在哺乳动物发育和干细胞维持中具有重要作用[10]。Hh通路的活化从通过Hh配体结合其细胞表面受体Patched(Ptc)开始,然后,导致效应蛋白、G蛋白耦联受体和Smoothened(Smo)抑制的解除[10]。最后,Smo活化Gli家族转录因子及其靶基因。Hh/Gli信号失调涉及到多种肿瘤发生和演进,例如,Gli1基因在人神经胶质瘤扩增和基底细胞癌活化[11]。鼠Gli1的转基因过表达导致基底细胞癌的发展[11],已经证实在肝细胞癌细胞和组织中存在Gli1活化[12]。最近的研究表明ATP-结合盒运转G家族蛋白成员2(ABCG2)是一个Hh/Gli信号的直接转录靶分子[13]。本文的实验结果显示,金雀异黄素处理导致Gli1蛋白表达下调。因此,笔者推测,金雀异黄素抑制肝癌干细胞样细胞特性和氟尿嘧啶耐药性,其作用机制与抑制干细胞标志物蛋白表达和阻断Hh信号传导有关。
[1]Banerjee S,Li Y,Wang Z,et al.Multi-targeted therapy of cancer by genistein[J].Cancer Lett,2008,269(2):226-242.
[2]Peterson G,Barnes S.Genistein inhibits both estrogen and growth factor-stimulated proliferation of human breast cancer cells[J].Cell Growth Differ,1996,7(10):1345-1351.
[3]Farina HG,Pomies M,Alonso DF,et al.Antitumor and antiangiogenic activity of soy isoflavone genistein in mouse models of melanoma and breast cancer[J].Oncol Rep,2006,16(4):885-891.
[4]Ren KQ,Cao XZ,Liu ZH,et al.8-bromo-5-hydroxy-7-methoxychrysin targeting for inhibition of the properties of liver cancer stem cells by modulation ofTwist signaling[J].Int J Oncol,2013,43(5):1719-1729.
[5]Huang W,Wan C,Luo Q,et al.Genistein-inhibited cancer stem cell-like properties and reduced chemoresistance of gastric cancer [J].Int J Mol Sci,2014,15(3):3432-3443.
[6]周 蓓,肖立红,肖 荞,等.8-溴-7-甲氧基白杨素对Huh-7细胞系肝癌干细胞样细胞自我更新的影响[J].湖南师范大学学报(医学版),2013,3(1):10-14.
[7]Clarke MF,Dick JE,Dirks PB,et al.Cancer stem cells-Perspectives on current status and future directions:AACR Workshop on cancer stem cells[J].Cancer Res,2006,66(19):9339-9344.
[8]Soh SX,Lim JY,Huang JW,et al.Multi-agent chemotherapy overcomes glucocorticoid resistance conferred by a BIM deletion polymorphism in pediatric acute lymphoblastic leukemia[J].PLoS One, 2014,9(8):e103435.
[9]Liu J,Ma L,Xu J,et al.Co-expression of CD44and ABCG2 in spheroid body-forming cells of gastric cancer cell line MKN45[J]. Hepatogastroenterology,2013,60(125):975-980.
[10]Ingham PW,Nakano Y,Seger C.Mechanisms and functions of Hedgehog signalling across the metazoan[J].Nat Rev Genet,2011,12(6): 393-406.
[11]Nilsson M,Unden AB,Krause D,et al.Induction of basal cell carcinomas and trichoepitheliomas in mice overexpressing GLI-1[J]. Proc NatlAcad Sci USA,2000,97(7):3438-3443.
[12]Jeng KS,Sheen IS,Jeng WJ,et al.Activation of the sonic hedgehog signaling pathway occurs in the CD133positive cells of mouse liver cancer Hepa 1-6 cells[J].Onco Targets Ther,2013,6:1047-1055.
[13]Zhang S,Wang Y,Mao JH,et al.Inhibition of CK2αdown-regulates Hedgehog/Gli signaling leading to a reduction of a stem-like side population in human lung cancer cells[J].PLoS One,2012,7 (6):e38996.
Inhibition of genistein on characteristics of liver cancer stem-like cells and its effect on fluorouracil-resistance.
LI Chong,TANG Chun-na,HE Geng-sheng.Department of General Surgery,the First Affiliated Hospital,University of South China,Hengyang 421001,Hunan,CHINA
ObjectiveTo investigate the effects of genistein on the characteristics of liver cancer stem-like cells(LCSLCs)derived from SMMC-7721 cell line and the sensitivity to fluorouracil.MethodsSphere-forming cells(SFCs)from SMMC-7721 cell line were treated with various concentrations of genistein.The capability of self-renewal was tested using tumor sphere-forming assay.The sensitivity to fluorouracil was determined by MTT assay.And the protein expression of stem cell markers CD133,CD44,Hedgehog(Hh)signal effector Gli1 and its target molecule ABCG2 was analyzed using Western blot.ResultsGenistein significantly inhibited the capability of sphere-forming in SMMC-7721 SFCs and relative selectively suppressed the proliferation activity of SFCs(P<0.05). Genistein(10 μ mol/L)could effectively reverse the resistance of SFCs to fluorouracil.And genistein could also down-regulate the protein expression of CD133,CD44,Gli1 and ABCG2.ConclusionGenistein inhibits characteristics of liver cancer stem cells and resistance to Fluorouracil,and its mechanism is likely involved in inhibiting protein expression of stem cell markers and obstructing Hh signal pathway.
Liver cancer;Cancer stem cells;Genistein;Multidrug resistance
R735.7
A
1003—6350(2015)08—1108—04
10.3969/j.issn.1003-6350.2015.08.0397
2014-10-09)
贺更生。E-mail:gengshenghe@Yahoo.com.cn
