超声辅助双水相体系提取牛大力总黄酮的研究
2015-04-13李维峰王娅玲黄艳丽高云涛
李维峰++王娅玲++黄艳丽++高云涛

摘 要 利用超声耦合乙醇-硫酸铵双水相萃取技术提取牛大力总黄酮。通过单因素实验和正交实验对影响牛大力总黄酮提取的料液比、硫酸铵浓度、乙醇浓度和超声时间等因素进行探讨,以建立牛大力总黄酮的提取工艺。结果显示:影响牛大力总黄酮提取因素的主次顺序为料液比>乙醇浓度>硫酸铵浓度>超声时间;最优提取条件为乙醇浓度80%、料液比1∶40(m∶V)、超声时间50 min、硫酸铵浓度为0.3 g/mL,在此条件下,牛大力总黄酮得率为5.82 mg/g。
关键词 双水相 ;牛大力 ;总黄酮 ;超声耦合
分类号 R284.2
牛大力(Millettia Specisoa Champ.),别名山莲藕、大力薯、金钟根、猪脚笠,为豆科植物崖豆藤属植物美丽崖豆的块根,具有清热止咳、舒筋活络、补肺滋阴等功效,用于治疗肾虚、跌打损伤、慢性肝炎、肺虚咳嗽等[1]。相关研究表明,牛大力中富含挥发油、黄酮、木脂素、多糖等活性成分[2-5],但关于牛大力中总黄酮化合物的提取研究报道较少[6]。
双水相提取技术始于20世纪60年代,是利用物质在互不相容的两相中分配系数的不同来进行提取分离的方法[7],传统聚合物与无机盐形成的双水相体系因为聚合物粘度较大,导致成本较高,提取物的后续处理比较困难等缺点,最近发展由低级醇如乙醇、丙醇与盐组成双水相体系[8-10],该法具有提取分离条件温和、过程易于应用于实际生产、生物适应性广等优点,被广泛应用于生物提取、天然产物分离、食品化工等行业[11-14]。本研究拟采用超声耦合乙醇-水-硫酸铵双水相提取牛大力总黄酮,并通过单因素实验和正交实验对提取条件进行优化,为牛大力中总黄酮的提取开发利用提供基础。
1 材料与方法
1.1 材料
1.1.1 试验材料
牛大力饮片(广州南北行中药饮片有限公司)采购自广东省河源市,干燥后粉碎过40目筛,冷藏备用。
1.1.2 试验试剂
芦丁标准品,国家标准物质中心;其他试剂均为国药集团分析纯试剂。
1.1.3 主要仪器
北京中兴伟业FW-200万能粉碎机;上海科导SK5210HP超声清洗仪,上海精科UV759紫外-可见分光光度计;梅特勒AL204电子分析天平;上海一恒DZF-6053真空干燥箱。
1.2 试验方法
1.2.1 乙醇-硫酸铵双水相体系制备
在硫酸铵溶液加入一定浓度的无水乙醇,利用硫酸铵的盐析作用形成双水相体系,并通过改变成相后乙醇的浓度和硫酸铵的浓度控制双水相体系的组成[15]。
1.2.2 标准曲线的绘制
总黄酮含量的测定采用分光光度法,配制0.2 mg/mL芦丁为标准溶液,分别取1.00、2.00、3.00、4.00、5.00、6.00 mL于25 mL比色管中,加入1 mL 5% NaNO2溶液,摇匀后放置6 min,然后加入1 mL 10% Al(NO3)3溶液,摇匀后放置6 min,再加入6 mL 4% NaOH溶液,用30%乙醇定容至刻度线[16],摇匀,放置15 min后于510 nm波长处测定吸光度,以吸光度为横坐标,芦丁浓度为纵坐标,绘制标准曲线,得到回归方程A=0.012 5x-0.003 5,相关系数R2=0.999 8。
1.2.3 样品总黄酮的提取
取1 g牛大力干粉于100 mL圆底烧瓶中,按照超声功率500 W,超声温度60℃[6],分别研究不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50、1∶60)、不同硫酸铵浓度(0.15、0.2、0.25、0.3、0.35、0.4 g/mL)、乙醇浓度(50%、60%、70%、80%、90%)、不同超声时间(10、20、30、40、50、60 min)对牛大力总黄酮提取率的影响。
1.2.4 正交实验设计
为了对提取工艺进行优化,在上述单因素实验基础上,选择浸提料液比、硫酸铵浓度、乙醇浓度和超声时间4个因素按照L9(34)设计四因素三水平实验(见表1)。
1.2.5 样品总黄酮的分析
取1 mL牛大力提取液,于25 mL比色管中,加入1 mL 5% NaNO2溶液,摇匀后放置6 min,然后加入1 mL 10% Al(NO3)3溶液,摇匀后放置6 min,再加入6 mL 4% NaOH溶液,用30%乙醇定容至刻度线[16],摇匀,放置15 min后于510 nm波长处测定吸光度,利用回归方程计算样品中总黄酮含量,并按照下面公式计算总黄酮得率。
总黄酮得率(%)=(提取液中总黄酮质量/原料质量)×100%
2 结果与分析
2.1 单因素影响试验
2.1.1 料液比对提取的影响
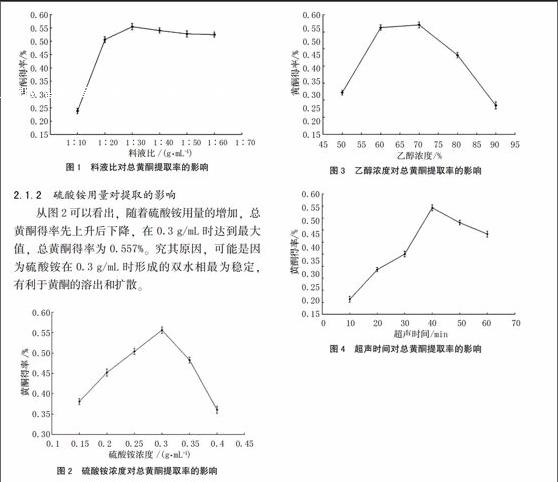
由图1可以看出,料液比直接影响牛大力总黄酮的得率,料液比过大或者过小都不利于总黄酮的提取,料液比过小,溶剂体积过少,黄酮类从样品扩散到溶剂中的速率低,而且极易达到饱和状态;料液比过大,不但会在加热过程中造成能源的浪费,更会因溶剂用量过多,硫酸铵用量增大,影响双水相的稳定性,从而导致总黄酮得率下降,因此选用1∶30(m∶V)为最佳料液比。
2.1.2 硫酸铵用量对提取的影响
从图2可以看出,随着硫酸铵用量的增加,总黄酮得率先上升后下降,在0.3 g/mL时达到最大值,总黄酮得率为0.557%。究其原因,可能是因为硫酸铵在0.3 g/mL时形成的双水相最为稳定,有利于黄酮的溶出和扩散。
2.1.3 乙醇浓度对提取的影响
乙醇浓度会影响双水相的组成及稳定性,进而对总黄酮得率产生影响。从图3可以看出,乙醇浓度为70%时,黄酮得率最高,达到5.72mg/g,过低的醇浓度不利于黄酮类化合物从植物细胞中溶解出来,而过高的醇浓度不易透过亲水性植物细胞壁。
2.1.4 超声时间对提取的影响
从图4可以看出,超声时间10~40 min总黄酮得率随超声时间的延长而提高,在40 min时达到最大值,之后继续超声提取得率会有所降低,可能是超声时间过长,黄酮类化合物部分氧化降解,从而导致提取得率下降,所以选定40 min为最佳超声时间。
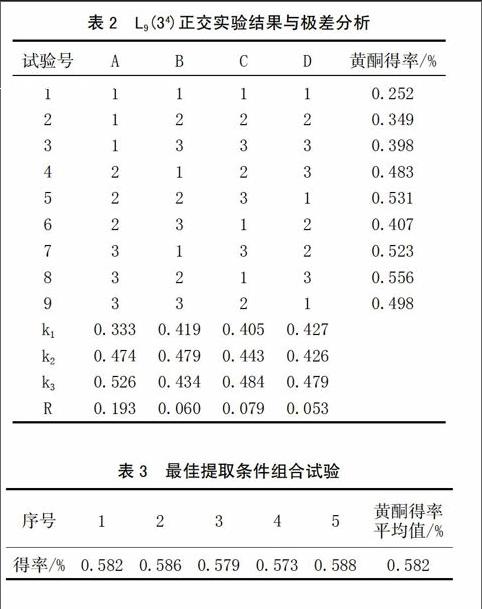
2.2 牛大力总黄酮提取工艺的正交实验结果
以牛大力总黄酮得率为评价指标,使用正交设计助手Ⅱ进行数据统计分析,实验结果见表2。
从表2中可以看出,牛大力总黄酮的提取得率受到超声时间、乙醇浓度、料液比、硫酸铵浓度4个因素的交叉影响,通过极差R值的比较可以看出,影响牛大力总黄酮提取得率因素的主次顺序为料液比>乙醇浓度>硫酸铵浓度>超声时间,牛大力总黄酮的超声辅助双水相提取最佳条件是A3B2C3D3,即料液比为1∶40(g/mL),硫酸铵浓度为0.3 g/mL,超声提取时间为50 min,乙醇浓度为60%。
2.3 最佳条件组合试验
根据正交试验优化条件,按照乙醇浓度为80%,硫酸铵浓度为0.3 g/mL配制双水相溶液,料液比为1∶40(g/mL),超声提取时间为50 min,牛大力总黄酮进行5次平行提取试验,实验结果见表3。
由表3可见,在上述最佳提取工艺下,采用超声耦合乙醇-硫酸铵双水相提取牛大力总黄酮,平均得率为5.82 mg/g,实验结果平均标准误(RSD)为1.02%。与前人研究中超声辅助乙醇溶液提取牛大力总黄酮方法相比,得率有明显的提高[6]。
3 结论
本文通过单因素试验和正交优化实验设计,将超声提取与乙醇-硫酸铵双水相分离技术耦合集成,研究了牛大力中总黄酮的提取最佳工艺,并通过试验验证最佳工艺下总黄酮的得率,发现在乙醇浓度为80%、硫酸铵浓度为0.3 g/mL配制双水相溶液、料液比为1∶40(g/mL)、超声提取时间为50 min的条件下,牛大力总黄酮平均得率可以达到5.82 mg/g,该工艺耗时短,提取工艺简单,比超声辅助单纯乙醇溶液提取黄酮的得率明显要高,具有很高的实际生产应用价值。
参考文献
[1] 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海:上海科学技术出版社,1999:571-572.
[2] 宗鑫凯,赖富丽,王祝年,等. 牛大力化学成分研究[J]. 中药材,2009,32(4):520-521.
[3] 王春华,王 英,王国才,等. 牛大力的化学成分研究[J]. 中草药,2008,39(7):972-975.
[4] 王祝年,赖富丽,王茂媛,等. 牛大力根的化学成分研究[J]. 热带作物学报,2011,32(12):2 378-2 380.
[5] 王呈文,陈光英,宋小平,等. 牛大力的化学成分研究[J]. 中草药,2014,45(11):1 515-1 520.
[6] 王呈文,纪明慧,舒火明,等. 牛大力总黄酮提取工艺及不同萃取物的抗氧化活性研究[J]. 化学研究与应用,2013,25(5):713-717.
[7] 陈秀娟,苏慧英,王光琴,等. 双水相分离纯化荷叶中黄酮类化合物[J]. 广东化工,2011,38(12):10-13.
[8] Liu Xiaohai, Gao Yuntao, Tang Runsheng, et al. On the extraction and separation of iodide complex of cadmium(Ⅱ) in propylalcohol ammonium sulfate aqueous biphasic system[J]. Sep Puri Tech, 2006, 50(2): 263-266.
[9] Gao Yuntao, Wang Wei. Distribution Behaviors of Pd(Ⅱ) in PrOH-(NH4)SO4 aqueous biphasic system and its application in determination of Pd(Ⅱ) [J]. Precious Metals, 2006, 27(3): 45-49.
[10] 高云涛,吴立生,王 伟. 丙醇-硫酸铵-水液-液体系萃取分离铂、钯、铑和金[J]. 分析化学,2001,29(8):901-903.
[11] Karakatsanis A, Liakopoulou-Kyriakides M. Comparison of PEG/fractionated dextran and PEG/industrial grade dextran aqueous two-phase systems for the enzymic hydrolysis of starch[J]. J Food Eng, 2007, 80(4): 1 213-1 217.
[12] Dallora N L P, Klem J G D, Pedro D A P F. Partitioning of model proteins in aqueous two-phase systems containing polyethylene glycol and ammonium carbamate[J]. Biochem Eng J, 2007, 34(1):92-97.
[13] 高云涛,王 伟. 金(Ⅲ)在聚乙二醇-硫酸铵双水相体系中的分配行为及萃取机理[J]. 应用化学,2002,19(6):578-581.
[14] Mokhtarani B, Karimzadeh R, Amini M H, et al. Partitioning of ciprofloxacin in aqueous two-phase system of poly(ethylene glycol) and sodium sulphate[J]. Biochem Eng J, 2008,38(2): 241-247.
[15] 李彩霞,高海宁,张喜峰,等. 超声辅助双水相体系提取国槐叶黄酮[J]. 天然产物研究与开发,2013,25(10):1387-1391.
[16] 张志良,翟伟箐. 植物生理学实验指导[M]. 北京:高等教育出版社,2003:173-175.
