化疗在胸腺肿瘤治疗中的临床价值:中国胸腺肿瘤研究协作组回顾性研究
2015-04-11马可韩泳涛陈克能方文涛中国胸腺肿瘤研究协作组
马可 韩泳涛 陈克能 方文涛 中国胸腺肿瘤研究协作组
化疗在胸腺肿瘤治疗中的临床价值:中国胸腺肿瘤研究协作组回顾性研究
马可1韩泳涛1陈克能2方文涛3中国胸腺肿瘤研究协作组4
目的 分析探讨化疗在胸腺肿瘤治疗中的临床应用价值。方法 回顾性分析中国胸腺肿瘤研究协作组(the Chinese Alliance of Research for Thymomas,ChART)数据库中1994年3月至2012年12月纳入的MasaokaⅢ/Ⅳa期及胸腺肿瘤化疗病例739例,初步评估不同模式化疗的临床价值,采用Kaplan-Meier法绘制不同亚组患者生存曲线,分析影响预后的因素。结果 Masaoka-Koga分期、手术的根治性和病理学类型是影响患者长期生存的主要因素。初始化疗有效率50.8%(30/59),客观缓解率11.9%(7/59)。初始化疗使R0切除率从66.6%(397/596)提高至72.9%(43/59)。Masaoka-KogaⅢ/Ⅳ期胸腺癌未术后化疗组与术后化疗组5年、10年生存率分别为71.0%、66.6%和53.5%、42.6%,两组间差异无统计学意义(χ2=0.003,P=0.953)。Masaoka-KogaⅣ期胸腺瘤未术后化疗组与术后化疗组5年生存率分别为85.7%、76.1%,两组间差异无统计学意义(χ2=0.030,P=0.862)。Masaoka-KogaⅢ胸腺瘤患者未术后化疗组和术后化疗组5年、10年生存率分别为92.1%、65.0%和88.1%、59.6%,未术后化疗组生存率显著优于术后化疗组(χ2=13.294,P=0.000)。Masaoka-KogaⅢ/Ⅳ期胸腺瘤R0切除后患者未术后化疗组和术后化疗组5年生存率分别为92.8%和67.2%,未术后化疗组生存率也显著优于术后化疗组(χ2=10.856,P=0.001)。结论 初始化疗有提高R0切除率趋势,术后化疗未能改善胸腺肿瘤的总体预后,对于MasaokaⅢ期胸腺瘤和局部晚期R0切除的胸腺肿瘤患者术后化疗无益。
胸腺肿瘤; 化疗; 手术; 预后
胸腺肿瘤临床少见,多发于前上纵隔,绝大多数患者经手术切除后可获得良好的疗效[1],但约1/ 3的胸腺肿瘤患者就诊时即为进展期,肿瘤局部侵袭明显或发生远处转移无法经手术根治性切除,Masaoka等[2]报道局部进展期患者5年生存率约67%,而远处转移者为50%。胸腺肿瘤化疗仍有争议。化疗的目的其一是降低肿瘤负荷为后续手术或放疗创造机会,其二是延长疾病的控制时间。化疗可用于治疗的不同阶段,常采用的治疗模式包括术前化疗+手术、手术+术后化疗或放化疗。同时,对于发生远处转移的胸腺肿瘤患者,姑息性化疗常常是治疗的基本手段。目前胸腺肿瘤化疗没有标准治疗方案,有限的数据也多来源于不同单位采用各自的治疗模式和化疗方案的回顾性报道,因此结论千差万别。为此中国胸腺肿瘤协作组(the Chinese Alliance of Research for Thymomas,ChART),收集国内多家医疗中心胸腺肿瘤数据,对近年来治疗胸腺肿瘤患者的临床资料进行总结。本研究回顾性分析其中MasaokaⅢ/Ⅳa期胸腺肿瘤化疗病例的临床资料,初步探讨化疗在胸腺肿瘤治疗中的价值。
资料与方法
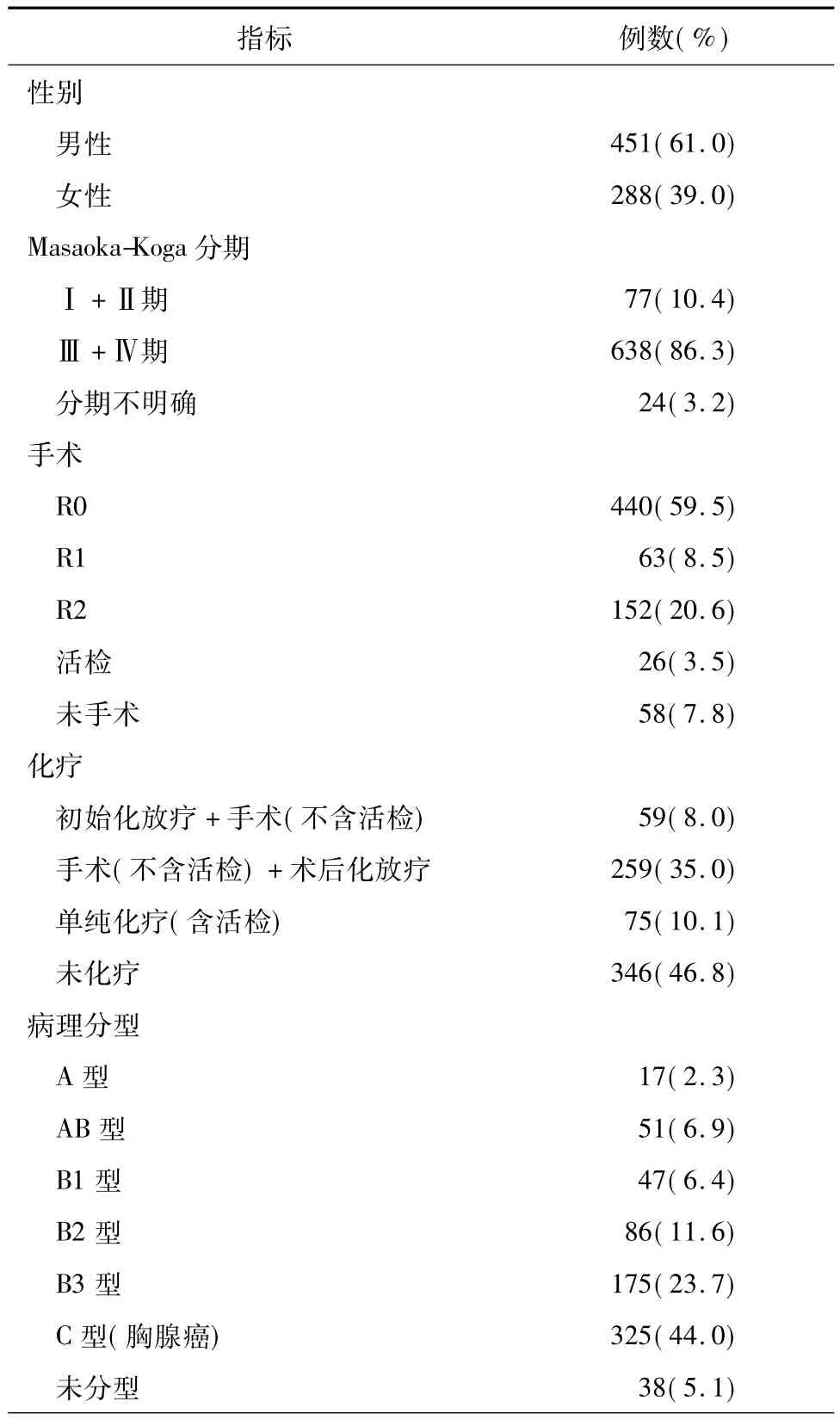
表1 739例MasaokaⅢ/Ⅳ期胸腺肿瘤化疗患者一般临床资料
一、临床资料
1994年3月至2012年12月,ChART数据库共纳入824例MasaokaⅢ/Ⅳ期及胸腺肿瘤化疗病例,临床资料相对完整者739例,年龄7~80岁,平均(50.1±13.3)岁。患者的一般临床资料见表1。
二、研究方法
对ChART数据库中Ⅲ/Ⅳa期及胸腺肿瘤化疗的病例进行回顾性分析。收集患者的一般信息资料,疾病分期参考国际胸腺肿瘤协作组织(International Thymic Malignancy InterestGroup,ITMIG)对Masaoka-Koga分期的具体定义[3];治疗模式包括手术、化疗及放疗的多学科治疗。具体手术方式为活检术、经胸骨路径或经胸路径纵隔肿瘤切除术(含胸腔镜手术),并详细记录手术资料。采用电话、病历资料、信访及户籍查询等方式获取生存随访资料。
三、统计学处理
临床病例及随访资料由合作医疗中心录入数据库。采用SPSS 19.0软件进行统计学分析,率的比较采用χ2检验。生存分析采用Kaplan-Meier法绘制生存曲线,log-rank检验或者Breslow检验进行生存分析。P<0.05表示差异有统计学意义。
结果
一、随访情况
739例患者均经临床病理诊断为胸腺肿瘤并行化疗(含术前化疗和术后化疗),经过不同方式随访获得588例患者的生存资料,共随访0~201个月,全组平均随访时间(46.87±39.536)个月,随访率79.6%(588/739)。
二、胸腺肿瘤预后因素分析
1.不同Masaoka-Koga分期患者的生存率:在有明确病理分期的564例患者中,Ⅰ+Ⅱ期患者的中位生存时间为(144.3±9.7)个月,5年和10年的生存率分别为94.7%和75.6%;Ⅲ期患者的中位生存时间为(141.1±6.1)个月,5年和10年的生存率分别为76.7%和64.3%,Ⅳ期患者的中位生存时间为(108.2±11.9)个月,5年和10年生存率分别为64.7%和37.5%(χ2=9.294,P=0.002,图1)。结果显示:Masaoka-Koga分期较好地区别出各期患者的预后情况,随着疾病的进展,患者的生存率逐渐降低。
2.不同手术性质患者的生存率:有明确手术性质的521例患者中,行R0手术的患者中位生存时间为(155.8±5.6)个月,5年和10年生存率分别为80.8%和70.4%,行R1+R2手术的患者中位生存时间为(98.5±7.8)个月,5年和10年生存率分别为63.0%和42.3%(χ2=23.297,P=0.000,图2)。结果提示R0切除患者的预后明显优于姑息性切除患者。
3.不同病理类型患者的生存:有明确病理分型的559例患者中,A+AB+B1组5年和10年的生存率分别为82.2%和75.9%,B2+B3组5年和10年的生存率分别为82.2%和70.8%,C组5年生存率为65.0%,3组间比较差异有统计学意义(χ2= 18.209,P=0.000,图3)。结果提示胸腺瘤患者的预后明显优于胸腺癌患者,而胸腺瘤各病理类型分组中并无显著差异。
因此,疾病分期、手术的根治性和病理学类型是影响患者长期生存的主要因素。
三、化疗在胸腺肿瘤治疗中的价值
1.初始化疗:全组共59例患者行术前初始化疗,7例经初始化疗后缓解Masaoka-Koga分期下降、23例病情稳定、29例疾病进展。初始化疗有效率为50.8%(30/59),客观缓解率为11.9%(7/59)。初始化疗的患者中约72.9%(43/59)达到R0切除,未行初始化疗的患者R0切除率为66.6%(397/596),初始化疗有提高R0切除率的趋势,但未达到统计学意义(χ2=0.957,P=0.328)。
2.术后化疗:全组共259例患者行术后化疗,337例患者未行术后化疗。
(1)术后化疗对胸腺肿瘤生存的影响:术后化疗组患者的中位生存时间为(121.6±6.5)个月,5年和10年生存率分别为70.2%和54.9%;未术后化疗组患者的中位生存时间为(140.9±6.5)个月,5年和10年生存率分别为85.0%和74.5%,未术后化疗组生存时间显著优于术后化疗组(χ2=8.613,P =0.003,图4)。结果提示术后化疗并未给胸腺肿瘤手术患者带来生存获益,进一步分析发现选择行术后化疗的患者中R1+R2切除率为40.9%(106/ 259),显著高于未化疗组27.8%(94/338)(χ2= 11.323,P=0.001)。(2)术后化疗对Masaoka-KogaⅢ/Ⅳ期胸腺瘤及胸腺癌生存影响的分层分析:术后化疗并未改善 Masaoka-KogaⅣ期胸腺瘤及Masaoka-KogaⅢ/Ⅳ期胸腺癌患者预后;而对于Masaoka-KogaⅢ期胸腺瘤患者术后化疗后生存时间则明显降低(表2、3)。

图1 不同Masaoka-Koga分期胸腺肿瘤患者的生存曲线(564例,χ2=9.294,P=0.002) 图2 不同手术性质胸腺肿瘤患者的生存曲线(521例,χ2=23.297,P=0.000) 图3 不同病理类型胸腺肿瘤患者的生存曲线(559例,χ2=18.209,P=0.000)图4 术后化疗对胸腺肿瘤患者生存的影响(596例,χ2=8.613,P=0.003)

表2 Masaoka-KogaⅢ/Ⅳ期胸腺癌患者术后化疗分层分析
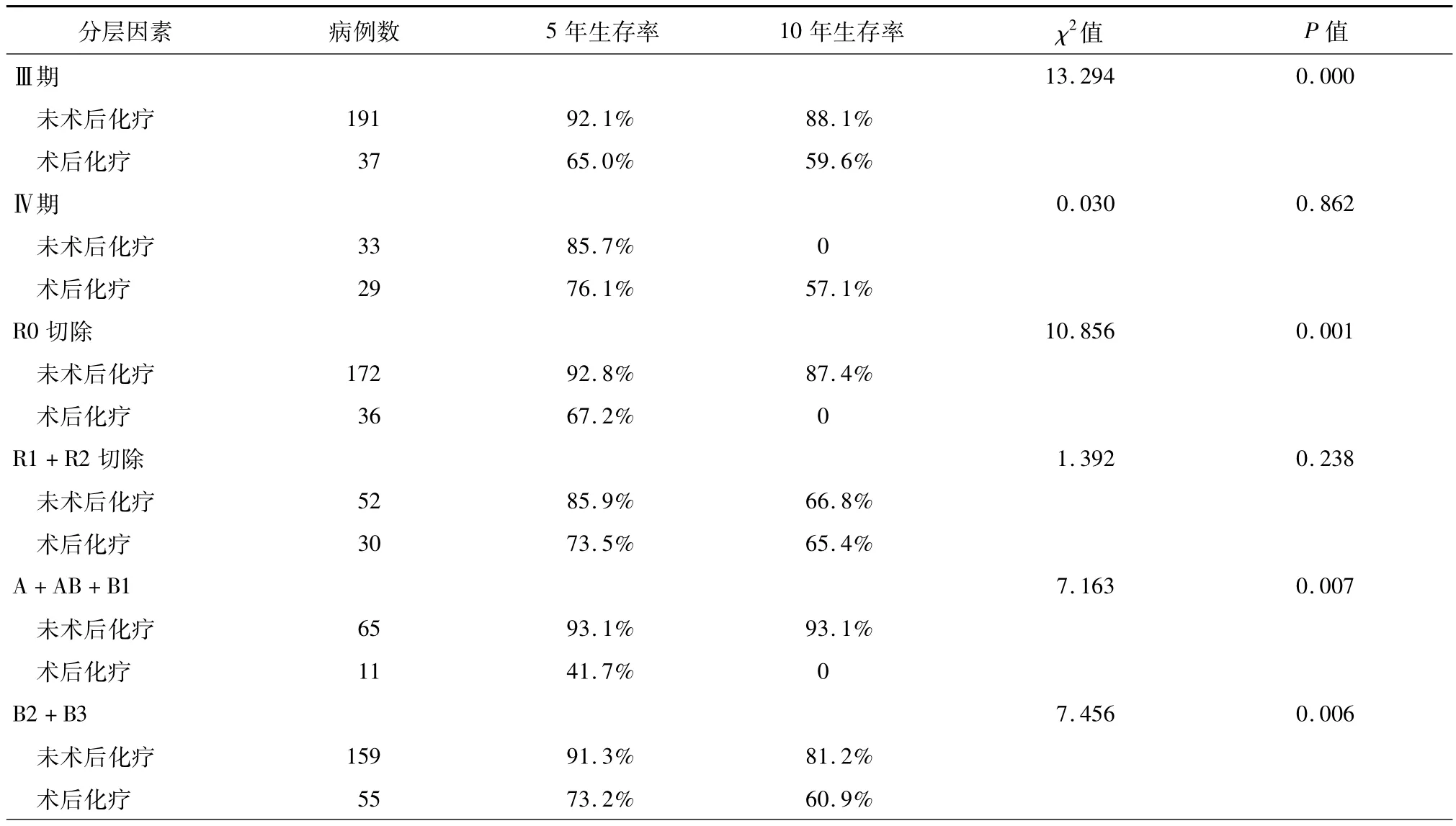
表3 Masaoka-KogaⅢ/Ⅳ期胸腺瘤患者术后化疗分层分析
讨论
胸腺肿瘤是少见的上皮源性肿瘤,多发于前上纵隔,绝大多数患者经手术切除后可获得良好的疗效,但约1/3的胸腺肿瘤患者就诊时即为进展期,肿瘤局部侵袭明显或发生远处转移无法经手术根治性切除。
胸腺肿瘤患者的长期生存期差异很大。肿瘤分期和手术的根治性是决定肿瘤患者生存的重要的因素。Kondo等[4]报道Ⅰ、Ⅱ、Ⅲ、Ⅳ期胸腺瘤患者5年生存率分别为100%、98%、89%和71%;本研究显示Ⅰ+Ⅱ期患者5年生存率94.7%,Ⅲ期76.7%,Ⅳ期64.7%。R0切除后5年生存率80.8%,而R1+R2切除后5年生存率63%,差异有统计学意义,与文献报道一致。
胸腺肿瘤化疗仍有争议。化疗的目的其一是降低肿瘤负荷为后续手术或放疗创造机会,其二是延长疾病的控制时间。常采用的治疗模式包括初始化疗+手术、手术+术后化疗或放化疗。同时,对于发生远处转移的胸腺肿瘤患者,姑息性化疗常常是治疗的基本手段。目前胸腺肿瘤化疗没有标准治疗方案,有限的数据也多来源于不同中心采用各自治疗方案的回顾性报道或小样本研究[5-9]。
初始化疗主要的目的是增加 R0切除率。Venuta等[10]报道45例包括初始化疗在内的多学科治疗Ⅲ期胸腺肿瘤病例,患者10年总生存率接近80%,较没有接受综合治疗的明显升高(45%),提示多学科综合治疗是胸腺肿瘤治疗的主要研究方向。Lucchi等[11]报道初始化疗70% ~80%的患者可获得缓解,约50%的术前化疗患者达到R0切除。Bretti等[6]报道初始化疗使Ⅲ期根治性切除率从45%提高至65%,Ⅳa期根治性切除率从0提高至20%。本组资料分析显示初始化疗有效率50.8%,客观缓解率11.9%。初始化疗的患者中约72.9% (43/59)达到R0切除,未行初始化疗的患者中R0切除率为66.6%(397/596,P=0.384),初始化疗有提高R0切除率的趋势,但未达到统计学意义。
由于胸腺瘤根治术后复发率很低,术后化疗在胸腺瘤治疗中的作用仍不明确。Strobel等[12]回顾性分析228例胸腺瘤和胸腺鳞癌的治疗经验,结果显示:术后化疗并不能改善A、AB、B1型胸腺瘤和Ⅱ期B2、B3型胸腺瘤的远期生存,术后放疗可延长Ⅲ期胸腺瘤患者的生存时间。Kim等[13]对100例胸腺瘤临床资料分析发现术后放化疗与术后单独放疗相比,Ⅱ和Ⅳ期胸腺瘤患者的5年生存率并无明显差异。Kondo等[4]对115个医疗中心治疗的1320例胸腺瘤分析后发现:术后放疗或术后化疗不能改善Ⅲ/Ⅳ期根治性切除的胸腺瘤患者的预后。同样,Attaran[14]等认为:尽管初始化疗和姑息化疗对某些患者显示出较好的治疗反应,但目前仍并没有证据表明术后化疗能改善胸腺肿瘤患者的生存。本组资料显示术后化疗并未给胸腺肿瘤手术患者带来生存获益,与文献报道一致。进一步分析发现本组资料中,术后化疗的患者中姑息性切除率较未化疗组明显高,而手术的根治性是影响患者预后的重要因素之一,这似可解释部分术后化疗患者预后差的原因。
由于胸腺癌患者术后常出现局部复发或远处转移[15],我们对局部晚期(Masaoka-KogaⅢ/Ⅳ期)胸腺瘤和胸腺癌进行分层分析后发现:术后化疗并未改善Ⅳ期胸腺瘤及胸腺癌患者的生存情况,与以往文献报道一致。而对于Masaoka-KogaⅢ期及根治性术后患者,化疗则明显降低患者的生存时间。分析原因是多方面的,从某种程度上更反映出国内胸腺肿瘤治疗中的不足之处。其一,由于目前胸腺肿瘤化疗并无明确的规范,更多是基于医师的临床经验来决定,人为判断的误差有可能造成选择术后化疗患者的实际分期要晚,整体预后相对更差。其二,Ⅲ期是一组异质性比较大的群体,临床上肿瘤对纵隔胸膜、心包、神经、大血管、肺的致密粘连或侵犯较难明确区分,更多需要病理学检查的镜下确认,术后标本标识不清和病理报告不全面同样导致本研究中根治性切除术后未化疗的部分Ⅲ期患者实际分期可能要低(有可能是Ⅱ期)。上诉因素的共同影响造成Ⅲ期胸腺瘤患者术后化疗结论的明显偏差。同时,本研究的病例来源于不同治疗中心所采用的不同放、化疗方案,术后化疗在胸腺肿瘤治疗中的真实价值仍有待进一步研究。
由于数据库建立初期各分中心录入的化疗信息有限,治疗中所采用的化疗方案、化疗周期数、治疗后反应等并未录入,无法评价各具体化疗方案的疗效;但就本组数据分析,手术根治性、病理类型和Masaoka-Kago分期仍是影响胸腺肿瘤预后的重要因素。术前化疗有提高R0切除率的趋势,术后化疗并不能为局部晚期胸腺肿瘤患者带来生存获益,化疗在胸腺肿瘤中的作用仍待进一步研究。胸腺肿瘤是少见肿瘤,鉴于国内目前在该研究领域中存在各种不足,有必要进一步建立前瞻性数据库,开展多中心合作研究。
中国胸腺肿瘤研究协作组成员:上海交通大学附属胸科医院:方文涛(胸外科)、谷志涛(胸外科)、王长禄(放疗科),张杰(病理科);复旦大学附属中山医院:谭黎杰(胸外科);复旦大学附属华山医院:庞烈文(胸外科);同济大学附属肺科医院:陈岗(病理科);中山大学附属肿瘤医院:傅剑华(胸外科);郑州大学附属肿瘤医院:李印(胸外科);青岛大学医学院附属医院:沈毅(胸外科);天津医科大学附属肿瘤医院:于振涛(胸外科);四川省肿瘤医院:韩泳涛(胸外科);北京大学附属第三医院:闫天生(胸外科);北京大学附属肿瘤医院:曹登峰(病理科),陈克能(胸外科),付浩(胸外科)
1 Girard N,Mornex F,Van HoutteP,et al.Thymoma:a focus on current therapeutic management[J].J Thorac Oncol,2009,4(1): 119-126.
2 Masaoka A,Monden Y,Nakahara K,et al.Follow-up study of thymomas with special reference to their clinical stages[J].Cancer,1981,48(11):2485-2492.
3 Detterbeck FC,Nicholson AG,Kondo K,et al.The Masaoka-Koga stage classification forthymic malignancies: clarification and definition of terms[J].J Thorac Oncol,2011,6(7 Suppl 3): S1710-S1716.
4 Kondo K,Monden Y.Therapy for thymic epithelial tumors:a clinical study of 1,320 patients from Japan[J].Ann Thorac Surg,2003,76(3):878-884
5 Fornasiero A,Daniele O,GhiottoC,et al.Chemotherapy of invasive thymoma[J].J Clin Oncol,1990,8(8):1419-1423.
6 Bretti S,Berruti A,Loddo C,et al.Multimodal management of stagesⅢ-Ⅳa malignant thymoma[J].Lung Cancer,2004,44(1): 69-77.
7 Loehrer PJ Sr,Jiroutek M,Aisner S,et al.Combined etoposide,ifosfamide,and cisplatin in the treatment of patients with advanced thymoma and thymic carcinoma:an intergroup trial[J].Cancer,2001,91(11):2010-2015.
8 Berruti A,Borasio P,Roncari A,et al.Neoadjuvant chemotherapy with adriamycin, cisplatin, vincristine and cyclophosphamide (ADOC)in invasive thymomas:results in six patients[J].Ann Oncol,1993,4(5):429-431.
9 Berruti A,Borasio P,Gerbino A,et al.Primary chemotherapy with adriamycin,cisplatin,vincristine and cyclophosphamide in locally advanced thymomas:a single institution experience[J].Br J Cancer,1999,81(5):841-845.
10 Venuta F,Rendina EA,Longo F,et al,Long-term outcome after multimodality treatment for stageⅢthymic tumors[J].Ann Thorac Surg,2003,76(6):1866-1872.
11 Lucchi M,Ambrogi MC,Duranti L,et al.Advanced stage thymomas and thymic carcinomas:results of multimodality treatments[J].Ann Thorac Surg,2005,79(6):1840-1844.
12 Strobel P,Bauer A,Puppe B,et al.Tumor recurrence and survival in patientstreated forthymomasand thymic squamouscell carcinomas:a retrospective analysis[J].J Clin Oncol,2004,22 (8):1501-1509.
13 Kim BK,Cho BC,Choi HJ,et al.A single institutional experience of surgically resected thymic epithelial tumors over 10 years:clinical outcomes and clinicopathologicfeatures[J].Oncol Rep,2008,19 (6):1525-1531.
14 Attaran S,McCormack D,Pilling J,et al.Which stages of thymoma benefit from adjuvant chemotherapy post-thymectomy?[J]Interact Cardiovasc Thorac Surg,2012,15(2):273-275.
15 Eng TY,Fuller CD,Jagirdar J,et al.Thymic carcinoma:state of the art review[J].Int J Radiat Oncol Biol Phys,2004,59(3):654-664.
Clinical value of chemotherapy for thymictumors:a retrospective analysis based on the results of theChinese Alliance of Research for Thymomas database
Ma Ke1,Han Yongtao1,Chen Keneng2,Fang Wentao3,the Chinese Alliance for Research of Thymoma4.1Department of Thoracic Surgery,Sichuan Cancer Hospital,Chengdu 610041,China;2Department of Thoracic Surgery,Peking University Cancer Hospital,Beijing 100142,China;3Department of Thoracic Surgery,Shanghai Chest Hospital,Shanghai Jiao Tong University,Shanghai 200030,China;4the Chinese Alliance for Research of Thymoma
Chen keneng,Email:chenkeneng@bjmu.edu.cn;Fang Wentao,Email:vwtfang@ hotmail.com
Objective To explore the clinical value of chemotherapy in the treatment of thymic tumors.Methods 739 patients with Masaoka stageⅢ/Ⅳa or the chemotherapy cases between March 1994 and December 2012 were retrospectively analyzed based on the Chinese Alliance of Research for Thymomas (ChART)database.The clinical value of different modes of chemotherapy was estimated,the survival curves were drawn according to different subgroups,and the factors affecting the prognosis were analyzed.Results The Masaoka-Koga stage,completion of resection and pathological type were the main influencing factors of long-term survival.The efficiency of primary chemotherapy was 50.8%(30/59),and the objective response rate was 11.9%(7/59).The primary chemotherapy improved complete resection rate from 66.6%(397/596)to 72.9%(43/59).The 5-year survival and 10-yea r survival ofⅢ/Ⅳthymic carcinoma were 71.0%vs 66.6%and 53.5%vs 42.6%,respectively(χ2=0.003,P=0.953).The 5-year survival of non-postoperative chemotherapy group and postoperative chemotherapy group in patients with stage IV thymic tumor were 85.7%and 76.1%,respectively(χ2=0.030,P=0.862).The 5-year survival and 10-year survival of non-postoperative chemotherapy group and postoperative chemotherapy group in patients with stageⅢthymoma were 92.1%vs 65.0%and 88.1%vs 59.6%,respectively(χ2=13.294,P= 0.000).For the patients with complete resected thymoma in stageⅢ andⅣ,the 5-year survival of patients without and with postoperative chemotherapy were 92.8%and 67.2%,respectively(χ2=10.856,P=0.001).Conclusions Primary chemotherapy can slightly improve the complete resection rate,while postoperative chemotherapy cannot improve the long-term outcomes of thymic tumors.Postoperative chemotherapy does no good to the MasaokaⅢthymoma and thymic tumor with localized advanced complete resection.
Thymic tumor; Chemotherapy; Surgery; Prognosis
2015-01-10)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.01.004
610041 成都,四川省肿瘤医院胸外科1;100142 北京大学附属肿瘤医院胸外科2;200030 上海交通大学附属胸科医院胸外科3;中国胸腺瘤协作组4
陈克能,Email:chenkeneng@bjmu.edu.cn;方文涛,Email:vwtfang@hotmail.com
non-postoperative chemotherapy group and postoperative chemotherapy group in patients with Masaoka-Koga
马可,韩泳涛,陈克能,等.化疗在胸腺肿瘤治疗中的临床价值[J/CD].中华胸部外科电子杂志,2015,1(1):13-19.
