牛磺酸对鲫鱼(Carassius auratus)生长、肠道细胞增殖及蛋白消化吸收相关基因表达的影响*
2015-04-10唐建洲赵玉蓉鲁双庆
伍 琴 唐建洲 刘 臻 ① 赵玉蓉 郝 光 鲁双庆
(1.湖南农业大学动物科技学院 长沙 410128;2.湖南省水产高效健康生产协同创新中心 常德 415000;3.长沙学院生物与环境工程系 长沙 410003)
牛磺酸(2-氨基乙烷磺酸)是一种能在鱼体内自主合成的含硫非蛋白氨基酸。对鱼体内的营养生理具有很大作用,如影响动物视力和神经系统,调节细胞渗透压,促进营养物质的消化吸收,提高鱼的生长性能等。越来越多的研究者把牛磺酸添加到饲料中,探讨牛磺酸对淡水鱼和海水鱼养殖的生理、代谢、及营养的影响(Li et al,2009;El-Sayed et al,2013)。牛磺酸在鱼体内可以通过游离氨基酸的代谢自身合成,但是多数鱼类尤其是淡水鱼类自身合成的牛磺酸浓度很低,不能满足自身生长需求,必须通过饮食来补充。已有研究表明,在饲料中添加牛磺酸能提高五条鰤的繁殖能力(Matsunari et al,2006);在鱼饲料中添加牛磺酸能提高饲料利用率和鱼的生产性能(Takagi et al,2006a,2006b,2010,2011;Yamamoto et al,2000)。添加适量牛磺酸的饲料提高了黄河鲤鱼的胰肠蛋白酶活性(高春生等,2007)。但是有关牛磺酸影响鲫鱼生长性能、肠道细胞增殖和蛋白质消化吸收的机理研究尚未见报道,因此本试验旨在饲料中添加不同剂量的牛磺酸,研究牛磺酸对鲫鱼生长性能,肠道黏膜形态,以及蛋白消化吸收相关基因表达的影响,以期能为牛磺酸应用于水产动物营养以及牛磺酸对水产动物的作用机理提供新的理论依据。
1 材料与方法
1.1 试验设计
配制6种等氮等能饲料,饲料蛋白源主要是豆粕和鱼粉,饲料脂肪源主要是豆油和鱼油,饲料糖源则主要由面粉和淀粉提供。参考文献(Matsunari et al,2006;Xie et al,2014),在鲫鱼基础饲粮中添加牛磺酸的剂量分别为 0.0、1.0、2.5、4.0、6.0以及 9.0g/kg (牛磺酸由上海明丰生物科技有限公司提供,分析纯)。饲粮原料粉碎后用 40目筛筛净杂质,饲料原料混匀采用的是由小比重成分到大比重成分逐级扩大的方法,制粒前把鱼油等脂肪源与水预混合再加到混合好的原料中充分混匀,用 SLX-80型软颗粒饲料机加工成直径为1.5 mm的硬颗粒饲料。分析饲料成品得知各组饲粮中牛磺酸的准确含量分别为 2.1、2.99、4.4、5.7、7.5、10.1 g/kg,基础饲料配方如表1所示。
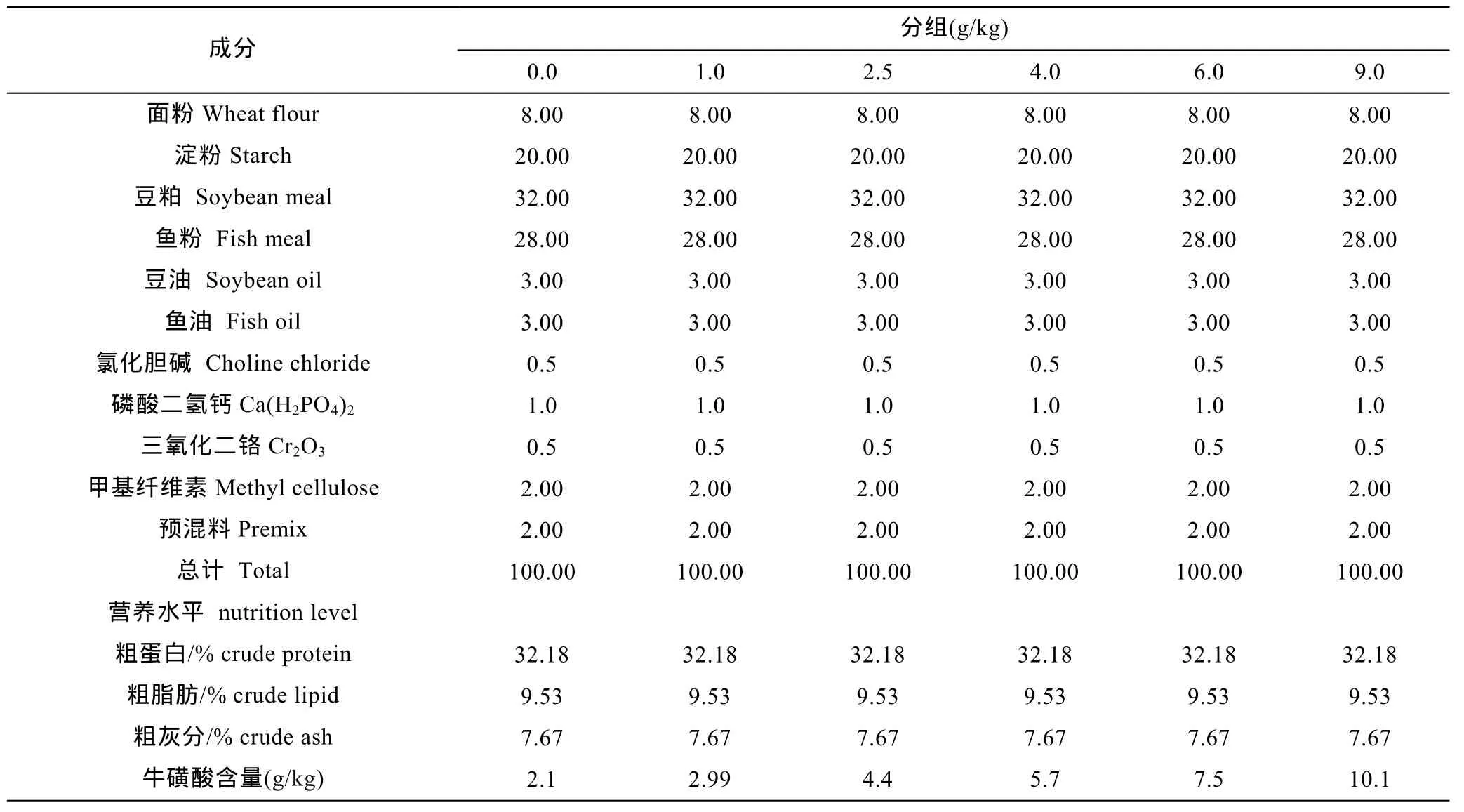
表1 基础饲粮的组成(%)及营养水平Tab.1 Composition and nutrient levels of the basal fodder
1.2 试验用鱼的养殖管理
选取同批孵化、体质健壮的鲫鱼(由湖南省水产科学研究所提供),初始体重为(29.07±0.19)g,饲喂周期为8周。试验共设6个处理组,每个处理组分为4个重复,每个重复有鱼20尾。养殖试验于2014年7—9月在长沙学院产学研基地室内循环养殖系统中进行,养殖用缸规格为120cm×80cm×80cm。试验开始后,每日定点定时投喂3次,均为饱食投喂,饲喂期间养殖缸每天不断增氧,水温控制在 24—27°C,pH 控制在6.5—7.5。每天测量水温、记录投喂量和观察摄食情况。
1.3 样品采集与指标测定
1.3.1 生产性能指标 8周养殖试验结束,停食24h后采样,分别称取每缸鱼体重并记录尾数,算出每缸鱼的平均体重、增重率(weight gain rate,WGR)、特定生长率(special growth rate,SGR)、饲料系数(feed coefficient,FC)、蛋白质效率(protein efficiency ratio,PER)。计算公式如下:
增重率(WGR,%)= (末均重-初均重)/初均重×100%;
特定生长率(SGR,%/d)= (ln末均重-ln初均重)/实验天数×100%;
饲料系数(FC)= 总摄食量/(末总重-初总重);
蛋白质效率(PER)= (末均重-初均重)/(尾均摄食日粮总量×饲粮粗蛋白含量)。
1.3.2 血清生化指标 试验结束后,从每缸鱼中随机捞选 3尾鱼进行尾静脉采血,迅速摘下针头并将血液注入已灭菌的1.5mL EP管中,4°C静置直至析出大量血清,4000 r/min离心10 min,取血清保存在–80°C待测。血清中 T3、T4、尿素氮、葡萄糖等血清生化指标由中国人民解放军第163医院检测得到。
1.3.3 肠道黏膜形态测定 养殖结束后,每缸随机捞取鱼3尾,解剖后分离肠道,用0.1 mol/L PBS溶液轻轻冲洗肠道,用 4%多聚甲醛溶液固定中肠,按照石蜡切片的制作程序(脱水、石蜡包埋、切片和H-E染色)制出切片,在 10×10显微镜下观察并拍照。每张切片随机选10—20根平整完好的的绒毛,用软件Image-pro plus6.0测量其高度及相邻的隐窝深度[测量方法参考孙浪(2013)],算出绒毛高度与隐窝深度的比值,最后把各指标的平均数作为测定数值。
1.3.4 肠道蛋白质消化吸收相关基因相对表达的测定 养殖结束后,每缸鱼随机取3尾,在无菌环境下于冰盒上解剖后分离出肠道,用剪刀剪碎装入无RNAse EP管中,迅速投入液氮中保存,用于基因表达的分析,全程低温操作。
1.3.5 荧光定量引物设计 用Tritrol试剂(TaKaRa)提取鲫鱼肠道样品中总 RNA,随后用 PrimeScript RT reagentKit (Perfect Real Time)(TaKaRa)反转录得到单链cDNA。从GenBank中查询并下载鲫鱼的氨肽酶N (Aminopeptidase,APN)、小肽转运蛋白(Peptide Transporter,PepT1)、基因系尾型同源盒基因(caudal homeobox genes,CDX2)、L-氨基酸转运载体蛋白(L-transport carrier protein amino acids,LAT2)基因序列全长,找到ORF区,实时荧光定量 PCR(Real-time PCR)特异引物用Primer Express 3.0软件设计,内参基因引物根据鲫鱼管家基因β-actin设计(见表2)。
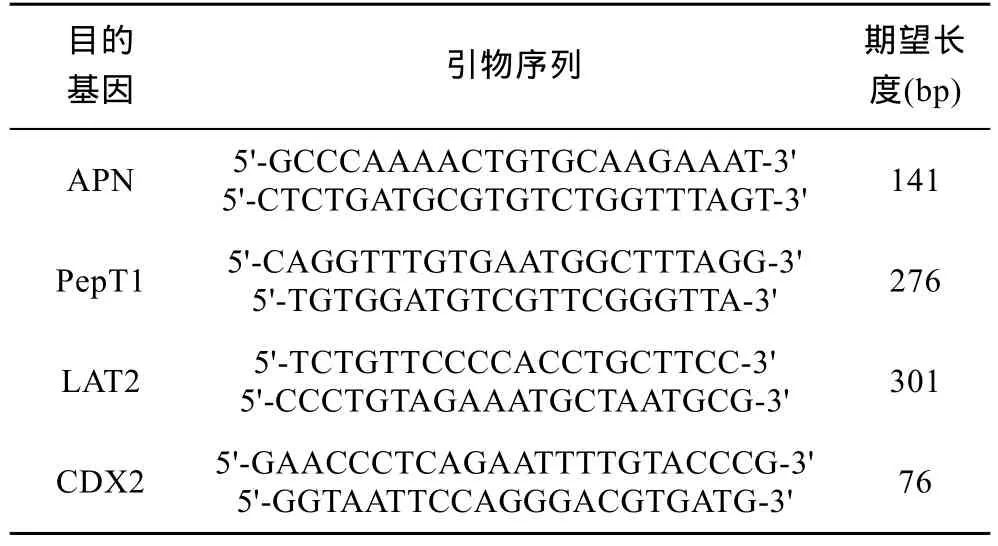
表2 荧光定量分析的目的基因与内参基因的引物参数Tab.2 Primers used for real-time quantitative PCR analysis
Real-time PCR扩增采用SYBR Premix ExTaqTM(Tli RNaseH Plus)试剂盒(TaKaRa)和 BIO-RAD CFX96TMReal-time PCR仪进行Real-time PCR扩增。 PCR 反 应 体 系为: SYBR Premix ExTaq 6 µL;正向引物(10 µmol/L)0.5 µL;反向引物(10 µmol/L)0.5 µL;模板 0.5 µL;双蒸水5 µL;总体积为 12.5 µL,每个样品3个重复。RT-PCR结束后,从扩增曲线得出Ct值,通过公式RQ=2–△△Ct[ΔΔCt=(Ct目的基因-Ct管家基因)-ΔCt校准样]计算得出目的基因的相对表达量,最后用Sigmaplot软件作图。
1.4 数据统计处理
用 Image-pro plus6.0软件分析肠道切片图,所有数据都用“平均值±标准差(x±SD)”的表示方法,并用 Excel 2007进行初步数据统计,用SPSS16.0软件进行单因素方差分析(ANOVA),采用Duncan进行多重比较,检验不同组间的差异是否显著,以P<0.05为显著性判断标准。柱状图由专业制图软件 Sigmaplot制出。
2 结果与分析
2.1 牛磺酸对鲫鱼生产性能的影响
从表3可见,1.0、2.5、4.0和9.0 g/kg四个处理组与对照组相比较,鲫鱼的增重率、特定生长率、饲料系数差异不显著(P>0.05),当牛磺酸添加量为6.0 g/kg时,鲫鱼的增重率、特定生长率、饲料系数显著高于对照组及其它处理组(P<0.05)。从表3还可知,1.0、2.5和9.0 g/kg三个处理组与对照组相比,鲫鱼蛋白质效率差异不显著(P>0.05),4.0 g/kg和6.0 g/kg处理组蛋白质效率显著高于对照组及其它处理组(P<0.05)。
2.2 牛磺酸对鲫鱼血清生化指标的影响
由表4可知,血清中T3、T4随着牛磺酸剂量的增加,各试验组整体呈先增加后下降的变化趋势,牛磺酸浓度6.0 g/kg时,T3、T4在血清中浓度最高,显著高于对照组和1.0 g/kg、2.5 g/kg处理组(P<0.05)。各试验组血清葡萄糖浓度差异不显著(P>0.05),尿素氮浓度差异显著(P<0.05),6.0 g/kg处理组中尿素氮浓度显著低于对照组和其它处理组(P<0.05)。
2.3 牛磺酸对鲫鱼肠道细胞增殖的影响
由表5可知,绒毛高度整体上随着牛磺酸浓度的增加而先上升后下降,隐窝深度则随着牛磺酸浓度的增加先降低后增加。当饲料中牛磺酸浓度为6.0 g/kg时,鲫鱼绒毛高度达到最高值,隐窝深度达到最小值,且都显著区别于对照组和其它处理组(P<0.05)。而且,各试验组的绒毛高度/隐窝深度的比值随着牛磺酸浓度的增加先增大后减小,添加6.0 g/kg时达到最高值(见图1)。
2.4 牛磺酸对肠道蛋白吸收调节相关基因表达的影响
如图2、图3所示,APN、PepT1、LAT2、CDX2 mRNA的相对表达量随着牛磺酸添加量的增加整体上都呈先上升后下降的变化趋势,添加6.0 g/kg时处于最高值,显著高于对照组和其它处理组(P<0.05)。从图2可看出,1.0和4.0和6.0 g/kg处理组的APN mRNA的相对表达量显著高于对照组(P<0.05);PepT1 mRNA表达量在6.0 g/kg处理组时显著高于其它试验组(P<0.05),除6.0 g/kg处理组之外的其它组间则差异不显著(P>0.05)。由图3可看出,LAT2在 4.0 g/kg和6.0g/kg处理组时表达量显著高于其它试验组(P<0.05)。CDX2 mRNA在6.0g/kg和9.0 g/kg处理组的相对表达量高于对照组和其它处理组(P<0.05)。综上说明添加适量的牛磺酸能促进APN、PepT1、LAT2和CDX2 这4个基因的表达,而添加量过低或者是过 高则不起作用或者起抑制的效果。
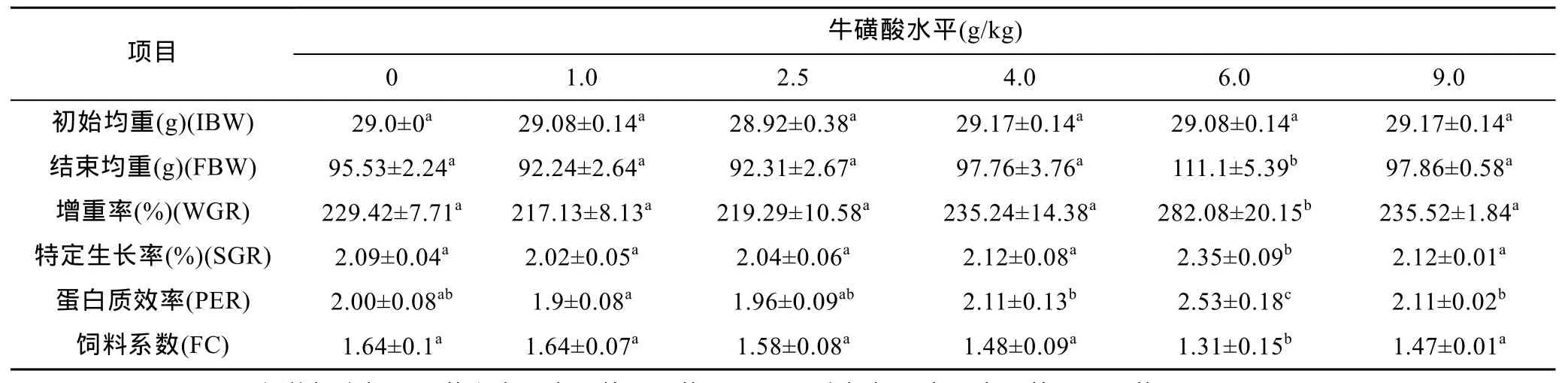
表3 不同牛磺酸量对鲫鱼生产性能的影响Tab.3 Effects of different concentrations of taurine on growth performance of crucian carp
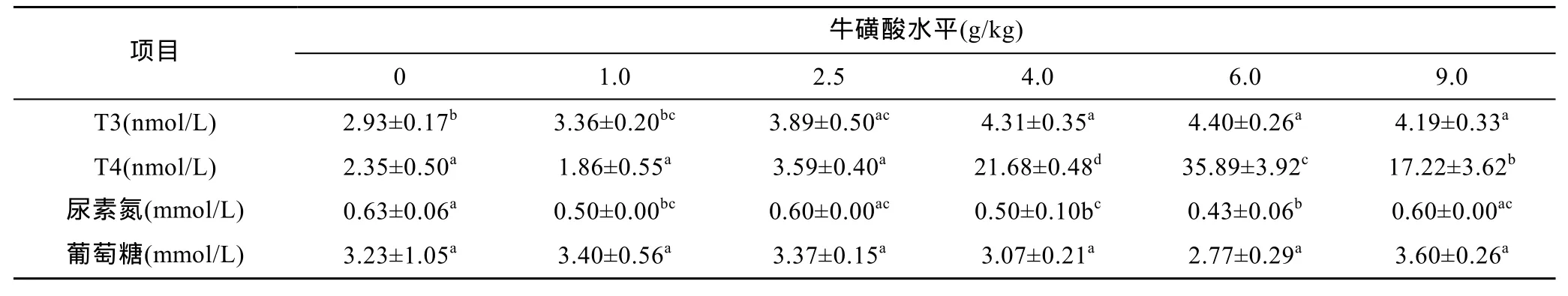
表4 不同牛磺酸量对鲫鱼血液生化指标的影响Tab.4 Effect of taurine in different concentrations on biochemical indices in crucian carp serum

表5 不同牛磺酸量对鲫鱼肠道黏膜形态的影响Tab.5 Effect of taurine in different concentrations on intestinal mucosa morphology of crucian carp
3 分析与讨论
国内外有关牛磺酸影响水产动物生产性能的研究报道很多,Takagi等(2006b)用添加不同梯度牛磺酸的饲料饲喂黄鱼,研究结果表明,饲喂 21周后,0添加牛磺酸组的鱼的增重,饲料效率明显比添加组低,而死亡率则更高。Takagi等(2006a)在饲料中添加梯度剂量的牛磺酸饲喂 1年龄的红鲷鱼,发现牛磺酸添加组的特定生长率和饲料利用率得到明显的改善。本试验结果表明,在饲料中添加一定剂量的牛磺酸对鲫鱼有明显的促生长和促进饲料利用的作用,6.0 g/kg牛磺酸处理组的生产指标最优,显著优于对照组和其它处理组(P<0.05),本研究结果与上述报道相似。
甲状腺激素的主要作用是通过加快新陈代谢来促进机体的生长发育。T3、T4都是机体的重要代谢激素,与生长激素密切相关,其水平的高低影响着机体代谢水平、生长快慢(宋永,2002;杨小然,2012)。本试验结果显示,T3、T4都随着牛磺酸添加浓度的增加而先增加后减少,当添加浓度达到6.0 g/kg时,T3、T4都达到最高值,这与郭鹏飞(2004)研究牛磺酸对肉鸭血液生化指标的结果一致。血清尿素氮含量主要反映体内氨基酸的代谢效率,血清中尿素氮含量的增加是因为过量的氨基酸在体内进行脱氨作用,有研究报道,尿素氮含量与蛋白质利用率及日增重呈负相关(Whang et al,1994)。本试验结果显示,1.0、4.0、6.0 g/kg牛磺酸添加组的尿素氮含量显著低于对照组(P<0.05),其中6.0 g/kg处理组最低,表明鲫鱼饲料中添加牛磺酸可降低血清尿素氮浓度,这一研究结果与刘玉芝等(2008)的肉仔鸡牛磺酸试验结果相互佐证。
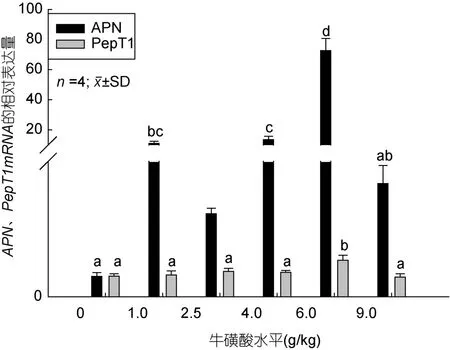
图2 牛磺酸对鲫鱼肠道APN、PepT1 mRNA相对表达量的影响Fig.2 Effect of taurine on APN,PepT1 mRNA relative expression of the crucian carp
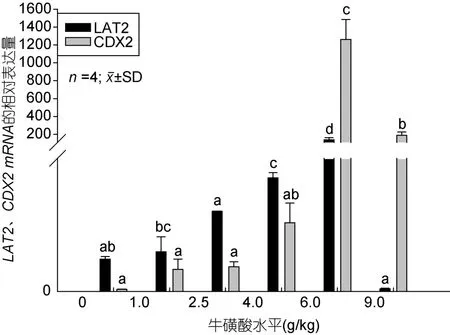
图3 牛磺酸对鲫鱼肠道 LAT2、CDX2 mRNA相对表达量的影响Fig.3 Effect of taurine on LAT2,CDX2 mRNA relative expression of the crucian carp
肠绒毛作为机体的主要消化和吸收场所,是肠黏膜的主要结构。衡量小肠吸收功能的指标主要是肠绒毛高度、隐窝深度及绒毛高度与隐窝深度的比值(韩正康,1991;晁洪雨,2008)。肠绒毛高度增加使肠道吸收面积加大,对饲料中营养物质的利用率得到提高,消化功能增强,提高鱼的生长性能和饲料系数。隐窝变浅使肠道分泌功能加强(成令忠,1994),能分泌更丰富的激素,酶类,提高了肠道的消化吸收能力。肠绒毛吸收营养物质的能力随着肠绒毛高度与隐窝深度比值的增高而加强,反之则减弱(郭元晟等,2011;郭志强等,2012)。张建斌等(2011)报道,在饲料中添加牛磺酸能极显著提高猪十二指肠的绒毛长度和降低隐窝深度,极显著提高十二指肠段和空肠中肠段的绒毛长度/隐窝深度。本试验结果与以上试验结果相似,添加适量的牛磺酸能使得高肠绒毛高度和绒毛高度/隐窝深度的比值得到显著提高,隐窝深度显著降低,尤其是6.0 g/kg添加量时,各数据均显示达到了最佳。
牛磺酸影响体内蛋白质的消化吸收效率,根本原因是牛磺酸对调控蛋白质水解、转运、吸收相关基因表达起了调控作用。APN作为鱼类肠道中水解各种蛋白质的关键酶,能够把 N端多肽链水解成游离氨基酸,对鱼类的消化有着至关重要的作用(Nakainishi et al,2002)。PepT1对大多数二肽和三肽都具有很高的转运活性,在蛋白质降解产物吸收中发挥关键作用(张云华等,2003)。CDX2在肠道中主要对肠道上皮形态发生,维持和分化起作用,是肠道上皮细胞的一种特异性核转录因子(Yuasa et al,2005),还调控一些对肠道消化吸收起关键性作用的功能基因的表达(冯幼等,2009)。LAT2负责转运支链氨基酸和芳香族氨基酸、中性氨基酸和一些必需氨基酸(Kanai et al,1998)。本试验结果显示,牛磺酸对 APN、PepT1、LAT2、CDX2 mRNA的相对表达量的影响整体上都是一个先上升后下降的变化趋势,当牛磺酸浓度达到6.0 g/kg时处于最高值,显著高于对照组和其它对照组(P<0.05),这与Matsunari等(2005)研究牛磺酸对黄鰤鱼幼鱼的影响的研究结果相似,即牛磺酸能影响氨基酸代谢。以上研究结果揭示牛磺酸通过调节APN、PepT1、LAT2、CDX2 mRNA在鲫鱼肠道中的相对表达量来调控蛋白质的水解,小肽的转运以及氨基酸的消化吸收,最终影响到鲫鱼的生长性能。
4 结论
(1)饲料中添加适量的牛磺酸能提高鲫鱼的生长性能、蛋白质效率、饲料系数、及鲫鱼肠道细胞的增殖和血清中T3、T4的浓度。
(2)饲料中添加适量的牛磺酸能上调鲫鱼肠道中APN、PepT1、LAT2、CDX2 mRNA的相对表达量。
(3)饲料中添加牛磺酸应注意适量原则。
冯 幼,王修启,江青艳,2009.肠道上皮细胞特异转录因子CDX2研究进展.中国畜牧兽医,36(6): 65—68
成令忠,1994.组织学.2版.北京: 人民卫生出版社
刘玉芝,刘艳琴,2008.牛磺酸对肉仔鸡生产性能和免疫功能的影响.扬州大学学报(农业与生命科学版),29(4): 45—48
孙 浪,刘 臻,郝 光等,2013.丁酸钠对鲫鱼生长和肠细胞增殖的影响.中国水产科学,20(4): 893—901
杨小然,2012.牛磺酸对蛋雏鸭生长性能和血液生化指标的影响.哈尔滨: 东北农业大学硕士学位论文
宋 永,2002.甘露寡糖对肉鸭生产性能、血液生化指标和盲肠主要菌群的影响.保定: 河北农业大学硕士学位论文
张云华,单安山,冯自科,2003.小肽转运载体(PepT1)及其活性的调控.东北农业大学学报,34(2): 205—209
张建斌,车向荣,陈娟娟,2011.谷氨酰胺和牛磺酸对仔猪肠黏膜形态的影响.饲料研究,(8): 50—52
晁洪雨,李福昌,2008.日粮ADF水平对肉兔氮代谢、小肠组织学结构和二糖酶活性的影响.中国兽医学报,28(5):604—607
高春生,范光丽,王艳玲,2007.牛磺酸对黄河鲤鱼生长性能和消化酶活性的影响.中国农学通报,23(6): 645—647
郭元晟,闫素梅,史彬林等,2011.发酵乳酸杆菌对肉鸡小肠绒毛形态的影响.动物营养学报,23(7): 119 4—1200
郭志强,杨奉珠,雷 岷,2012.抗菌肽对肉兔小肠黏膜形态、盲肠茵群和免疫功能的影响.动物营养学报,24(9):1778—1784
郭鹏飞,2004.牛磺酸对肉鸭生产性能、血液生化指标、免疫机能和胴体品质影响的研究.保定: 河北农业大学硕士学位论文
韩正康,1991.家畜营养生理学.北京: 农业出版社
El-Sayed A-F M,2013.Is dietary taurine supplementation beneficial for farmed fish and shrimp? a comprehensive review.Reviews in Aquaculture,6(4): 241—255
Kanai Y,Segawa H,Miyamoto K et al,1998.Expression cloning and characterization of a transporter for large neutral amino acids activated by the heavy chain of 4F2 antigen (CD98).The Journal of Biological Chemistry,273(37): 23629—23632
Li P,Mai K S,Trushenski J et al,2009.New developments in fish amino acid nutrition: towards functional and environmentally oriented aquafeeds.Amino Acids,37(1):43—53
Matsunari H,Hamada K,Mushiake K et al,2006.Effects of taurine levels in broodstock diet on reproductive performance of yellowtail Seriola quinqueradiata.Fisheries Science,72(5): 955—960
Matsunari H,Takeuchi T,Takahashi M et al,2005.Effect of dietary taurine supplementation on growth performance of yellowtail juveniles Seriola quinqueradiata.Fisheries Science,71(5): 1131—1135
Nakanishi K,Yaoi K,Nagino Y et al,2002.Aminopeptidase N isoforms from the midgut of Bombyx mori and Plutella xylostella——their classification and the factors that determine their binding specificity to Bacillus thuringiensis Cry1A toxin.FEBS Letters,519(1—3): 215—220
Takagi S,Murata H,Goto T et al,2006a.Efficacy of taurine supplementation for preventing green liver syndrome and improving growth performance in yearling red sea bream Pagrus major fed low-fishmeal diet.Fisheries Science,72(6): 1191—1199
Takagi S,Murata H,Goto T et al,2006b.Hemolytic suppression roles of taurine in yellowtail Seriola quinqueradiata fed non-fishmeal diet based on soybean protein.Fisheries Science,72(3): 546—555
Takagi S,Murata H,Goto T et al,2010.Necessity of dietary taurine supplementation for preventing green liver symptom and improving growth performance in yearling red sea bream Pagrus major fed nonfishmeal diets based on soy protein concentrate.Fisheries Science,76(1): 119—130
Takagi S,Murata H,Goto T et al,2011.Role of taurine deficiency in inducing green liver symptom and effect of dietary taurine supplementation in improving growth in juvenile red sea bream Pagrus major fed non-fishmeal diets based on soy protein concentrate.Fisheries Science,77(2):235—244
Whang K Y,Hahn J D,Easter R A et al,1994.Blood-plasma urea nitrogen: a useful index of feed efficiency and lean gain potential in pigs.Journal of Animal Science,72(S2): 61
Xie Z G,Wang F R,Liu H Y et al,2014.Effect of dietary taurine levels on growth performance and taurine content of Nibea albiflora larvae.Aquaculture International,22(6): 1851—1862
Yamamoto T A,Unuma T A,Akiyama T O,2000.The influence of dietary protein sources on tissue free amino acid levels of fingerling rainbow trout.Fisheries Science,66(2): 310—320 Yuasa Y,Nagasaki H,Akiyama Y et al,2005.Relationship between CDX2 gene methylation and dietary factors in gastric cancer patients.Carcinogenesis,26(1): 193—200
