基于纳米免疫磁珠快速富集4种海洋致病性弧菌的研究*
2015-04-10王祖忠张迪骏张春丹苏秀榕
张 璇 戴 娟 王祖忠 周 君 张迪骏 张春丹 李 晔 苏秀榕
(宁波大学海洋学院 宁波 315211)
副溶血弧菌(Vibrio parahemolyticurs)、哈维氏弧菌(Vibrio harveyi)、创伤弧菌(Vibrio vulnificus)和灿烂弧菌(Vibrio splendidus)均属于革兰氏阴性、兼性厌氧、嗜盐性弧菌,主要分布于海水、盐湖等水域环境以及鱼虾、蟹贝类等海产品中,是引起海洋生物发生细菌性疾病的首要原因(Baker-Austin et al,2010;刘瑞等,2011;赵永刚等,2013;Tanguy et al,2013;高磊等,2014;Sun et al,2014)。目前,直接检测海洋中的致病性弧菌,往往由于目标菌太少而难以检测,所以一般都采用先增菌后检测的方式,而传统增菌方法不仅费时,且灵敏度低(赵玲等,2013)。为了加快对以上致病弧菌的检测速度及提高检测限,采用高效、简便的免疫磁珠法对样品进行分离富集,该法作为一种前处理手段,与其它检测方法结合使用,可大大缩短检测时间,提高检测限(苏晨曦等,2012)。Wang等(2013)用免疫磁分离技术结合酶联免疫吸附法(ELISA)检测苹果汁中的脂环酸芽孢杆菌属(Alicyclobacillus spp.),检测限为 103CFU/mL,与传统培养法相比,检测时间缩短了24—40倍。Zeng等(2014)用免疫磁分离与环介导等温扩增(LAMP)技术联合检测生蚝中的副溶血弧菌,在纯培养中,检测限为 1.4×102CFU/mL,且不受其它菌群的干扰;在生蚝样品中,检测限可达到1.9—0.19 CFU/g。目前,国内外已有不少学者利用免疫磁珠快速富集食品中的致病菌,如副溶血弧菌(黄韵仪等,2012;苏晨曦等,2012)、大肠杆菌O157: H7 (Escherichia coli O157: H7)(Zhu et al,2011;Chen et al,2014;Lin et al,2015)、李斯特菌(Listeria monocytogenes)(徐金亭等,2012)等,并结合 ELISA、LAMP、各种 PCR等方法实现对单个或者多种目标菌的定量检测(Yang et al,2007;Seo et al,2010;Zeng et al,2014)。
免疫磁珠分离技术基于抗原抗体间的特异性反应,高效浓缩目的样品,且可保留样品原有的生物活性,有利于后续检测,并广泛应用于致病菌检测的样品前期处理(闻一鸣等,2013a,b)。该法可以快速、特异性地从样品基质中富集致病弧菌,解决了传统致病菌检测过程中食品组份复杂、致病菌难分离、基质干扰大等问题(黄韵仪等,2012;王程程等,2013),如海水样品,只要将海水加到某种特异性免疫磁珠中,就能立即分离富集对应的致病菌,有效对样品中的目标菌进行捕获,起到富集浓缩的作用,从而减少前期增菌时间,缩小寻找目的菌范围,为后续检测减少了工作量(苏晨曦等,2012)。本研究制备的纳米免疫磁珠,可分别实现对4种海洋致病性弧菌的快速、特异性富集,这大大提高了检测的灵敏度和准确度,具有简便、快速、经济等特点,为更简便、快捷地定量检测致病弧菌做好了前期准备,也为开发4种海洋弧菌免疫磁珠试剂盒奠定了基础。
1 材料与方法
1.1 材料
副溶血弧菌(VP)ATCC 17802、创伤弧菌(VV)ATCC 27562、哈维氏弧菌(VH)ATCC 33868、灿烂弧菌(VS)ATCC 33125、阴沟肠杆菌(Enterobacter cloacae,EC)ATCC 13047、黄海希瓦氏菌(Shewanella marisflavi,SM)MCCC 1A02628、鳗弧菌(Vibrio anguillarum,VA)ATCC 43308、粪链球菌(Streptococcus faecalis,SF)ATCC 14506、迟缓爱德华氏菌(Edwardsiella tarda,ET)ATCC 15947购于青岛日水生物技术有限公司;4种弧菌抗体、牛血清白蛋白(BSA)、叠氮化钠(NaN3)购于生工生物工程(上海)股份有限公司;纳米四氧化三铁购于阿拉丁试剂(中国)有限公司;3-氨丙基三乙氧基硅烷(APTES)、25%戊二醛购于沃凯化成工业(上海)有限公司;3M Petrifilm菌落总数测试片购于美国3M公司。
1.2 方法
1.2.1 免疫磁珠的制备 将纳米四氧化三铁用APTES氨基化修饰后,再用戊二醛进行醛基化处理,然后用PBS清洗3次,最后加PBS重悬,4°C保存备用(何磊等,2008)。取5份1mL醛基化磁珠于1.5mL离心管,磁分离,用PBS清洗3次;分别加入75、150、300、600、1200μg VP多克隆抗体,37°C 于旋转混匀仪中偶联2h;置于磁分离器,去液相,用PBS清洗3次;加1mL含0.1% BSA和0.02% NaN3的PBS缓冲液,37°C于旋转混匀仪中封闭1h (王程程等,2013);磁分离,去液相,PBS清洗3次;最后加1mL PBS重新分散免疫磁珠,标为IMB-VP1—5 (75mg/mL),4°C保存备用。VH、VV、VS免疫磁珠的制备同上。
1.2.2 抗体加入量的优化 将–80°C 保存的菌接种至5mL海水牛肉膏蛋白胨培养基中,28°C振荡培养24h,用无菌PBS稀释菌液浓度。取IMB-VP1—5各3mg于1.5mL离心管,加1mL VP菌悬液,不加免疫磁珠的作为空白对照,37°C于旋转混匀仪中富集 45min,磁分离3min,去液相,用PBS清洗3次。最后将免疫磁珠-菌复合物重新分散在 1mL PBS中,接种于 3M 试纸,平行3次,28°C培养1—2d,计算其捕获率。
捕获率(capture efficiency,CE)(%)= Nc/N0×100,其中,Nc是免疫磁珠捕获到的细菌数,单位为CFU/mL;N0是空白对照中的细菌数,单位为CFU/mL。
1.2.3 免疫磁珠量的优化 分别取0.75、1.5、3、6、12mg IMB-VP3于1.5mL离心管,加1mL VP菌悬液,不加免疫磁珠的作为空白对照,37°C于旋转混匀仪中富集45min,磁分离3min,其它操作同1.2.2,计算捕获率。
1.2.4 免疫反应时间的优化 取3mg IMB-VP3于1.5mL离心管,加1mL VP菌悬液,不加免疫磁珠的作为空白对照,37°C于旋转混匀仪中分别富集5、15、30、45、60、90min,磁分离3min,其它操作同1.2.2,计算捕获率。
1.2.5 免疫磁珠分离时间的优化 取 3mg IMBVP3于1.5mL离心管,加1mL VP菌悬液,不加免疫磁珠的作为空白对照,37°C于旋转混匀仪中富集45min,磁分离分别为0.5、1、3、5、7 min,其它操作同1.2.2,计算捕获率。
1.2.6 pH的优化 取3mg IMB-VP3于1.5mL离心管,加1mL分别用 pH 6.0、pH 7.4、pH 8.0和 pH 9.6的PBS缓冲液稀释的VP菌悬液,不加免疫磁珠的作为空白对照,37°C于旋转混匀仪中富集45min,磁分离3min,其它操作同1.2.2,计算捕获率。VH、VV、VS免疫磁珠捕获细菌条件的优化同上。
1.2.7 超微结构观察 VP、VH、VV和 VS免疫磁珠分别与VP、VH、VV和VS菌体在PBS中结合,经过戊二醛固定以及乙醇梯度脱水后(闻一鸣等,2013a,b),在扫描电子显微镜(SEM)下观察免疫磁珠与其对应致病弧菌的结合情况。
1.2.8 免疫磁珠的灵敏度检测 分别取1mL菌浓度为100—107CFU/mL数量级的VP、VV、VH、VS菌悬液,添加3mg IMB-VP3,37°C于旋转混匀仪上孵育45min,磁分离3min,用PBS清洗3次,最后用1mL PBS重悬。涂3M试纸,重复3次,28°C培养1—2d,计算捕获率。检测VV、VH、VS免疫磁珠的灵敏度时按照各自最佳捕获条件进行实验,具体操作同上。
1.2.9 免疫磁珠的特异性以及抗干扰能力检测分别取VP、VV、VH、VS、EC、SF、ET、VA、SM菌液1mL,添加3mg IMB-VP3,37°C于旋转混匀仪上孵育 45min,磁分离 3min,用 PBS清洗3次,最后用1mL PBS重悬。涂3M试纸,重复3次,28°C培养1—2d,计算捕获率。用IMB-VP3对VP、VV、VS、VH 4种混合菌进行捕获,从而确定 VP免疫磁珠的抗干扰能力。检测VV、VH、VS免疫磁珠的特异性以及抗干扰能力操作同上。
2 结果与分析
2.1 抗体加入量
当VP抗体加入量在75—300μg之间时,捕获率逐渐增加,当加入的抗体量大于300μg时,捕获率开始下降,最后稳定在65%左右。当VH抗体加入量在75—600μg之间时,捕获率逐渐增加,当加入的抗体量大于600μg时,捕获率下降。当VV、VS抗体加入量在75—150μg之间时,捕获率逐渐增加,当加入的抗体量大于 150μg时,捕获率下降。VP免疫磁珠的最佳抗体加入量为300μg,捕获率为87.5%,VH免疫磁珠的最佳抗体加入量为600μg,捕获率达到94.2%,VV和VS免疫磁珠的最佳抗体加入量为150μg,捕获率分别为98.1%和85.5% (见图1)。
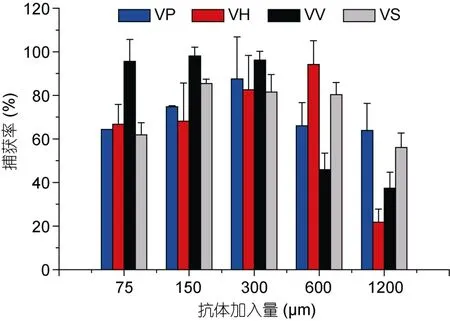
图1 抗体加入量对捕获率的影响Fig.1 Effect of antibody amount on capture efficiency
2.2 免疫磁珠量
当VP、VH免疫磁珠的加入量为0.75—3mg时,VP、VH免疫磁珠的捕获率逐步上升,分别达到89.8%和99.1%,当加入的免疫磁珠用量大于3mg时,捕获率会有所下降。VV免疫磁珠的加入量为 12mg时,捕获率达到最高,为98.3%。当VS免疫磁珠的加入量为0.75—6mg时,VS免疫磁珠的捕获率逐步上升,当加入的免疫磁珠用量大于 6mg时,捕获率基本趋于饱和(见图2)。
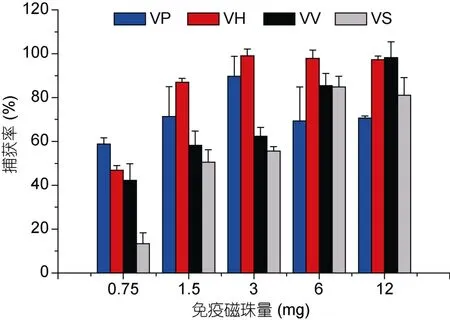
图2 免疫磁珠量对捕获率的影响Fig.2 Effect of IMBs (immunomagnetic beads)amount on capture efficiency
2.3 免疫反应时间
免疫反应时间在5—45min内,VP、VH免疫磁珠的捕获率逐渐增大,捕获率分别为 54.9%、63.0%、88.2%、89.1%和 75.2%、90.1%、92.1%、97.5%,说明磁珠与菌液反应的时间越长效果越好,但是当反应时间大于45min,效果就不明显。VV、VS免疫磁珠分别在60min、30min时捕获率最高(见图3)。
2.4 免疫磁分离时间
VP和 VS免疫磁珠在不同免疫磁分离时间的捕获效率分别为 57.3%、67.2%、89%、88.5%、85.8%和69.7%、71.5%、85.9%、69.7%、65.9%,捕获率随着磁分离时间延长到 3min时达到最高,时间再延长捕获率反而降低,说明3min为最佳磁分离时间。VV免疫磁珠在不同免疫磁分离时间内的捕获率分别为50.5%、58.2%、75.8%、98.9%、96.7%,免疫磁分离时间在5min时,捕获率达到最高。VH免疫磁珠在磁分离1min时达到85.9%的最高捕获率(见图4)。
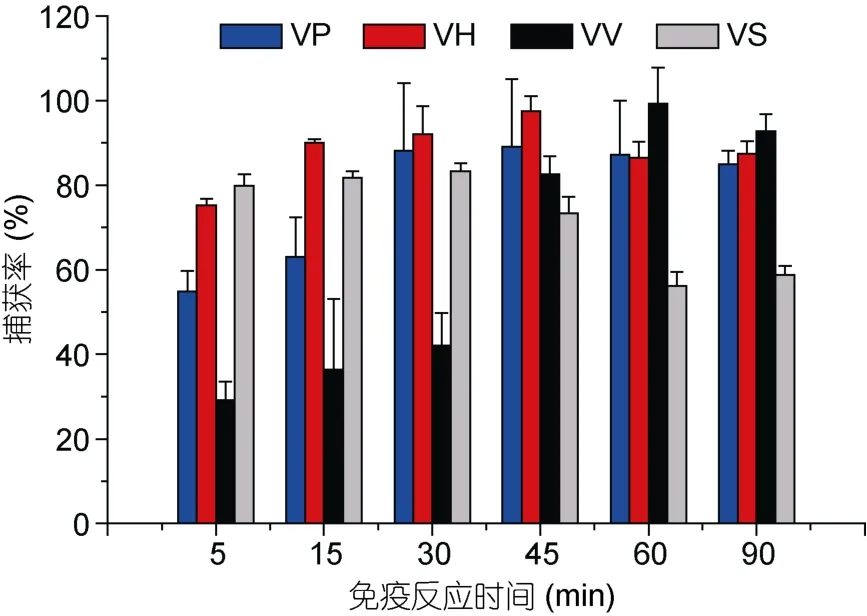
图3 免疫反应时间对捕获率的影响Fig.3 Effect of immunoreaction times on capture efficiency
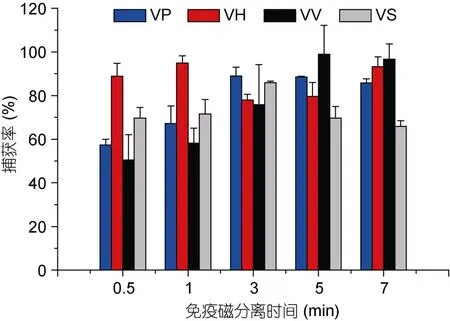
图4 免疫磁分离时间对捕获率的影响Fig.4 Effect of immunomagnetic separation times on capture efficiency
2.5 缓冲液pH
VP、VS免疫磁珠在pH 7.4的PBS缓冲液中捕获率最佳,VH免疫磁珠在pH 6.0的PBS缓冲液中捕获率最佳,VV免疫磁珠在pH 8.0的PBS缓冲液中捕获率最佳。在pH 9.6的PBS缓冲液中,VP免疫磁珠的捕获率为0,VS免疫磁珠的捕获率为12.3%,VH、VV免疫磁珠的捕获率均低于80%(见图5)。
2.6 超微结构
裸磁珠大部分颗粒呈现圆形,无不规则形状,颗粒大小相对均一,分散性较好,基本上没有成堆成团的现象(图6a),可用于制备免疫磁珠。当加入抗体后,醛基化磁珠分布在抗体液中,与抗体结合,开始出现聚集现象(图6b)。图6c—图6f分别表示VP、VH、VV和VS 4种免疫磁珠均能通过其表面的抗体分别与各自的抗原相结合,且菌体表面结合磁珠数量较多。4种弧菌都呈月牙般的弧状,免疫磁珠仍呈圆形,但大量聚集,一个菌体表面可与多个磁珠结合,从而使磁珠和菌体聚集在一起,呈团状。除VH免疫磁珠较少捕获到VH外,其余3种免疫磁珠均能大量捕获对应致病弧菌。
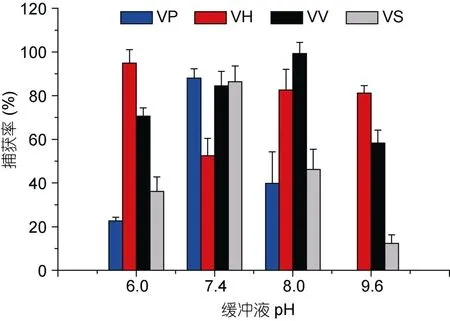
图5 不同pH缓冲液对捕获率的影响Fig.5 Effect of buffer at different pH values on capture efficiency
2.7 灵敏度
在最佳免疫捕获条件下,VP、VH、VV免疫磁珠分别捕获100—107CFU/mL数量级的VP、VH和VV,结果如图7所示,在 101—107CFU/mL浓度下,捕获率逐渐下降。VS免疫磁珠分别捕获100—104CFU/mL数量级的VS,在101—104CFU/mL浓度下,捕获率逐渐下降。4种免疫磁珠均可捕获到100CFU/mL数量级的相应致病弧菌,表明该免疫磁珠具有较高的灵敏度。
2.8 特异性和抗干扰能力
VP、VH、VV、VS 4种免疫磁珠对9株菌分别进行捕获。VP免疫磁珠对VP的捕获率为87.3%,对其它菌株的捕获率均低于 20%。VH、VV、VS免疫磁珠对其相应致病弧菌的捕获率均达到 90%以上,VH免疫磁珠对VV和VS的捕获率均为18.6%,对其余菌株的捕获率均低于15%;VV免疫磁珠对VS的捕获率为31.8%,对其余菌株的捕获率均低于20%;VS免疫磁珠对EC的捕获效率为26%,对其余菌株的捕获率均低于 20%。VP、VH、VV、VS 4种免疫磁珠抗干扰能力实验中,分别对VP、VV、VS、VH 4种混合菌进行捕获,4种免疫磁珠对其相应致病弧菌的捕获率均在 90%以上,且不受其它杂菌影响,说明此次制备的免疫磁珠特异性和抗干扰能力较强(见图8)。
3 讨论
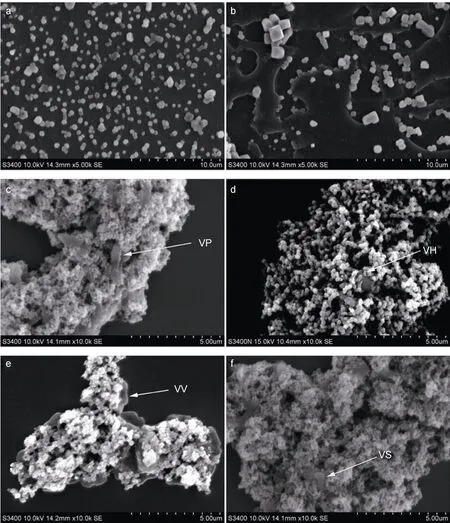
图6 免疫磁珠与致病弧菌结合的扫描电镜图Fig.6 SEM of pathogenic vibrio interacting with IMBs
用免疫磁珠富集样品中的目标菌,不仅能显著减少背景细菌的干扰,还能消除样品基质中的复杂成分,纳米免疫磁珠因其光学特性、比表面积等优势而在致病菌检测方面受到越来越多的关注(Leon-Velarde et al,2009;Wadud et al,2010;Wang et al,2013)。首先,随着磁珠粒径的减小,细菌表面可结合的磁珠数量增多,在磁分离时细菌从免疫磁珠上脱落下来的概率减少,同时,纳米磁珠比表面积较微米磁珠大,连接的抗体量更多,弥补了抗体亲和力不足的缺点,从而使捕获率增加(Pamme et al,2006)。其次,纳米磁珠粒径小,受布朗热运动作用大,在溶液中呈现单分散状态,加上纳米磁珠比表面积大,使得纳米磁珠表面上的抗体与抗原接触概率显著增加(McCloskey et al,2003a,b)。本研究所采用的是200nm的免疫磁珠,所以在致病菌捕获率方面较微米磁珠有极大优势,在106—107CFU/mL数量级下,VP、VH、VV和VS免疫磁珠分别在最优捕获条件下获得高达90%左右的捕获率,而之前报道的微米免疫磁珠捕获致病菌的效率通常在 32%—56%之间(Datt et al,2008)。Yang等(2007)分别用纳米磁珠与微米磁珠捕获单增李斯特菌,结果显示,纳米磁珠捕获率是微米磁珠捕获率的 1.4—26倍,另外,单增李斯特菌浓度越低,纳米磁珠捕获率与微米磁珠捕获率的差异更显著。钟子清等(2013)采用不同粒径免疫磁珠捕获单增李斯特菌,结果显示180nm、350nm、1180nm的免疫磁珠捕获细菌效率分别为95%、18%和9%。但是,免疫磁珠并不是粒径越小捕获率就越高。研究表明(王报贵等,2013),小于50nm的磁珠由于粒径太小可能会使目标菌死亡,且需要超强磁场和长时间的分离,才能有效富集目的菌。本实验采用平均粒径为200nm的免疫磁珠,在普通磁力架上 3min左右就可以有效分离致病菌,又由于比表面积大,不仅能与抗体有较多的结合位点,也使其与目标菌体表面积接触机会增大,所以捕获率较其它磁珠更高。即使菌液浓度很低(100CFU/mL数量级),磁珠也能捕获到目标菌,即检测限高,可达到2 CFU/mL。灵敏度实验中,VP、VH、VV和 VS菌液浓度分别为 101、102、100和 101CFU/mL数量级时,捕获率达到最高,分别为88%、93.5%、94.7%和 100%,且捕获率随着菌液浓度的升高而降低,这表明超出反应体系中纳米免疫磁珠容量后,磁珠捕获致病菌的数量不再增加,反而会受到限制(Zhu et al,2011)。
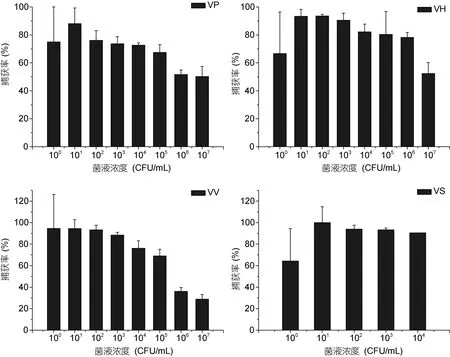
图7 免疫磁珠捕获的灵敏度实验Fig.7 The sensitivity of the IMBs capture
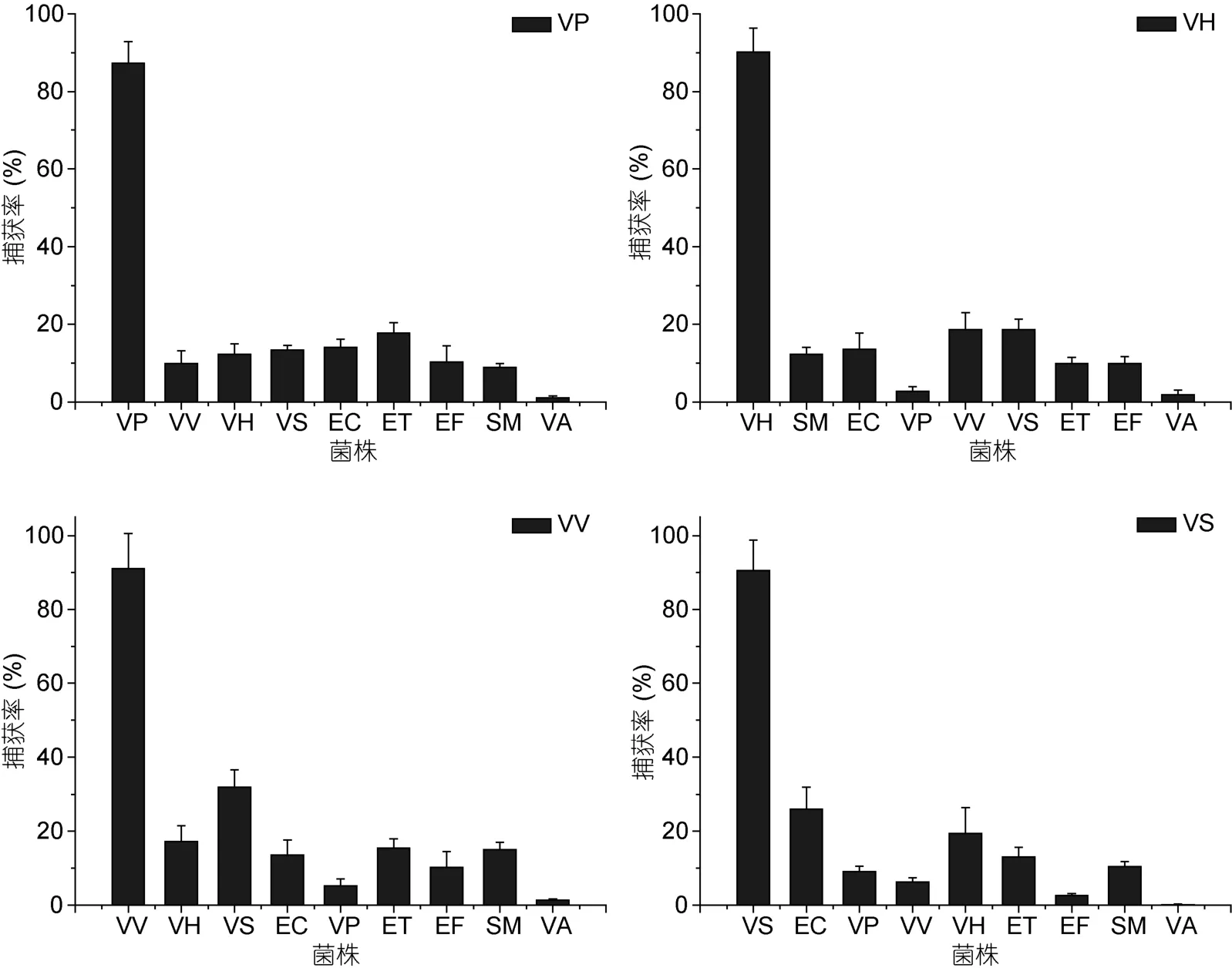
图8 免疫磁珠捕获的特异性实验Fig.8 The specificity of the capture of IMBs
抗体亲和力也会直接影响免疫磁珠捕获细菌的灵敏度,前期试验证明,4种多克隆抗体分别与其对应的菌株具有良好的亲和力,所以本实验4种免疫磁珠具有较高的灵敏度。特异性是评价免疫磁分离体系的另一个重要标准,本实验中,为了评价 VP、VH、VV和 VS 4种免疫磁珠的特异性,在 106—107CFU/mL数量级浓度下,对8株非目标菌和1株目标菌进行捕获,对目标菌的捕获率分别为 87.3%、90.1%、91.1%和90.5%,对非目标菌的捕获率除创伤弧菌对灿烂弧菌的捕获率在31.8%外,其余均在30%以内。4种免疫磁珠能分离出一部分非目标菌,原因可能是: (1)本实验采用的是多克隆抗体,多克隆抗体结合非目标菌的概率大于单克隆抗体;(2)非目标菌会被一些较大的磁颗粒吸附,当用磁场分离时,这些被较大的磁性颗粒吸附的非目标菌也会被分离。有研究证明(Zeng et al,2014;Lin et al,2015),微米磁珠比纳米磁珠的非特异性吸附强,原因是粒径大的磁珠的总磁力比粒径小的磁珠的总磁力强,在磁分离时间内,粒径大的磁珠更容易将菌(目标菌和非目标菌)吸附。所以,本实验采用200nm的免疫磁珠,其优势就在于能减少非特异性吸附率。另外,由于免疫反应时间短,清洗次数多(3—5次),加上本研究制备的纳米免疫磁珠最终均用0.1% BSA和0.02% NaN3进行封闭,所以实验获得的免疫磁珠对其目标菌的捕获率均在 87%以上,对非目标菌的捕获率大部分在30%以内,因为有研究证明(Chen et al,2014),这可以有效增强免疫磁珠与其抗原的特异性结合,从而减少非特异性吸附。
利用醛基化免疫磁珠对细菌进行富集,捕获率受抗体加入量、磁珠用量、免疫反应时间、免疫磁分离时间、缓冲体系 pH等诸多因素的影响(山珊等,2013;王程程等,2013;谢芳等,2013)。抗体加入量与免疫磁珠捕获细菌的效率呈正相关,但是当捕获率达到平台期后,增加抗体量并不能提高免疫磁珠的捕获率,有时候反而会使捕获率下降。实验中,当VP、VH、VV和VS抗体加入量分别为 300、600、150、150µg时,免疫磁珠的捕获率达到最高,分别为87.5%、94.2%、98.1%和85.5%,当抗体量再增加时,捕获率或降低或趋于平稳,导致该现象的原因是过量的抗体会使空间发生阻碍和竞争现象(黄韵仪等,2012),又由于免疫磁珠捕获细菌的整个过程是在不断振荡和洗脱中完成的,这就使得即使较多数量的抗体与磁珠结合,但其结合的稳定程度也远不如适量抗体和磁珠的结合,从而使抗体与磁珠分离,导致捕获率下降(王程程等,2013)。由此可见,抗体加入量过多不仅不能提高捕获率,还会造成抗体的浪费,增加检测成本。另外,免疫磁珠的用量也是影响捕获率的主要因素。在一定范围内,磁珠的用量与免疫磁珠捕获细菌的效率也呈正相关,但当达到一定捕获率后,增加磁珠用量并不能显著提高捕获率。实验中,VP、VH、VV和VS免疫磁珠用量分别超过 3、3、12和 6mg时,捕获率开始下降,该原因是捕获细菌需要在强磁场下进行,免疫磁珠用量过多,细菌表面多个抗原位点与磁珠结合,分离时会造成部分细菌受损,从而造成捕获率下降(赵玲等,2013)。除上述两个因素,免疫磁珠与细菌的作用时间也是影响捕获率的重要因素之一。随着免疫反应时间的增加,磁珠的捕获率也随之增加,但反应时间过长,反而会导致捕获率下降。本实验中分别研究免疫反应时间在5、15、30、45、60和 90min时的 4种免疫磁珠的捕获率情况,结果显示,VP、VH、VV和VS分别在45、45、60、30min 时达到了 89.1%、97.5%、99.3%、83.3%的最高捕获率,即免疫反应可在30—60min内完成,而一般用微米磁珠捕获致病菌都是在60—120min内完成的(Seo et al,2010;Zhu et al,2011),出现这种差异的原因是纳米免疫磁珠与靶细胞结合时具有较快的反应动力学。实验表明(Varshney et al,2005),在反应动力学方面,纳米免疫磁珠比1-100μm的磁珠快5—20倍。由于本实验采用的是纳米免疫磁珠,所以免疫反应时间较短。免疫反应一般是在pH 6.0—8.0之间进行,pH过低或者过高都可能影响抗体抗原的结合(刘伟伟等,2011;闻一鸣等,2013a,b)。pH过低会使抗体抗原解离,免疫磁珠捕获细菌效率降低;pH过高会使蛋白质破坏或者变性,抗体抗原无法结合,从而使捕获率下降,甚至出现零捕获,比如VP免疫磁珠在pH 9.6的时候,捕获率为 0。所以在免疫反应过程中,选择一个合适的pH是相当重要的。
免疫磁珠可直接从样品中捕获目标菌,解决了其它菌群的干扰和抑制问题,所以在抗干扰性实验中,加入其它菌群并不影响免疫磁珠对其靶细菌的富集。此外,免疫磁分离技术结合其它快速检测方法,可大大缩短检测时间,提高特异性和灵敏度。若用于实际食品检测中,可将待检样品富集浓缩,这将大大提高检测灵敏度和准确度,具有简便、快速、经济等特点,该检测方法对于食品(瘦肉精的磁珠富集)安全的筛查、诊断、治疗、监测和控制等也都具有重要的意义。
山 珊,牛瑞江,赖卫华等,2013.免疫磁珠法富集沙门氏菌的优化及应用.食品工业科技,34(13): 153—156
王报贵,武晓丽,董素琴等,2013.副溶血弧菌的磁珠捕获及检测.食品工业科技,34(13): 147—152
王程程,赵 玲,李敏通等,2013.基于免疫磁珠快速分离金黄色葡萄球菌的研究.食品工业科技,34(9): 175—178
刘 瑞,赵明君,杨 慧等,2011.副溶血弧菌(Vibrio parahaemolyticus)tdh2基因和鳗弧菌(V.anguillarum)ompU基因二联 DNA疫苗制备及其对大菱鲆(Scophthalmus maximus)免疫保护作用.海洋与湖沼,42(4): 580—586
刘伟伟,孙秀兰,张银志等,2011.超顺磁性免疫磁珠体系用于植物油中黄曲霉毒素 B1的检测研究.分析测试学报,30(12): 1345—1350
苏晨曦,孙晓红,卢 瑛等,2012.副溶血性弧菌免疫磁珠的制备及其应用.食品工业科技,33(17): 313—316
何 磊,郭雅飞,李智洋等,2008.免疫磁珠的制备.化工时刊,22(7): 5—6
赵 玲,王程程,李敏通等,2013.基于免疫纳米磁珠对福氏志贺氏菌的快速富集研究.食品工业科技,34(9):290—292
赵永刚,唐小千,战文斌,2013.副溶血弧菌trh基因的克隆、表达及基因缺失株的构建.海洋与湖沼,44(1): 38—42
钟子清,熊勇华,赖卫华等,2013.纳米免疫磁珠富集单核增生李斯特菌.食品科学,34(23): 212—215
闻一鸣,李志清,童吉宇等,2013a.免疫磁珠富集技术联合选择性培养基快速检测单增李斯特菌.生物工程学报,29(5):672—680
闻一鸣,徐金亭,向军俭,2013b.免疫磁珠富集技术进展.中国免疫学杂志,29(1): 88—92
徐金亭,李志清,向军俭等,2012.单增李斯特菌免疫磁珠的制备研究.食品工业科技,33(5): 323—327
高 磊,邓益琴,刘助红等,2014.石斑鱼及暂养环境中副溶血弧菌分离鉴定与毒力评价.海洋与湖沼,45(6):1280—1287
黄韵仪,胡连花,孙力军等,2012.副溶血性弧菌免疫磁珠偶联条件优化及捕获性能评价.微生物学杂志,32(6):7—11
谢 芳,赖卫华,史爱武等,2013.免疫磁珠富集结合酶联免疫吸附法检测酱油中黄曲霉毒素 B1.食品科学,34(18):165—169
Baker-Austin C,Stockley L,Rangdale R et al,2010.Environmental occurrence and clinical impact of Vibrio vulnificus and Vibrio parahaemolyticus: a European perspective.Environmental Microbiology Reports,2(1): 7—18
Chen J,Shi X M,Gehring A G et al,2014.Automated immunomagnetic separation for the detection of Escherichia coli O157: H7 from spinach.International Journal of Food Microbiology,179: 33—37
Datta S,Janes M E,Simonson J G,2008.Immunomagnetic separation and coagglutination of Vibrio parahaemolyticus with anti-flagellar protein monoclonal antibody.Clinical and Vaccine Immunology,15(10): 1541—1546
Leon-Velarde C G,Zosherafatein L,Odumeru J A,2009.Application of an automated immunomagnetic separationenzyme immunoassay for the detection of Salmonella enterica subspecies enterica from poultry environmental swabs.Journal of MIcrobiological Methods,79(1): 13—17
Lin J H,Li M,Li Y B et al,2015.A high gradient and strength bioseparator with nano-sized immunomagnetic particles for specific separation and efficient concentration of E.coli O157: H7.Journal of Magnetism and Magnetic Materials,378: 206—213
McCloskey K E,Chalmers J J,Zborowski M,2003a.Magnetic cell separation: characterization of magnetophoretic mobility.Analytical Chemistry,75(24): 6868—6874
McCloskey K E,Moore L R,Hoyos M et al,2003b.Magnetophoretic cell sorting is a function of antibody binding capacity.Biotechnology Progress,19(3): 899—907
Pamme N,Wilhelm C,2006.Continuous sorting of magnetic cells via on-chip free-flow magnetophoresis.Lab on a Chip,6(8): 974—980
Seo S M,Cho I H,Jeon J W et al,2010.An ELISA-on-a-chip biosensor system coupled with immunomagnetic separation for the detection of Vibrio parahaemolyticus within a single working day.Journal of Food Protection,73(8): 1466—1473
Sun B G,Dang W,Sun L et al,2014.Vibrio harveyi Hsp70:Immunogenicity and application in the development of an experimental vaccine against V.harveyi and Streptococcus iniae.Aquaculture,418—419: 144—147
Tanguy M,McKenna P,Gauthier-Clerc S et al,2013.Functional and molecular responses in Mytilus edulis hemocytes exposed to bacteria,Vibrio splendidus.Developmental &Comparative Immunology,39(4): 419—429
Varshney M,Yang L J,Su X L et al,2005.Magnetic nanoparticle-antibody conjugates for the separation of Escherichia coli O157: H7 in ground beef.Journal of Food Protection,68(9): 1804—1811
Wadud S,Leon-Velarde C G,Larson N et al,2010.Evaluation of immunomagnetic separation in combination with ALOA Listeria chromogenic agar for the isolation and identification of Listeria monocytogenes in ready-to-eat foods.Journal of Microbiological Methods,81(2): 153—159
Wang Z L,Yue T L,Yuan Y H et al,2013.Development and evaluation of an immunomagnetic separation-ELISA for the detection of Alicyclobacillus spp.in apple juice.International Journal of Food Microbiology,166(1): 28—33
Yang H,Qu L W,Wimbrow A N et al,2007.Rapid detection of Listeria monocytogenes by nanoparticle-based immunomagnetic separation and real-time PCR.International Journal of Food Microbiology,118(2): 132—138
Zeng J,Wei H Y,Zhang L et al,2014.Rapid detection of Vibrio parahaemolyticus in raw oysters using immunomagnetic separation combined with loop-mediated isothermal amplification.International Journal of Food Microbiology,174: 123—128
Zhu P X,Shelton D R,Li S H et al,2011.Detection of E.coli O157: H7 by immunomagnetic separation coupled with fluorescence immunoassay.Biosensors and Bioelectronics,30(1): 337—341
