水杨酸对蛋白核小球藻(Chlorella pyrenoidosa)生长及抗逆相关基因的影响*
2015-04-10丁聪聪徐年军李亚鹤
丁聪聪 徐年军① 张 琳 孙 雪 李亚鹤
(1.宁波大学海洋学院 宁波 315211;2.浙江省海洋生物工程重点实验室 宁波 315211)
小球藻(Chlorella)为绿藻门(Chlorophyta)、Trebouxiophyceae纲、小球藻科(Chlorellaceae)的一类单细胞藻类,在自然界广泛分布。小球藻中常见种主要有普通小球藻(C.vulgaris)、蛋白核小球藻(C.pyrenoidosa)、椭圆小球藻(C.ellipsoidea)等。蛋白核小球藻因生长快、易培养,及其独有的具有很高药用价值的小球藻生长因子(CGF)而广受关注。温度作为重要的环境因素之一,在小球藻生长和光合作用中发挥了重要作用 (欧阳峥嵘等,2010)。水杨酸作为一种新型植物激素已成为植物体内的重要信号分子来诱导逆境防御机制,参与并调节逆境胁迫。大量的研究证实水杨酸可以提高植物对低温(Lei et al,2010)、高温(Li et al,2015)、盐害(Jayakannan et al,2015)等胁迫的抗性。
热激蛋白(heat stock proteins,HSPs)作为植物体对逆境短期响应的一种分子伴侣,能阻止细胞内变性蛋白发生聚集,并对其进行修复(Fu et al,2009),可提高机体耐热性,减轻逆境胁迫对机体的伤害( Koizumi et al,2014)。大量研究发现,逆境条件如高温、高盐、重金属、干旱和病害等多种胁迫都可诱导HSPs的合成(Timperio et al,2008;周向红等,2010)。其中 HSP70是热激蛋白家族中的重要成员,参与真核细胞新生肽段折叠、定位等正常生命活动过程,以及DNA修复、抗氧化活性、光保护物质等多种应激反应。藻类中关于HSP的研究已经比较多,其中褐藻门的裙带菜(Undaria pinnatifida)和海带(Laminaria japonica)(Henkel et al,2008;Fu et al,2009)、红藻门的龙须菜(Gracilaria lemaneiformis)(Gu et al,2012)、绿藻门的孔石莼(Ulva pertusa)(Tominaga et al,2010)等都有HSP70基因的相关报道。Liu等(2014)克隆了普通小球藻 HSP90基因,但目前尚无蛋白核小球藻HSP70基因克隆和表达的相关报道。
磷酸甘油酸激酶(phosphoglycerate kinase,PGK)是生物体内糖酵解过程中的关键酶,缺乏此酶可引起生物体代谢功能紊乱。磷酸甘油酸激酶在催化1,3-二磷酸甘油酸转变成 3-磷酸甘油酸时,产生一分子的ATP。逆境条件下,植物需消耗大量能量来提高抗性,而能量主要来源为糖酵解途径(Wang et al,2009)。目前关于PGK的研究主要集中在动物方面(Wang et al,2014),植物方面有部分蛋白组学相关研究(蒋际谋等,2014),基因表达水平研究较少(Ding et al,2014),而藻类中的研究更少。Shingaki-Wells等(2011)发现,缺氧环境下,水稻胚芽鞘中PGK活性提高,并证实了在适应缺氧环境的过程中水稻胚芽鞘酵解和酒精发酵增强。而高温下水杨酸对糖代谢分子水平的影响方面的研究还很少。
本文从蛋白核小球藻中分离鉴定了其 HSP70和PGK基因序列,并研究了高温胁迫下水杨酸对蛋白核小球藻生长、可溶性糖和蛋白含量及 HSP70和PGK基因转录水平的影响。相关研究结果可为水杨酸在抗高温胁迫方面的应用及其作用机制等提供一定的参考。
1 材料与方法
1.1 材料
蛋白核小球藻 820藻株来自宁波大学海洋生物工程重点实验室藻种室,培养基为 f/2培养基,培养温度为25°C,光照强度为3500 lx,光照周期为 12L:12D。
1.2 引物序列
从GenBank数据库中搜索莱茵衣藻(Chlamydomonas reinhardtii)、普通小球藻等的 HSP70序列,利用ClustalX 1.83软件进行比对,根据其保守核苷酸序列设计简并引物,扩增出两条基因的部分 cDNA序列,然后根据这部分cDNA序列使用Primer Premier 5.0软件来设计5′ RACE和3′ RACE引物(所用各引物序列见表1)。
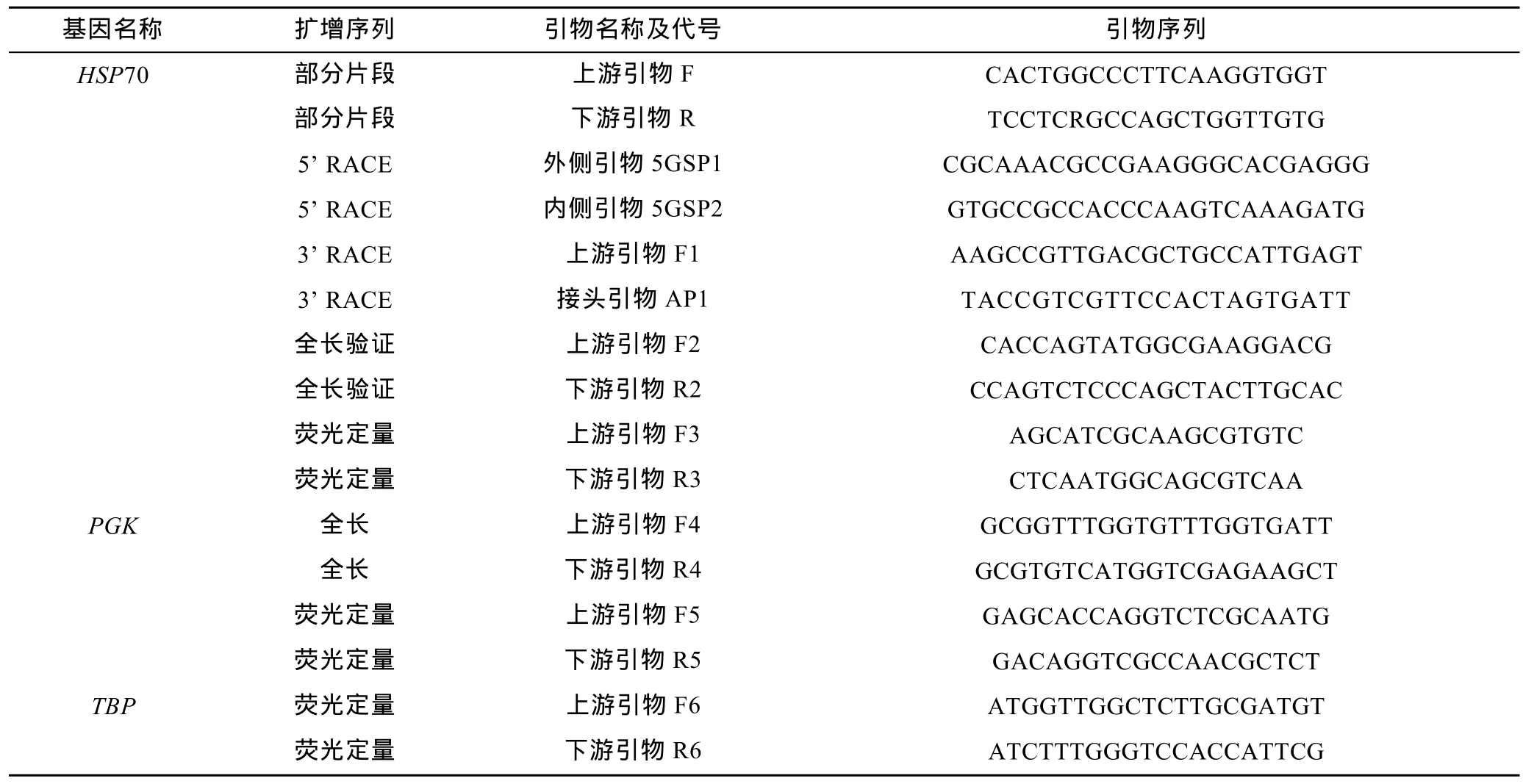
表1 蛋白核小球藻HSP70和PGK基因克隆和荧光定量所用引物Tab.1 Primer sequences of cloning and real-time PCR for HSP70 and PGK in C.pyrenoidosa
1.3 HSP70部分cDNA片段的克隆
首先8000 r/min离心5min收集对数期的蛋白核小球藻,无菌水洗涤藻细胞后再次离心。再按 Trizol试剂说明提取小球藻总RNA,检测总RNA质量合格后根据 PrimeScript®RT reagent Kit (TaKaRa)反转录试剂盒说明书反转录为cDNA,以该cDNA为模板利用简并引物进行 PCR扩增。1%琼脂糖凝胶电泳检测PCR产物后,GenClean琼脂糖凝胶回收试剂盒回收目的片段,连接至 pMD18-T载体,连接后的产物导入大肠杆菌(E.coli)DH5α感受态细胞,阳性克隆送去华大基因(上海)科技服务有限公司测序。
1.4 HSP70的RACE扩增
利用 SMARTerTMRACE cDNA扩增试剂盒(Clontech公司)获得基因的 5’端序列。根据PrimeScript®RT reagent Kit(Takara)反转录试剂盒说明书进行3’ RACE cDNA的制备,3’ RACE adaptor代替试剂盒中的OligodT Primer和Random 6 mers进行反转录反应。以合成的cDNA为模板,特异性引物F、接头引物AP1作为上下游引物进行3’ RACE PCR扩增。
1.5 HSP70和PGK基因全长的获得及验证
将测序得到的HSP70基因的部分片段、5’ RACE和3’ RACE片段一起拼接得到其全长cDNA序列。PGK基因序列来自实验室已测蛋白核小球藻的转录组测序结果。为了验证两条基因序列的正确性,再从基因两端的非翻译区(UTR)区设计一对引物,利用Pyrobest Polymerase (TaKaRa)进行PCR扩增。产物的回收、转化等同1.3,将阳性克隆送去测序。
1.6 HSP70和PGK基因的序列分析
将HSP70和PGK基因在NCBI的Blastx中(http://www.ncbi.nlm.nih.gov/blastx)进行同源性比对;用ORF Finder (http: //www.ncbi.nlm.nih.gov/gorf/gorf.html)推测开放阅读框;利用 ExPASy Proteomics Server(http: //web.expasy.org)进行氨基酸序列分析;利用ClustalX和MEGA 5.0软件中的邻接法(NJ)分别进行多序列比对和系统进化树构建。
1.7 HSP70和PGK基因转录水平的定量分析
样品处理: 处理温度为 35°C,在处于对数中期的蛋白核小球藻中加入水杨酸母液,使其终浓度分别为0、1、5、10、15和20μg/mL,每组设三个平行,培养12h和24h后取样。根据获得的HSP70和PGK基因设计荧光定量PCR引物(表1)。以TATA结合蛋白(TATA-binding protein,TBP)做内参基因,根据其cDNA序列设计荧光定量PCR引物(表1)。将TBP、HSP70和PGK的荧光定量PCR引物扩增序列进行克隆与测序鉴定。
荧光定量PCR采用SYBR®Premix Ex TaqTM试剂盒,反应体系: 10 μL SYBR Premix Ex Taq,正反向引物(10 μmol/L)各 0.4 μL,2 μL cDNA 模板,RNA-free水补足体积至 20 μL。PCR循环参数为 95°C预变性2min;然后按 95°C 变性 15s,55°C复性 15s,72°C延伸20s的程序进行40个循环;PCR结束后进行熔解曲线分析 95°C 15s,60°C 15s,95°C 15s(一个循环)。每个样品三个平行。采用2–ΔΔCt方法分析HSP70和PGK的相对表达量。并用Origin 7.0软件进行差异显著性分析。
1.8 生长及生化指标的测定
不同浓度水杨酸处理蛋白核小球藻24h和48h后,利用分光光度计测定 680nm下藻的吸光值。根据吸光值与藻细胞密度的标准曲线图计算出细胞密度,并根据μ=(lnN–lnN0)/(t–t0)计算藻的比生长速率。其中N0为初始培养时间t0时的细胞密度,N为t时的细胞密度。可溶性糖含量测定采用硫酸蒽酮法,可溶性蛋白含量测定用考马斯亮蓝法(李合生,2000)。
1.9 统计分析
数据处理和统计分析采用Origin7.0软件,差异显著水平检验用的是单因素方差分析(one-way ANOVA),P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 HSP70和PGK基因的扩增
使用 HSP70简并引物扩增得到 1518 bp长的cDNA 部分片段,将其与 3′ RACE扩增得到的长为611 bp的产物与长900 bp的5′ RACE产物一起拼接,得到全长为 2405 bp的 HSP70基因(GenBank号:KP694307),包括1959 bp的开放阅读框(ORF)、60 bp的 5’端非编码区(5’-UTR)和 386 bp 的 3′端非编码区(3’-UTR)。其中ORF区编码652个氨基酸,Expasy分析显示其分子量大小为 71.59 kDa,理论等电点为5.12。利用引物 F4和 R4扩增得到全长 1664 bp的PGK基因(GenBank号: KP694308),包括 35 bp的5’-UTR,1398 bp 的 ORF 和 231 bp 的 3’-UTR,其中ORF编码465个氨基酸,推测其分子量为49.16 kDa,理论等电点为7.01。
2.2 HSP70和PGK基因的分析
将由HSP70的cDNA序列推导出的氨基酸序列与其它物种的 HSP70氨基酸序列进行多序列比对(图1),结果表明该蛋白核小球藻与普通小球藻和小球藻 C.variabilis的同源性均高达 91%,与拟南芥(Arabidopsis thaliana)的同源性为83%。我们在HSP70氨基酸的多序列比对中发现序列保守性强的区域,包含了三个典型的HSP70家族签名基序,其氨基酸残基序列分别为 10—17(IDLGTTYS)、203—216 (IFDLGGGTFDVSLL)、339—354(VVLVGGSTRIPKVQQ),及细胞质定位的 C-末端的特征基序(EEVD)。
利用邻接法构建了基于 HSP70氨基酸序列的系统进化树。进化树分析显示,蛋白核小球藻 HSP70氨基酸序列与普通小球藻和小球藻C.variabilis亲缘关系最近,先聚为一支,然后再与其它植物聚为一 组,符合其传统的分类地位(图2)。

图1 蛋白核小球藻与其它物种的HSP70氨基酸的多序列比对结果Fig.1 Alignment of HSP70 amino acid sequences of C.pyrenoidosa and other species
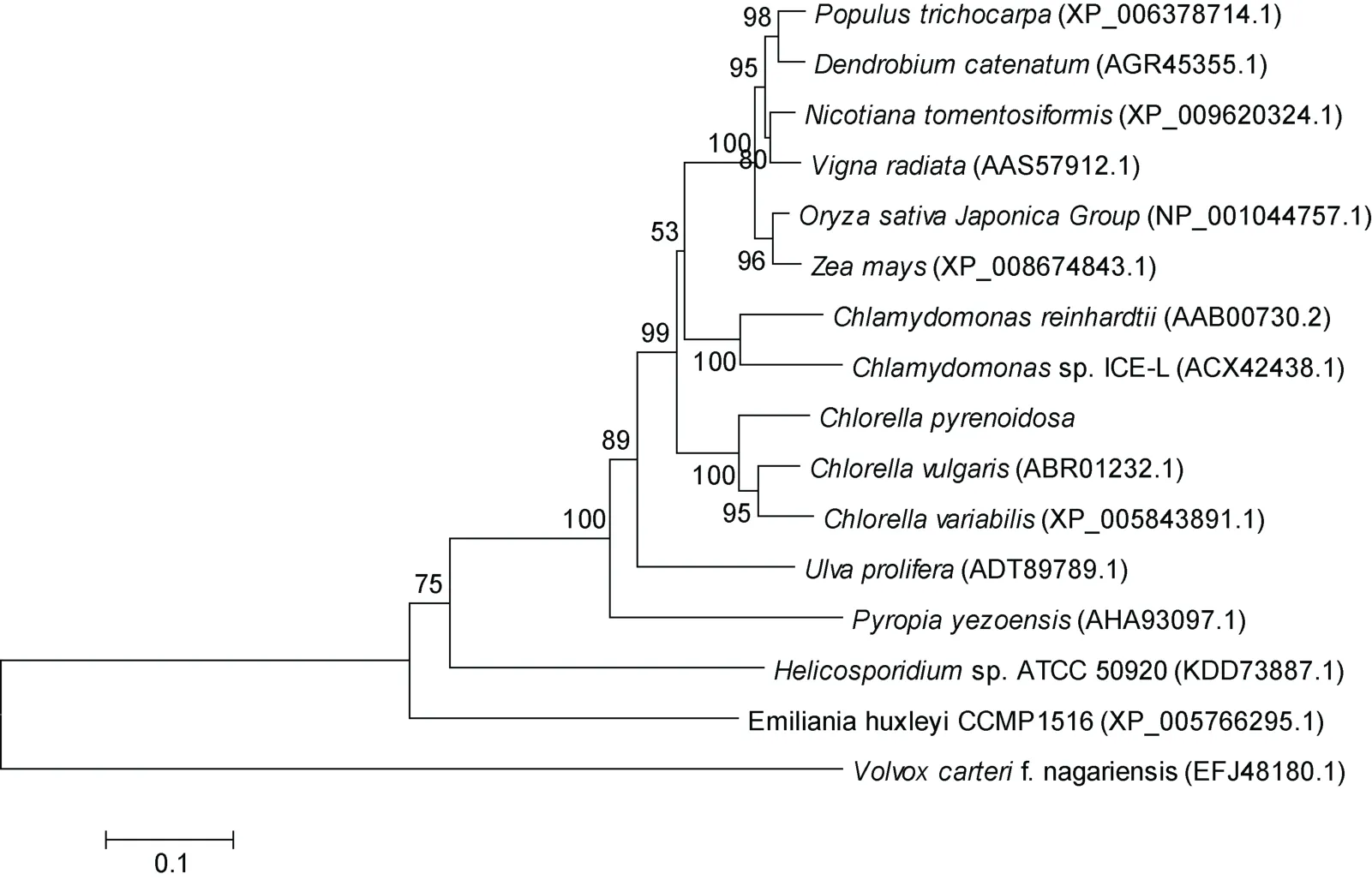
图2 不同物种基于HSP70氨基酸序列的系统进化树Fig.2 Phylogenetic tree of different species based on HSP70 amino acid sequences
Blastx分析结果表明蛋白核小球藻的PGK氨基酸序列与团藻(Volvox carteri f.nagariensis)有75%的相似性,与莱茵衣藻(Ch.reinhardtii)相似性为73%。氨基酸多序列比对中连续序列YVNDAFG、AHRAHAST、WNGPMGVFEF、TIIGGGDSV、MSHISTGGGASLEL保守性较强(图3)。分析基于PGK氨基酸序列构建的进化树,发现蛋白核小球藻与莱茵衣藻和团藻亲缘关系最近,聚为一支,其它高等植物则聚在一起(图4)。以上结果表明不同物种的HSP70和PGK在进化过程中是比较保守的,其氨基酸序列同源性较高。

图3 蛋白核小球藻与其它物种的PGK氨基酸的多序列比对结果Fig.3 Alignment of PGK amino acid sequences of C.pyrenoidosa and other species
2.3 不同浓度水杨酸对HSP70和PGK基因表达的影响
不同浓度水杨酸对HSP70(图5)和PGK(图6)基因表达的影响在12h和24h均呈现相同的趋势。水杨酸添加后,HSP70和 PGK基因表达量均增加,在 0—10μg/mL浓度范围内两基因的表达水平随着水杨酸浓度的升高而增加,随着水杨酸浓度的继续升高两者的表达量有所下降。其中10 μg/mL水杨酸浓度下两基因的表达量最高。
在水杨酸处理12h和24h时,HSP70的相对表达量与对照组均有显著性差异(P<0.05),且 12h时(图5A)1、5、10、15μg/mL水杨酸处理组与对照组差异极显著(P<0.01);而24h时(图5B)5个处理组与对照组差异均极显著(P<0.01)。在水杨酸处理 12h时,10μg/mL水杨酸浓度组中 HSP70表达量为对照组的2.57倍,在24h则为对照组的1.71倍。
在水杨酸处理12h(图6A)和 24h(图6B)时,PGK的相对表达量在1、5、10、15 μg/mL水杨酸处理组和对照组均有显著性差异(P<0.05),且5、10 μg/mL水杨酸处理组与对照组差异极显著(P<0.01)。12h时,10μg/mL水杨酸浓度下 PGK表达量为对照组的1.56倍,24h则为对照组的1.79倍。以上结果说明水杨酸促进了HSP70和PGK的表达,且10 μg/mL效果最好。
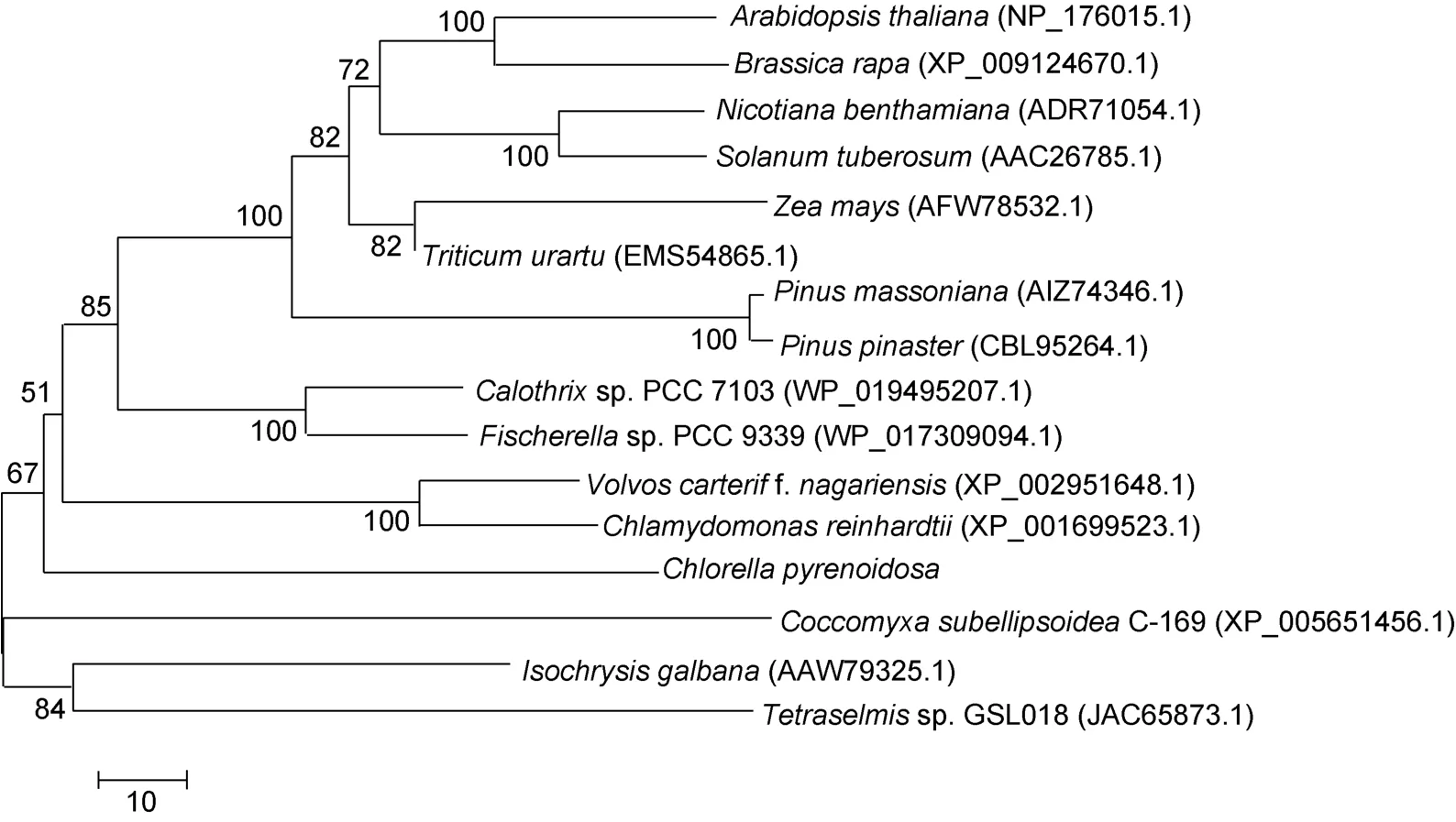
图4 不同物种基于PGK氨基酸序列构建的系统进化树Fig.4 Phylogenetic tree of different species based on PGK amino acid sequences
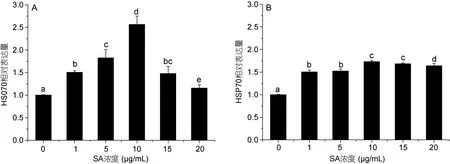
图5 不同浓度水杨酸对高温培养蛋白核小球藻HSP70基因表达的影响(A: 12h,B: 24h)Fig.5 Effects of salicylic acid concentration on HSP70 relative expression of C.pyrenoidosa under high temperature (mean±SD)(A: 12h,B: 24h)
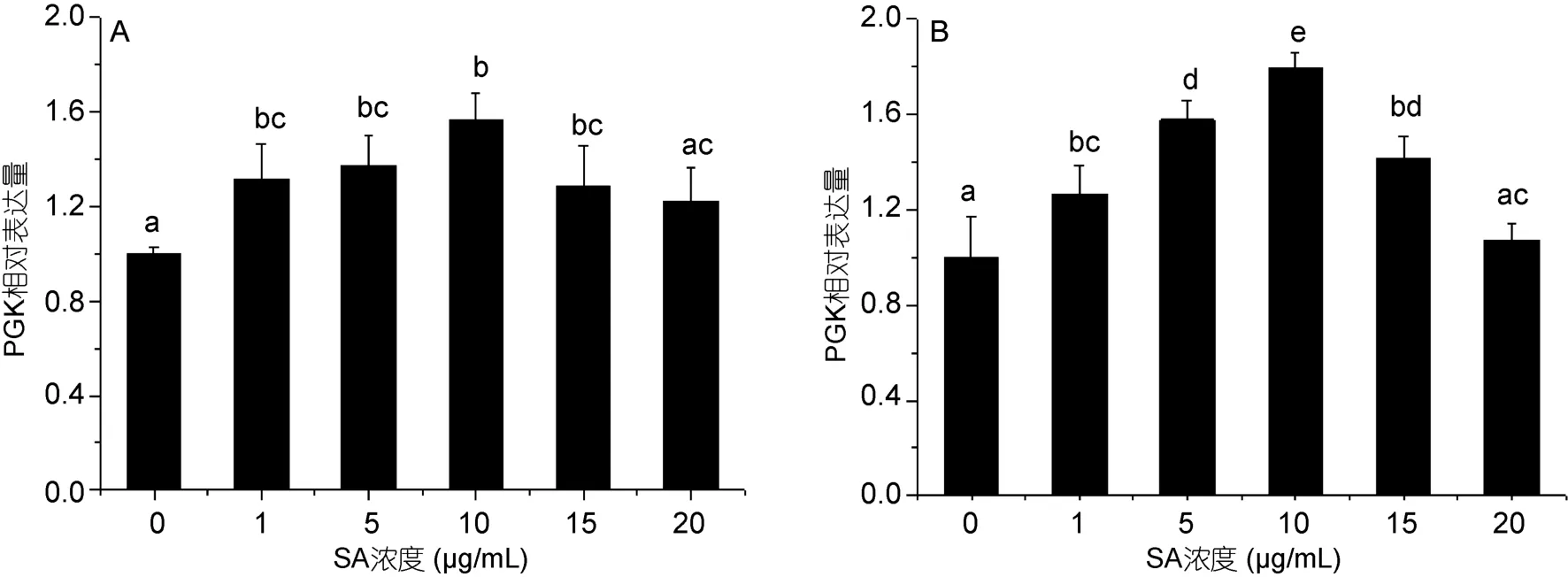
图6 不同浓度水杨酸对高温培养蛋白核小球藻PGK基因表达的影响(A: 12h,B: 24h)Fig.6 Effects of salicylic acid concentration on PGK relative expression of C.pyrenoidosa under high temperature (mean±SD)(A: 12h,B: 24h)
2.4 不同浓度水杨酸对蛋白核小球藻生长的影响
不同浓度水杨酸处理对高温胁迫后蛋白核小球藻生长有明显的影响(图7)。随着水杨酸浓度的升高,蛋白核小球藻比生长速率(μ)均有所提高,且在一定范围内随着水杨酸浓度的增加而增加。其中高温胁迫24h时(图7A),5和10μg/mL水杨酸添加后,藻的比生长速率均显著高于对照组(P<0.05),且在5 μg/mL浓度下达到最高,为对照组的 2.55倍。在 48h时,5-20μg/mL水杨酸添加后藻的比生长速率显著高于对照组(P<0.05),而在 10μg/mL浓度下最高,为对照组的 2.07倍。该结果说明一定浓度的水杨酸促进了高温培养蛋白核小球藻的生长,其中5和10 μg/mL水杨酸促进作用最好。
2.5 不同浓度水杨酸对可溶性蛋白和可溶性糖含量的影响
不同浓度水杨酸处理对高温胁迫后蛋白核小球藻可溶性蛋白(图8)和可溶性糖含量(图9)有一定的影响。随着水杨酸浓度的增加,小球藻的可溶性蛋白和糖含量均有所增加,且在一定浓度范围内,蛋白和糖含量的增加量与水杨酸浓度呈正相关。其中高温胁迫24h和48h时,5个水杨酸处理组藻的蛋白含量均高于对照组(P<0.05),且在 10μg/mL水杨酸组中最高,分别是对照组的1.51和1.18倍。
在高温胁迫24h时,仅1、5、10μg/mL水杨酸处理组藻的可溶性糖含量有所增加(P<0.05);在48h时,5个水杨酸处理组藻的可溶性糖含量均高于对照组。在10μg/mL水杨酸组中,小球藻的糖含量最高,分别是对照组的1.10 和1.34倍。以上结果说明一定浓度的水杨酸促进了蛋白核小球藻可溶性蛋白和可溶性糖含量的增加。
3 讨论
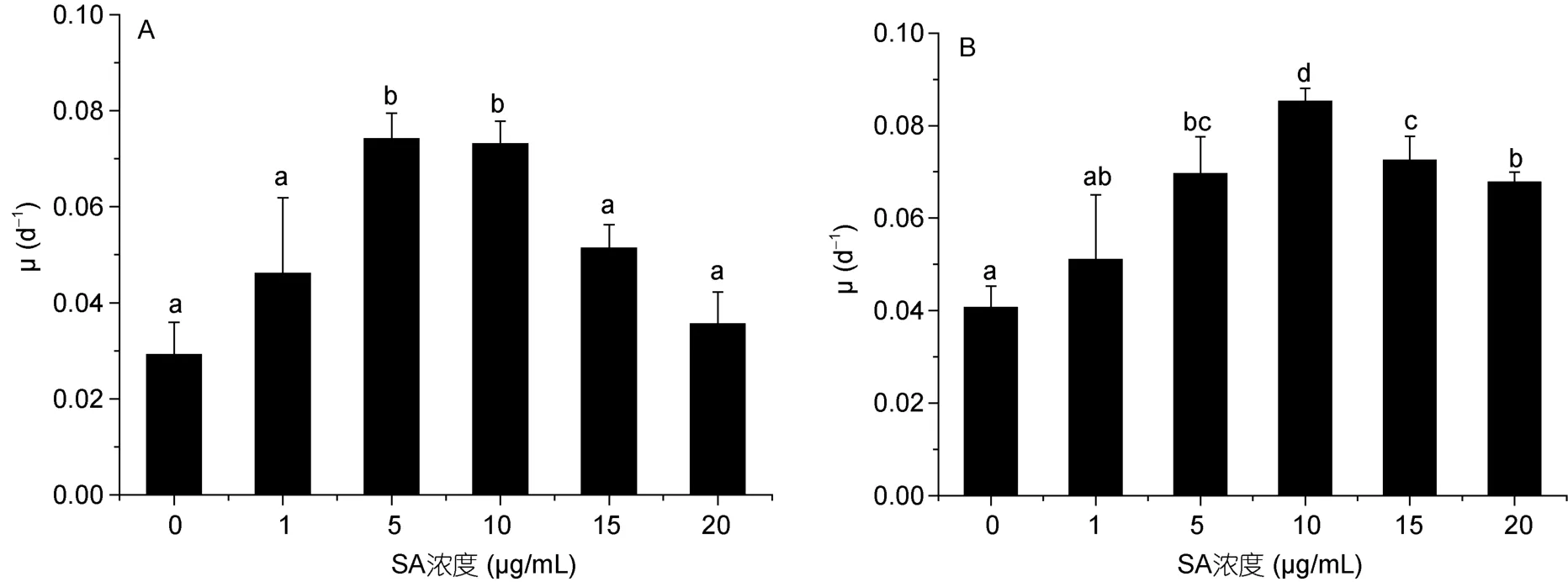
图7 不同浓度水杨酸对高温培养蛋白核小球藻生长的影响(A: 24h,B: 48h)Fig.7 Effects of salicylic acid concentration on C.pyrenoidosa grown in high temperature (mean±SD)(A: 12h,B: 24h)
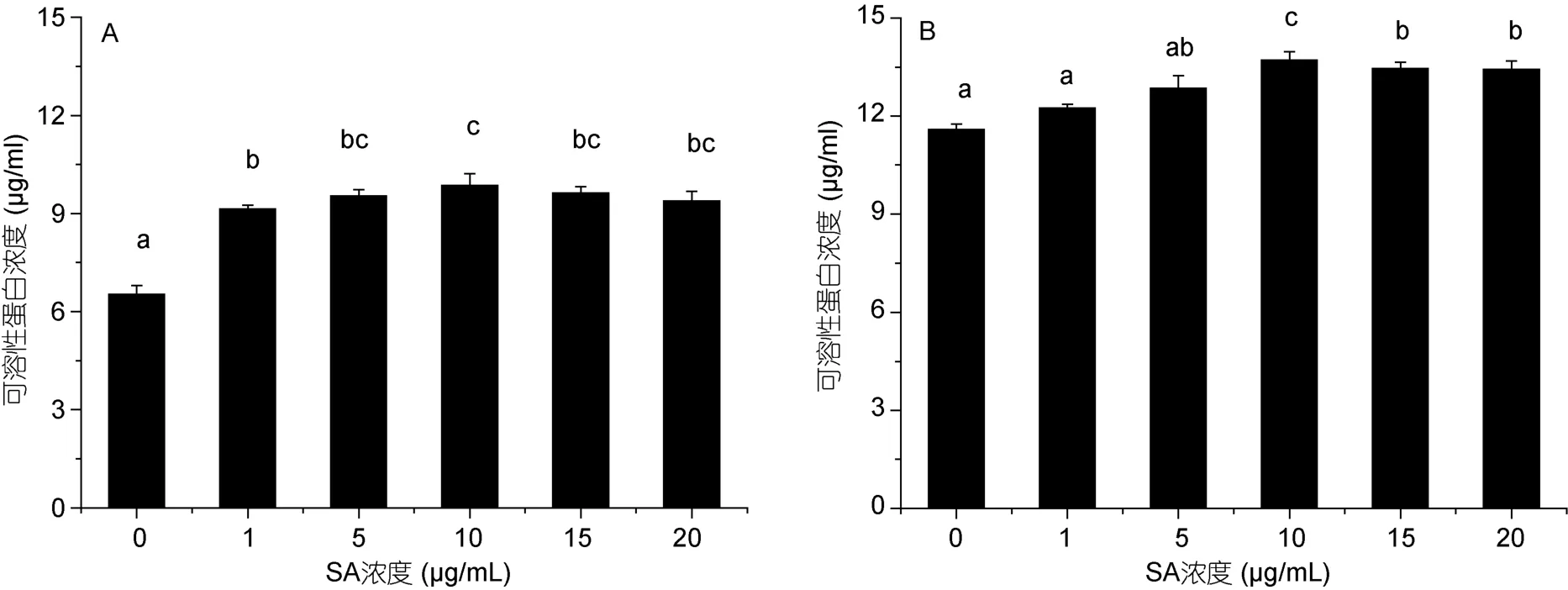
图8 不同浓度水杨酸对高温培养蛋白核小球藻可溶性蛋白含量的影响(A: 24h,B: 48h)Fig.8 Effects of salicylic acid concentration on soluble protein content of C.pyrenoidosa under high temperature (mean±SD)(A: 12h,B: 24h)
藻类在生长过程中往往受到多种逆境(高温、低温、高盐等)的影响,作为一种胁迫生物指示物,HSPs已得到广泛关注(Dahlhoff,2004;Elyse Ireland et al,2004)。在逆境胁迫状态时,生物体大量表达HSPs阻止变性蛋白的聚集,修复变性蛋白,并运送未成熟的蛋白质完成包装、代谢、修复,增加细胞抗逆性。有研究发现水杨酸参与植物的抗热反应,它可通过调节活性氧、抗氧化物质含量及活性来提高植物抗逆性(Qu et al,2013)。何亚丽等(2002)研究认为,SA通过促进植物在高温胁迫下合成大量的热激蛋白,保持较高的超氧化物歧化酶和过氧化氢酶活性,提高抗氧化能力,降低高温对细胞产生的伤害,从而提高植物抗热性。Pan等(2006)发现豌豆受到高温胁迫时,SA处理可诱导 HSP70的合成。而番茄在面临高温环境时,外施SA可诱导HSP70 mRNA转录和热休克因子基因表达增强,积累HSP70蛋白(Snyman et al,2008)。本研究发现水杨酸添加后,蛋白核小球藻 HSP70的表达量不同程度地得到提高,且在水杨酸处理浓度为10 μg/mL时HSP70表达量最高。该结果说明高温条件下水杨酸可以促进 HSP70的转录水平表达,从而大量合成 HSP70蛋白,修复受损细胞使生物体抵御高温环境,从而维持正常的生命活动状态。
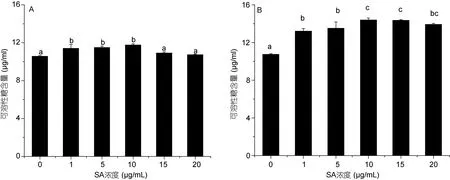
图9 不同浓度水杨酸对高温培养蛋白核小球藻可溶性糖含量的影响(A: 24h,B: 48h)Fig.9 Effects of salicylic acid concentration on soluble sugar content of C.pyrenoidosa under high temperature (mean±SD)(A: 12h,B: 24h)
高温条件下植物呼吸作用急剧升高,分解代谢增强,能量消耗增加。Gammulla等(2010)认为高温对水稻糖酵解途径具有负面的影响,且降低细胞能量的产生。磷酸甘油酸激酶(PGK)的编码基因在整个高温处理过程中表达持续上调(Zhang et al,2012)。而关于水杨酸处理后 PGK的变化研究较少。Suzuki等(2014)认为水杨酸促进了 PGK 的表达,Fahraji等(2014)研究则表明水杨酸显著刺激 PGK参与种子的萌发。本研究中PGK在水杨酸处理12h和24h时表达增强,反映了高温胁迫过程中,水杨酸促进细胞呼吸,减轻高温逆境胁迫对机体产生的伤害。
高温条件下小球藻生长受到胁迫,新陈代谢活性降低,比生长速率较小,而水杨酸添加后比生长速率升高,高温对生长的抑制作用得到缓解,这与小麦中的研究结果一致(Shakirova et al,2007)。高温下淀粉水解作用增强,可溶性糖含量升高,而淀粉的水解为呼吸作用提供能源,增加细胞渗透压,对细胞产生保护作用。有研究认为,高温处理下可溶性糖含量下降(Chaitanya et al,2001)。而本研究中高温胁迫 48h比 24h可溶性蛋白含量有所提高,高温下体内可溶性蛋白含量的提高可增加细胞渗透势等,维持机体正常代谢,提高细胞抗逆性,抵御不良环境胁迫。本研究中经水杨酸处理后可溶性糖和蛋白含量均呈现不同程度的提高,说明水杨酸通过调节渗透调节物质,改变质膜透性,从而提高机体对逆境胁迫的抗性,与 Czerpak等(2001)的研究结果相符。
综上所述,本文克隆了蛋白核小球藻 HSP70和PGK全长基因,并研究了水杨酸对高温胁迫下蛋白核小球藻中HSP70和PGK的表达、及藻的生长、生化指标的影响。结果表明适宜浓度的水杨酸对蛋白核小球藻高温胁迫具有一定的缓解作用,且在一定程度上增强了HSP70和PGK的表达,其中5—10 μg/mL时作用最显著,这为利用水杨酸缓解小球藻温度胁迫的研究提供了一定的资料。
李合生,2000.植物生理生化实验原理和技术.北京: 高等教育出版社,195—197
何亚丽,刘友良,陈 权等,2002.水杨酸和热锻炼诱导的高羊茅幼苗的耐热性与抗氧化的关系.植物生理与分子生物学学报,28(2): 89—95
欧阳峥嵘,温小斌,耿亚红等,2010.光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响.武汉植物学研究,28(1): 49 —55
周向红,李信书,王 萍等,2010.条斑紫菜HSP90基因的克隆与表达分析.水产学报,34(12): 1844—1852
蒋际谋,邓朝军,林永祥等,2014.枇杷果皮响应高温强光胁迫的蛋白质组分析.热带亚热带植物学报,22(4):383—390
Chaitanya K V,Sundar D,Reddy A R,2001.Mulberry leaf metabolism under high temperature stress.Biologia Plantarum,44(3): 379—384
Czerpak R,Bajguz A,Gromek M et al,2001.Activity of salicylic acid on the growth and biochemism of Chlorella vulgaris Beijerinck.Acta Physiologiae Plantarum,24(1): 45—52
Dahlhoff E P,2004.Biochemical indicators of stress and metabolism: applications for marine ecological studies.Annual Review of Physiology,66: 183—207
Ding M,Jiang Y,Cao Y et al,2014.Gene expression profile analysis of Ligon lintless-1 (Li1)mutant reveals important genes and pathways in cotton leaf and fiber development.Gene,535(2): 273—285
Elyse Ireland H,Harding S J,Bonwick G A et al,2004.Evaluation of heat shock protein 70 as a biomarker of environmental stress in Fucus serratus and Lemna minor.Biomarkers,9(2): 139—155
Fahraji S S,Kheradmand M A,Raoofi M M et al,2014.Effect of salicylic acid on germination,leaf area,shoot and root growth in crop plants.International Research Journal of Applied and Basic Sciences,8(9): 1454—1458
Fu W,Yao J,Wang X et al,2009.Molecular cloning and expression analysis of a cytosolic Hsp70 gene from Laminaria japonica (Laminariaceae,Phaeophyta).Marine Biotechnology,11(6): 738—747
Gammulla C G,Pascovici D,Atwell B J et al,2010.Differential metabolic response of cultured rice (Oryza sativa)cells exposed to high- and low-temperature stress.Proteomics,10(16): 3001—3019
Gu Y H,Zhang X,Lu N et al,2012.Cloning and transcription analysis of hsp70-1 and hsp70-2 of Gracilaria lemaneiformis under heat shock.Aquaculture,358—359:284—291
Henkel S K,Hofmann G E,2008.Thermal ecophysiology of gametophytes cultured from invasive Undaria pinnatifida(Harvey)Suringar in coastal California harbors.Journal of Experimental Marine Biology and Ecology,367(2): 164—173
Jayakannan M,Bose J,Babourina O et al,2015.The NPR1-dependent salicylic acid signalling pathway is pivotal for enhanced salt and oxidative stress tolerance in Arabidopsis.Journal of Experimental Botany,66(7):1865—1875
Koizumi S,Ohama N,Mizoi J et al,2014.Functional analysis of the Hikeshi-like protein and its interaction with HSP70 in Arabidopsis.Biochemical and Biophysical Research Communications,450(1): 396—400
Lei T,Feng H,Sun X et al,2010.The alternative pathway in cucumber seedlings under low temperature stress was enhanced by salicylic acid.Plant Growth Regulation,60:35—42
Li Z G,Xie L R,Li X J,2015.Hydrogen sulfide acts as a downstream signal molecule in salicylic acid-induced heat tolerance in maize (Zea mays L.)seedlings.Journal of Plant Physiology,177: 121—127
Liu Z,Zhang L,Pu Y et al,2014.Cloning and expression of a cytosolic HSP90 gene in Chlorella vulgaris.BioMed Research International,2014: 487050,http://dx.doi.org/10.1155/2014/487050
Pan Q,Zhan J,Liu H et al,2006.Salicylic acid synthesized by benzoic acid 2-hydroxylase participates in the development of thermotolerance in pea plants.Plant Science,171(2):226—233
Qu A L,Ding Y F,Jiang Q et al,2013.Molecular mechanisms of the plant heat stress response.Biochemical and Biophysical Research Communications,432(2): 203—207
Shingaki-Wells R N,Huang S,Taylor N L et al,2011.Differential molecular responses of rice and wheat coleoptiles to anoxia reveal novel metabolic adaptations in amino acid metabolism for tissue tolerance.Plant Physiology,156(4): 1706—1724
Snyman M,Cronjé M J,2008.Modulation of heat shock factors accompanies salicylic acid-mediated potentiation of HSP70 in tomato seedlings.Journal of Experimental Botany,59(8):2125—2132
Suzuki H,Takashima Y,Ishiguri F et al,2014.Proteomic analysis of responsive proteins induced in Japanese birch plantlet treated with salicylic acid.Proteomes,2(3):323—340
Tominaga H,Coury D A,Amano H et al,2010.Isolation and characterization of a cDNA encoding a heat shock protein 70 from a sterile mutant of Ulva pertusa (Ulvales,Chlorophyta).Ecotoxicology,19(3): 577—588
Timperio A M,Egidi M G,Zolla L,2008.Proteomics applied on plant abiotic stresses: role of heat shock proteins (HSP).Journal of Proteomics,71(4): 391—411
Wang Y T,Huang H Y,Tsai M A et al,2014.Phosphoglycerate kinase enhanced immunity of the whole cell of Streptococcus agalactiae in tilapia,Oreochromis niloticus.Fish &Shellfish Immunology,41(2): 250—259
Wang Y X,Sun Y,Tian Y C et al,2009.Cloning and expressing of putative enolase gene from cotton (Gossypium hirsutum L.).Cotton Science,21(4): 275—278
Zhang X,Li J,Liu A et al,2012.Expression profile in rice panicle: insights into heat response mechanism at reproductive stage.PLoS One,7(11): e49652
