香鱼(Plecoglossus altivelis)肿瘤坏死因子-α (TNF-α)基因的分子克隆、鉴定及免疫相关性表达*
2015-04-10杨智景李长红
杨智景 李长红 张 浩 苗 亮 陈 炯
(宁波大学海洋学院 生物化学与分子生物学实验室 宁波 315211)
肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)是机体在病原体入侵时,由激活的巨噬细胞、淋巴细胞以及其它免疫细胞产生的促炎细胞因子(Horiuchi et al,2010)。在哺乳动物中,TNF-α可以抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,并且参与机体的免疫调节,诱导相关的细胞因子及其受体基因的表达(Horiuchi et al,2010;Rajmani et al,2015);在抵抗细菌、病毒和寄生虫感染的过程中,TNF-α还起着重要介质的作用,与白介素-1 (interleukin-1,IL-1)和白介素-6 (interleukin-1,IL-6)等细胞因子被归为正急性期蛋白(Gruys et al,2005;Horiuchi et al,2010)。目前,已有应用TNF-α治疗肿瘤、牛皮癣、白塞病、风湿性关节炎、炎性肠病等的研究报道(Van Horssen et al,2006;Horiuchi et al,2010;Willrich et al,2015)。
目前,已经有数十种硬骨鱼类的 TNF-α基因得到了克隆,比如虹鳟(Oncorhynchus mykiss)(Laing et al,2001;Hong et al,2013)、鲤鱼(Cyprinus carpio)(Savan et al,2004)、大菱鲆(Psetta maxima)(Ordás et al,2007)、鳜鱼(Siniperca chuatsi)(Xiao et al,2007)和草鱼(Ctenopharyngodon idella)(Zhang et al,2012)等。在克隆TNF-α基因的同时,部分研究对其转录水平及免疫功能进行了测定。例如,在海弧菌(Vibrio pelagius)和病毒性出血败血症病毒(Viral haemorrhagic septicemia virus,VHSV)感染后,大菱鲆肝和肾组织中 TNF-α mRNA表达量明显增加,且不同个体表达量差异明显(Ordás et al,2007);在传染性脾肾坏死病毒(infectious spleen and kidney necrosis virus,ISKNV)感染后,鳜鱼血液和脾组织中 TNF-α mRNA表达量明显增加(Xiao et al,2007);经草鱼呼肠孤病毒(grass carp reovirus,GCRV)感染后,草鱼脾中 TNF-α mRNA表达量显著升高,而且 GCRV感染的草鱼肾细胞TNF-α mRNA表达量也增加显著(Wang et al,2013);在体外实验中,重组的虹鳟 TNF-α能促进虹鳟头肾来源巨噬细胞的趋化和吞噬活性(Zou et al,2003),并且重组的金鱼(Carassius auratus)TNF-α不仅能促进金鱼头肾来源的巨噬细胞的趋化和吞噬活性,还能促进其呼吸爆发功能等(Grayfer et al,2008)。上述研究结果表明,鱼类 TNF-α在细菌和病毒感染引起的炎症免疫防御反应发挥着重要作用。
香鱼(Plecoglossus altivelis),又名年鱼、仙胎鱼,隶属胡瓜鱼目、香鱼科,是一种一年生小型洄游性经济鱼类,为东亚地区中国、朝鲜和日本等国所特有。由于其体形优美、肉质鲜美,人工养殖规模逐年增加。然而,集约化、高密度养殖以及不当的病害防治技术导致香鱼病害频发,主要为细菌性病害,其中鳗弧菌是危害最严重的病原之一(李长红等,2009)。因此,香鱼以绿色健康养殖为要,应限制使用抗生素等药物,有必要从免疫学角度入手加强对香鱼免疫机制的研究,为香鱼病害防治及抗病品种选育提供指导。鉴于TNF-α在动物免疫反应中的作用,本实验拟对香鱼 TNF-α (PaTNF-α)进行初步研究。测定基因cDNA序列,明确其序列结构特征、系统进化关系及表达特征,解明鳗弧菌感染后香鱼免疫组织及细胞中PaTNF-α mRNA的表达变化以及鳗弧菌、脂多糖(lipopolysaccharide,LPS)和聚肌胞苷酸胞嘧啶核苷酸poly(I: C)分别处理后香鱼单核/巨噬细胞中 PaTNF-α mRNA的表达变化;原核表达 PaTNF-α重组蛋白并制备抗血清,分析鳗弧菌感染的香鱼血清及单核/巨噬细胞上清中 PaTNF-α的表达变化。研究结果将为进一步探讨 PaTNF-α在香鱼炎症免疫反应中的作用机制及机理提供基础。
1 材料与方法
1.1 实验材料与试剂
健康香鱼(20—30g)购自浙江省宁波市宁海县凫溪香鱼养殖基地,规格均一、健康无伤。运回实验室后暂养于充分曝气的自来水中,水温(20±1)°C。暂养期间连续充气,每天换水2次,早晚各一次。
ICR小鼠购自浙江医学科学院实验动物中心。大肠杆菌 BL21 pLys E菌株、TG1菌株、鳗弧菌ayu-H080701 (李长红等,2009)、pGEX-4T-3载体等由实验室保存。LPS (Escherichia coli 055: B5)和poly(I:C)购自 Sigma 公司(美国)。pMD19-T Simple Vector、RNAiso试剂、T4DNA连接酶、AMV逆转录酶、Ex Taq DNA聚合酶、BamH I、EcoR I,和SYBR Premix Ex Taq试剂盒等购自TaKaRa公司(日本)。压片暗盒、显影定影试剂盒、ECL化学发光试剂盒,和柯达X-OMAT BT胶片等购自碧云天生物技术研究所(北京)。SDS-PAGE低分子量标准蛋白试剂盒购自中国科学院上海生物化学研究所(上海),预染蛋白分子量蛋白标准购自 Fermentas公司(加拿大)。琼脂糖凝胶回收试剂盒购自 Omega公司(美国)。二抗(辣根酶标记山羊抗小鼠 IgG)购自北京中杉金桥生物技术有限公司(北京)。序列测序和引物合成工作由英维捷基贸易有限公司(上海)完成。
1.2 PaTNF-α cDNA序列获得及序列分析
采用Illumina HiSeq 2000测序平台对健康香鱼单核/巨噬细胞进行转录组测序,从中获得 PaTNF-α cDNA序列,并采用常规 PCR方法进行扩增和测序验证。采用 SignalP 4.1在线程序(http: //www.cbs.dtu.dk/services/SignalP/)预测信号肽序列;采用 TMHMM Server v.2.0 (http: //www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构域;采用 ClustalW 在线程序 (http: //clustalw.ddbj.nig.ac.jp/)进行多重序列比对;采用MEGA 6.0软件构建系统进化树(Tamura et al,2013)。多重序列比对及进化树构建所用序列详见表1。
1.3 香鱼头肾来源的单核/巨噬细胞分离培养
用 0.03% (V/V)的乙二醇苯醚麻醉香鱼,无菌条件下迅速取出头肾,剪刀剪碎头肾置 140目筛网中,加入适量RPMI1640培养基,无菌注射器活塞轻轻研磨,获得分散单细胞;采用 Ficoll密度梯度离心法分离细胞(2000 r/min,25 min),取含单核/巨噬细胞的白膜层细胞,用含 2%胎牛血清的 RPMI1640培养基洗涤2次,最后重悬于含 2%胎牛血清的RPMI1640培养基中。血球计数板计数,将细胞浓度调整为 107cells/mL,每皿铺2 mL细胞。将细胞置于24°C、5%CO2培养箱培养过夜,PBS洗去非贴壁细胞,贴壁细胞在含10%胎牛血清的RPMI1640培养基中培养。吉姆萨染色后显微镜观察,确定超过 95%的贴壁细胞是单核/巨噬细胞(Lu et al,2013)。
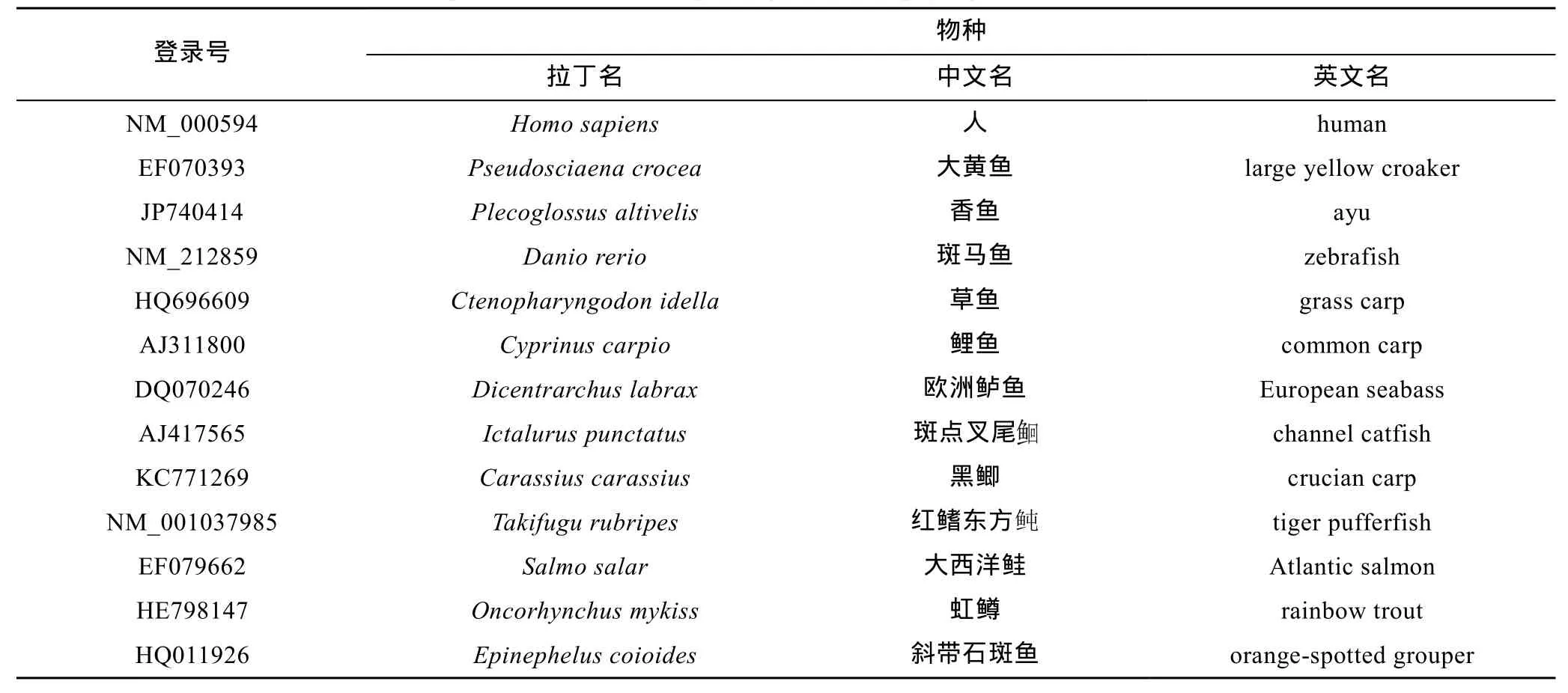
表1 多重比对及系统发育进化树构建采用序列Tab.1 Sequences used for multiple alignment and phylogenetic tree construction
1.4 香鱼外周血白细胞的分离
参考 Lam 等(2011)的方法分离香鱼外周血白细胞,具体步骤如下: 75%酒精消毒香鱼尾部,用肝素钠溶液润洗后的 1.0 mL注射器于香鱼尾静脉采血,加等量 PBS稀释。将稀释后的血液沿管壁加到 70%的Ficoll/磷酸缓冲液(PBS)液面上,500 g离心30 min,吸取中间白膜层细胞于15.0 mL离心管中,加入等量PBS,500 g离心20 min收集白细胞,重复2次,加适量PBS重悬,瑞士染色鉴定,确定超过95%的细胞是外周血白细胞。
1.5 鳗弧菌感染的香鱼组织样品制备
鳗弧菌感染香鱼的实验过程及感染剂量参考杨旦阳等(2013)的方法,具体步骤如下: 感染组香鱼用1.0×104CFU/尾的浓度腹腔注射鳗弧菌菌悬液,对照组香鱼注射相同体积的灭菌生理盐水,分别在感染后4、8、12和24 h (hours post infection)时采集脾、肝和头肾等组织并立即投入液氮中;从香鱼尾静脉抽取血液,4°C静置过夜后低速离心收集血清,随后转于–70°C超低温冰箱保存。
1.6 LPS、poly(I: C)和鳗弧菌感染的香鱼单核/巨噬细胞样品制备
将LPS和poly(I: C)分别以10 ng/mL和40 μg/mL的作用浓度加入香鱼单核/巨噬细胞中,于作用4、8、12和24 h时收集培养基上清,无菌滤膜过滤后分装;细胞用PBS洗涤3次,加入RNAiso试剂裂解细胞,5 min后收集裂解液作为香鱼单核/巨噬细胞样品,同上清样品置于–70°C保存。
过夜培养的鳗弧菌用 PBS稀释后,按照感染复数(multiplicity of infection,MOI)为10: 1的比例接种至香鱼单核/巨噬细胞中,于4、8、12和24 h时收集培养基上清和单核/巨噬细胞样品,收集和保存方法同上。
1.7 qRT-PCR检测
参考黄左安等(2011)的方法进行总RNA的抽提、第一链cDNA的合成及qRT-PCR检测。根据已获得的香鱼TNF-α cDNA序列设计检测引物,PaTNF-α test (+):5′-ACATGGGAGCT GTGTTCCTC-3′和 PaTNF-α test (–):5′-GCAAACACACCGAAAAAGGT-3′,预期扩增大小115 bp;根据香鱼管家基因 β-actin cDNA 序列(AB020884)设计内参检测引物 PaActin2 (+):5′-TCGTGCGTGACATCAAGGAG-3′和 PaActin2 (–):5′-CGCACTTCATGATGCTGTTG-3′,预期扩增片段长度为231 bp。qRT-PCR扩增体系25 μL,包括灭菌水 10 μL、SYBR Premix Ex Taq (2×)缓冲液 12.5 μL、cDNA 模板 0.5 μL、上下游引物各(10 μmol/L)1 μL。扩增反应在ABI StepOne荧光定量PCR仪(美国ABI公司)上进行,反应条件为: 94°C 180 s (预变性,1个循环);94°C 30 s,58°C 30 s,72°C 30 s (扩增段,共 40个循环);94°C 30 s,72°C 60 s,95°C 30 s (熔解段,1 个循环)。每个样品重复 3次。荧光定量的结果由仪器自带程序读取。根据 2–ΔΔCt相对标准曲线法计算PaTNF-α mRNA的相对表达量(Livak et al,2001)。
1.8 PaTNF-α的原核表达、抗血清制备
根据获得的PaTNF-α开放阅读框(ORF)设计原核表达引物,引物序列如下: pGEX-4T3-PaTNF-α (+):5′-CGGATCC ATGGATACTAATTGCAAAGTAC-3′和pGEX-4T3-PaTNF-α (–): 5′-GGAATTCTCACAGCAA ACACACC-3′,其中下划线碱基为的限制性内切酶BamH I和EcoR I识别序列,斜体字母为保护碱基。PCR 扩增体系 25 μL,包括 10×Ex Taq buffer 2.5 μL,dNTP (2.5 mmol/L)4.0 μL,cDNA模板0.5 μL,上下游引物(10 μmol/L)各 1 μL,Ex Taq DNA 聚合酶 0.25 μL,ddH2O 15.75 μL。扩增反应在Mastercycler pro梯度PCR 仪(德国 Eppendorf公司)上进行,反应程序为:94°C预变性 120 s;再 30个循环: 94°C变性 30 s,58°C退火30 s,72°C 延伸60 s;最后72°C延伸10 min。与预期相符的扩增片段经EcoR I和BamH I双酶切,插入到经相同内切酶酶切的原核表达载体 pGEX-4T-3中,获得重组质粒pGEX-4T-3-PaTNF-α。该重组质粒经测序验证无误后转化大肠杆菌BL21 pLys E菌株,经IPTG诱导表达,表达产物经SDS-PAGE检测,考马斯亮蓝G-250染色观察目的蛋白是否表达。
pGEX-4T-3-PaTNF-α/BL21经IPTG大量诱导后,经 5%—20%梯度胶分离,用预冷的 0.25 mol/L KCl溶液染色10 min,切下目的蛋白用于免疫ICR小鼠。每周免疫1次,共免疫3次。最后1次免疫后第3天从小鼠眼动脉取血,4°C静置过夜后冷冻离心收集血清,于–70°C 保存备用。
1.9 Western blot检测
将收集的香鱼血清和单核/巨噬细胞上清样品用Bradford法定量(Bradford,1976),参考黄左安等(2011)的方法进行Western blot检测。香鱼单核/巨噬细胞培养上清和重组蛋白样本经 SDS-PAGE电泳分离后湿转法转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,转膜结束后将 PVDF膜转移至封闭液(含 5%脱脂奶粉的 PBS-T)中于 4°C封闭过夜,按 1:500的比例加入PaTNF-α抗血清(一抗),37°C摇床孵育 2 h,PBS-T洗涤后按 1: 1000的比例加入 HRPIgG(二抗),37°C摇床孵育1 h,PBS-T洗涤采用ECL化学发光法显影,胶片扫描后采用Quantity One软件对电泳条带计算灰度值。
2 结果
2.1 PaTNF-α cDNA序列分析
PaTNF-α cDNA全长1932 bp (GenBank登录号:JP740414),包括一个完整 ORF,起始于第 347—350位的一个ATG起始密码子,终止于第1051—1054位的一个TGA终止密码子,预测编码一个由235个氨基酸组成、分子量大小约为26.4 kDa的前体蛋白,等电点为6.35。
软件分析结果表明,推测的 PaTNF-α不具有信号肽序列,具有 TNF家族典型的特征序列“IIIPDDG IYFVYSQ”,分子内包含一个保守的二硫键 Cys140-Cys181和位于72位Thr和73位Leu之间TNF-α转化酶 (TNF-α converting enzyme,TACE)酶切位点,并且在第 34—56位氨基酸处有一个单一的跨膜结构域“WTMWGALLAMALCVSAALFFTWN” (图1)。
2.2 PaTNF-α基因的系统进化分析
序列分析表明,PaTNF-α与其它鱼类TNF-α具有较高的氨基酸序列同源性(31.2%—53.4%),其中与虹鳟TNF-α同源性最高,为53.4%。根据哺乳动物和鱼类的 TNF-α氨基酸全长序列构建的系统进化树揭示,鱼类TNF-α单独形成一个大簇,香鱼与虹鳟、大西洋鲑的 TNF-α独立成簇,且与虹鳟 TNF-α的进化相关性最高(图2)。
2.3 鳗弧菌感染前后PaTNF-α mRNA表达的变化
取健康香鱼的肝、脾、体肾、头肾、脑、肠、肌、外周血白细胞和单核/巨噬细胞进行 qRT-PCR检测,结果表明,健康香鱼 TNF-α mRNA在头肾中表达量最高,其次是脾、体肾、肝、肌、单核/巨噬细胞和外周血白细胞(图3)。腹腔注射鳗弧菌后,感染组香鱼表现典型的弧菌病症状,并能从肝、脾和肾等组织中分离出病原菌(结果未显示),对照组香鱼无明显症状。与对照组相比,鳗弧菌感染4 h时,肝、脾和头肾中 PaTNF-α mRNA的表达量显著增加,分别为对照组的2.62、19.52和3.09倍(P<0.05);在8 h时,肝和头肾中PaTNF-α mRNA表达量继续增加,12 h时达到峰值,分别为对照组30.08和11.69倍(P<0.05),而在8 h后,脾中PaTNF-α mRNA与对照组无明显差异;外周白血细胞中PaTNF-α mRNA表达量在12 h时显著高于对照组,为对照组的2.20倍(P<0.05),在24 h时,与对照组无明显差异(图3)。
2.4 LPS、poly(I: C)和鳗弧菌处理前后香鱼单核/巨噬细胞PaTNF-α mRNA表达的变化
LPS、poly(I: C)和鳗弧菌处理香鱼单核/巨噬细胞后PaTNF-α mRNA的表达量显著增加,其中poly(I: C)和鳗弧菌处理组PaTNF-α mRNA的表达量在4 h时显著增加,分别为对照组的2.45和560.28倍,LPS处理组PaTNF-α mRNA与对照组无明显差异(P<0.05);在8 h时,LPS、poly(I: C)和鳗弧菌处理组PaTNF-α mRNA表达量分别为对照组的15.89、5.46和544.96倍(P<0.05);12 h时,LPS和鳗弧菌处理组PaTNF-α mRNA表达量仍然高于对照组,分别为对照组的4.99和365.03倍,而poly(I: C)处理组与对照组无明显差异(P<0.05);24 h时,LPS和poly(I: C)处理组PaTNF-α mRNA表达量均与对照组无明显差异,而鳗弧菌处理组 PaTNF-α mRNA表达量仍高于对照组,为对照组的24.95倍(图4)。
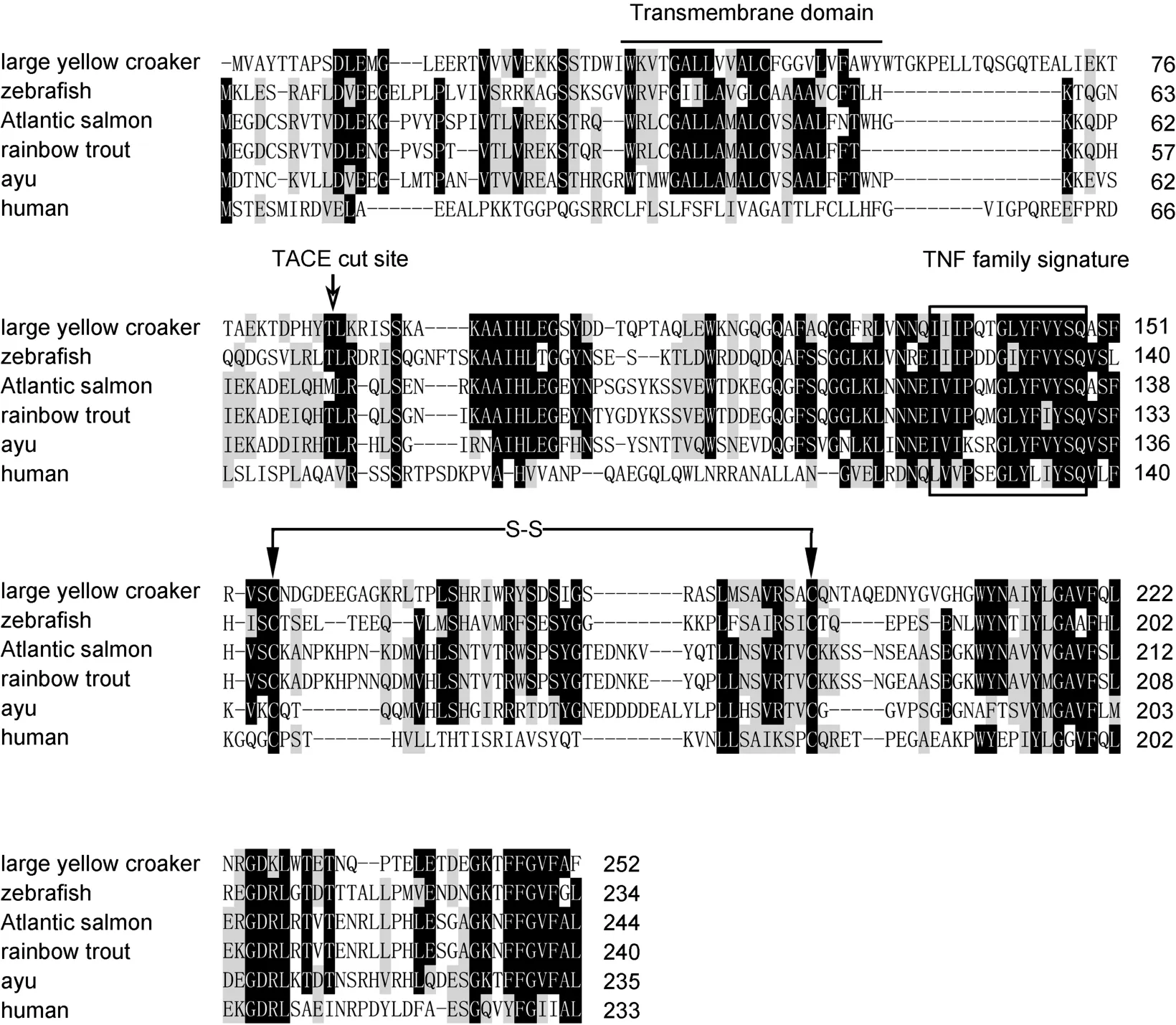
图1 香鱼与其它动物TNF-α氨基酸序列的多重比对Fig.1 Multiple alignment of TNF-α amino acid sequences of ayu and other animals
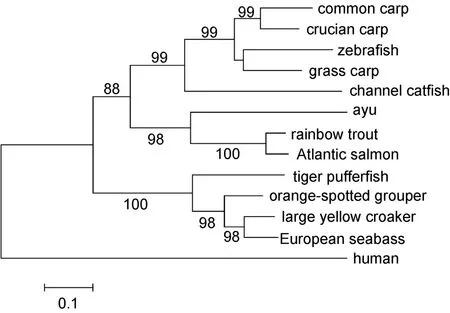
图2 基于NJ法构建的香鱼和其它物种TNF-α全长氨基酸序列的系统进化树Fig.2 Phylogenetic tree of the full-length amino acid sequences of ayu and other animals TNF-α using neighbor-joining method
2.5 PaTNF-α的原核表达和抗血清制备
重组质粒 pGEX-4T-3-PaTNF-α经测序验证无误后转至BL21 pLys E,加入IPTG诱导后高效表达,菌体总蛋白经 SDS-PAGE分离后出现一条高表达蛋白带,分子量为53.0 kDa左右,与预测的重组蛋白分子量(52.7 kDa)相符(图5a)。将目的条带切胶验证后,用于抗血清制备。
图3 qRT-PCR分析PaTNF-α mRNA的表达Fig.3 qRT-PCR analysis of PaTNF-α transcripts
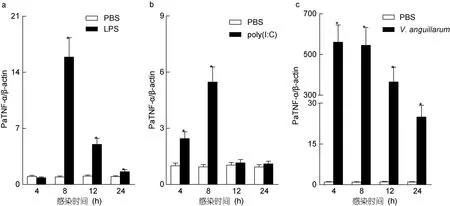
图4 qRT-PCR分析LPS、poly(I: C)和鳗弧菌处理前后香鱼单核/巨噬细胞PaTNF-α mRNA表达变化Fig.4 qRT-PCR analysis of PaTNF-α transcripts in ayu moncytes/macrophages upon LPS,poly(I: C)and V.anguillarum infection
以PaTNF-α抗血清进行Western blot,结果能观察到单一的反应条带,说明 PaTNF-α抗血清制备成功,且特异性较好(图6b),而香鱼血清中PaTNF-α成熟肽蛋白分子量约为 18 kDa,比重组蛋白大约小34.7 kDa,比前体蛋白大约小8.4 kDa (图5b)。
2.6 鳗弧菌感染前后香鱼血清和单核/巨噬细胞上清中PaTNF-α的表达变化
采用Western blot检测鳗弧菌感染前后香鱼血清和单核/巨噬细胞上清中PaTNF-α的表达。结果显示,鳗弧菌感染后,香鱼血清中 PaTNF-α的表达显著增加,4 h时鳗弧菌感染香鱼血清中PaTNF-α的表达量为对照组的5.20倍,8 h后含量达到峰值,为对照组的13.22倍,随感染时间延长,12和24 h血清中的含量略微下降,但仍为对照组的 12.55倍和 11.55倍(图6a)。香鱼单核/巨噬细胞感染鳗弧菌后,培养基上清中PaTNF-α的表达也显著增加,在12 h达到峰值,为对照组的2.92倍,在24 h时略有降低,但仍为对照组的 1.92倍(图6b)。
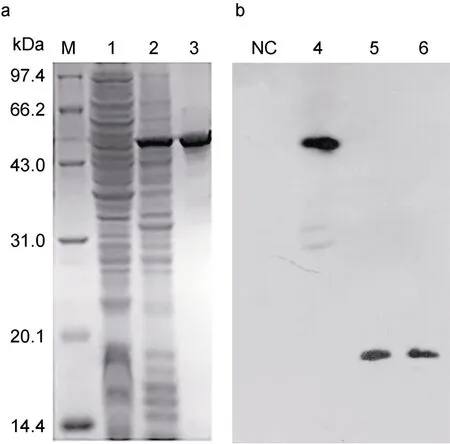
图5 PaTNF-α的原核表达和抗血清检测Fig.5 Prokaryotic expression of PaTNF-α and the detection of its antiserum
3 讨论
TNF-α是一种具有多效性的促炎性细胞因子,在哺乳动物以及某些鱼类中被广泛克隆和报道。本研究从香鱼单核/巨噬细胞转录组数据库中获得了PaTNF-α全长cDNA序列。序列分析结果揭示,PaTNF-α氨基酸序列与其它鱼类都拥有 TNF家族的特征序列"IIIPDDGIYFVYSQ",它与虹鳟的TNF-α氨基酸序列同源性最高,为 53.4%。系统进化树分析表明,鱼类TNF-α独立成簇,香鱼与虹鳟 TNF-α进化相关性最高。Western blot分析结果表明,香鱼血清和单核/巨噬细胞上清中 PaTNF-α的分子量均为 18 kDa左右,与预测的 PaTNF-α经 TACE加工裂解之后产生的成熟肽分子量大小一致。Lu et al研究表明,香鱼TACE能影响头肾来源单核/巨噬细胞中 PaTNF-α的表达(Lu et al,2015)。因此,可以推测鱼类TACE能影响TNF-α 的释放(Horiuchi et al,2010;Lu et al,2015)。
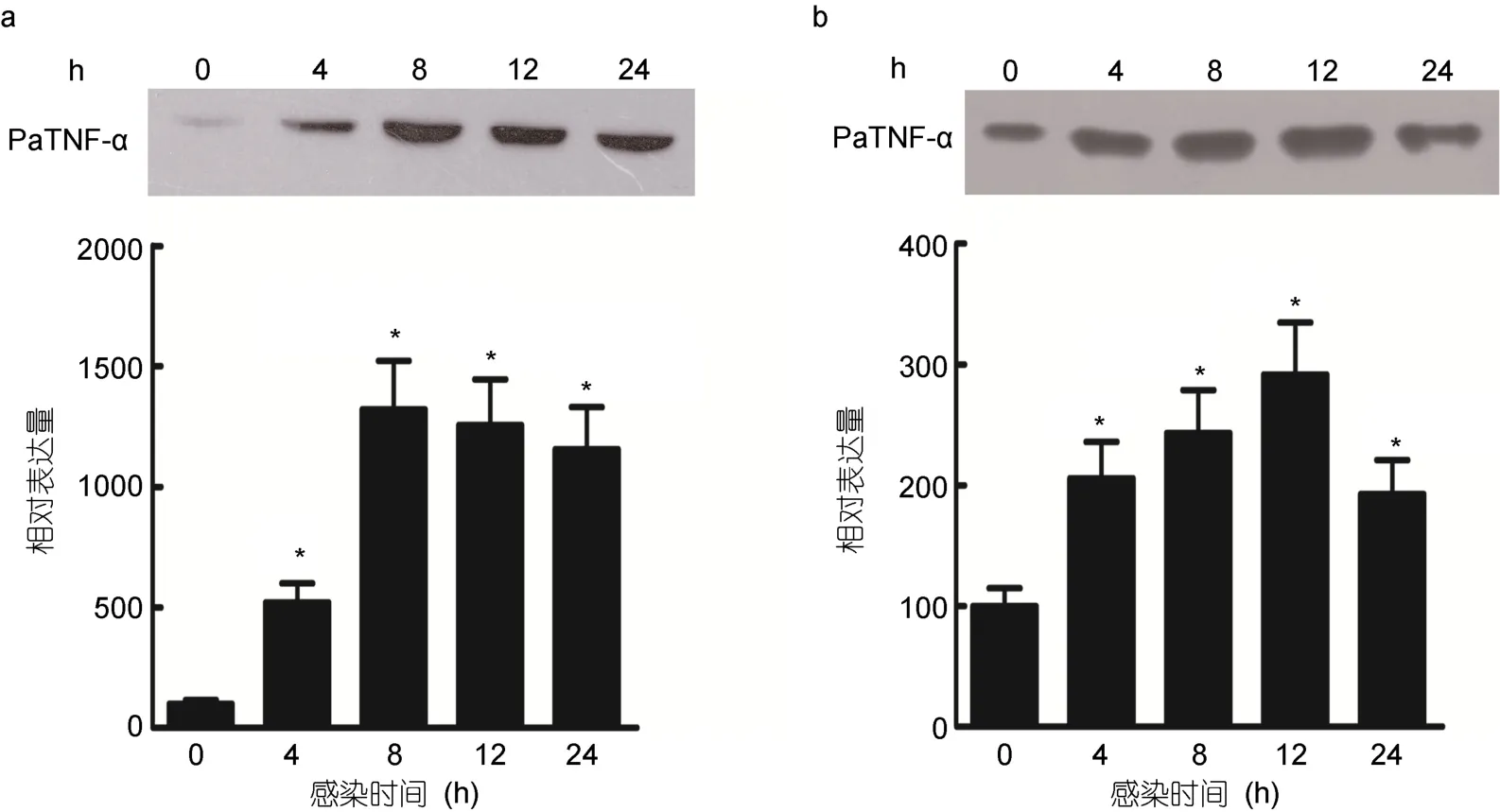
图6 Western blot检测鳗弧菌感染前后香鱼血清和单核/巨噬细胞上清中PaTNF-α的表达变化Fig.6 Western blot analysis of PaTNF-α in ayu serum and monocytes/macrophage supernatant after V.anguillarum infection
表达特征分析表明,PaTNF-α mRNA在健康香鱼被检组织与细胞中有不同程度的表达,且在头肾的表达量最高,与已报道的鲤鱼(Savan et al,2004)和条纹婢(Latris lineata)(Covello et al,2009)等鱼类研究结果较为一致。目前,已有较多文献揭示,鱼类TNF-α的表达与病原体感染密切相关,主要体现为,病原体感染后鱼类TNF-α的表达显著上调(Hirono et al,2000;Zhang et al,2012;Wang et al,2013)。例如,草鱼感染嗜水气单胞菌(Aeromonas hydrophila)后,肝TNF-α mRNA的表达在12 h和24 h时分别上调2.2倍和 2.1倍,48 h时达到最高(2.24倍),脾 TNF-α mRNA的表达在3 h时达到峰值,上调6.64倍,头肾TNF-α mRNA表达量在3 h时达到峰值,上调17.16倍,6 h时上调约11倍,随后降至对照组水平(Wang et al,2014);草鱼感染杀鲑气单胞菌(Aeromonas salmonicida)3 h 和 24 h时,脾 TNF-α mRNA 的表达量分别增加约100倍和4倍(Zanuzzo et al,2015)。本研究中,香鱼感染鳗弧菌后,肝、头肾和外周血白细胞中PaTNF-α mRNA表达变化趋势与上述研究结果相似,但达到峰值的时间点和峰值不同,肝、头肾和外周血白细胞PaTNF-α mRNA在感染12 h时达到最高,分别为对照组的 30.08、11.69和 2.20倍,而脾PaTNF-α mRNA表达量在4 h时即达到峰值,为对照组的 19.52倍。本研究还发现,鳗弧菌感染后,香鱼血清中PaTNF-α的表达逐渐增加,8 h时达到峰值,为对照组的13.22倍,12 h和24 h时略微下降,但仍显著高于对照组。
头肾是硬骨鱼类重要的造血组织和免疫器官,含有丰富的单核/巨噬细胞,已知单核/巨噬细胞是鱼类TNF-α的主要产生部位(Stafford et al,2001;Hong et al,2013)。因此,我们从香鱼头肾中分离了单核/巨噬细胞,分别研究了LPS、poly(I: C)和鳗弧菌刺激对其 PaTNF-α mRNA 表达的影响,结果表明,LPS、poly(I: C)和鳗弧菌都能诱导香鱼单核/巨噬细胞PaTNF-α mRNA 表达量显著增加,与已报道的虹鳟(Zou et al,2003;Hong et al,2013)、鲤鱼(Saeij et al,2003)和草鱼(Zhang et al,2012;Wang et al,2013)等鱼类较为一致。在草鱼中,poly(I: C)免疫刺激肾细胞8 h时,TNF-α mRNA表达量上调了61倍,而GCRV免疫刺激肾细胞24 h,TNF-α mRNA表达量上调了51倍(Wang et al,2013);在虹鳟中,LPS和poly(I: C)诱导头肾巨噬细胞 TNF-α mRNA表达的变化趋势相同,均在4 h时达到峰值,但LPS的诱导明显强于poly(I:C),LPS诱导4 h时头肾巨噬细胞TNF-α mRNA表达上调约1000倍,而此时poly(I: C)诱导TNF-α mRNA表达上调约80倍(Hong et al,2013)。上述研究中,各免疫刺激对鱼类TNF-α mRNA表达的诱导程度均高于本研究结果,可能由于LPS和poly(I: C)的处理浓度不同所致。同时,鳗弧菌对PaTNF-α mRNA表达的诱导程度高于 LPS和 poly(I: C)的诱导,且较早达到峰值。Zhang等(2012)研究还揭示,LPS诱导草鱼头肾白细胞培养基上清中TNF-α浓度显著增加,12 h时达到最高,与本研究中鳗弧菌诱导香鱼单核/巨噬细胞上清PaTNF-α的表达较为一致。上述研究结果揭示,头肾来源的单核/巨噬细胞是鱼类TNF-α的重要产生部位,在免疫刺激下短期内大量合成并释放TNF-α(Hirono et al,2000;Xie et al,2008;Zhang et al,2012)。
4 结论
本研究测定了香鱼TNF-α cDNA序列,序列分析揭示其与虹鳟 TNF-α序列最相似。健康香鱼中,PaTNF-α mRNA 在头肾中表达量最高;腹腔注射鳗弧菌后,香鱼肝、脾、头肾和外周白血细胞中PaTNF-α mRNA表达量显著上调;头肾来源的单核/巨噬细胞经鳗弧菌、LPS和 poly(I: C)体外处理后 PaTNF-α mRNA表达量增加;鳗弧菌感染后香鱼血清和单核/巨噬细胞上清中的 PaTNF-α表达量含量也显著增加,揭示香鱼 TNF-α表达与鳗弧菌感染紧密相关,可能参与病原体感染诱导的炎症免疫反应。研究结果为进一步研究鱼类 TNF-α的生物学功能及其在鱼类病原体感染的炎症反应中的作用机制提供基础资料。
李长红,陈 炯,史雨红等,2009.宁海地区香鱼弧菌病病原菌鉴定.微生物学报,49(7): 931—937
杨旦阳,陈 炯,陆新江等,2013.香鱼 CCL4-like基因的克隆、序列分析及免疫相关性表达变化分析.中国细胞生物学学报,35(5): 676—683
黄左安,陈 炯,陆新江等,2011.香鱼凝血因子 X基因表达与鳗利斯顿氏菌感染的相关性.动物学研究,32(5):492—498
Bradford M M,1976.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,72(1—2):248—254
Covello J M,Bird S,Morrison R N et al,2009.Cloning and expression analysis of three striped trumpeter (Latris lineata)pro-inflammatory cytokines,TNF-α,IL-1β and IL-8,in response to infection by the ectoparasitic,Chondracanthus goldsmidi.Fish Shellfish Immunol,26(5): 773—786
Grayfer L,Walsh J G,Belosevic M,2008.Characterization and functional analysis of goldfish (Carassius auratus L.)tumor necrosis factor-alpha.Dev Comp Immunol,32(5): 532—543
Gruys E,Toussaint M J M,Niewold T A et al,2005.Acute phase reaction and acute phase proteins.J Zhejiang Univ Sci,6B(11): 1045—1056
Hirono I,Nam B -H,Kurobe T et al,2000.Molecular cloning,characterization,and expression of TNF cDNA and gene from Japanese flounder Paralychthys olivaceus.J Immunol,165(8): 4423—4427
Hong S,Li R G,Xu Q Q et al,2013.Two types of TNF-α exist in teleost fish: phylogeny,expression,and bioactivity analysis of type-II TNF-α3 in rainbow trout Oncorhynchus mykiss.J Immunol,191(12): 5959—5972
Horiuchi T,Mitoma H,Harashima S et al,2010.Transmembrane TNF-α: structure,function and interaction with anti-TNF agents.Rheumatology,49(7): 1215—1228
Laing K J,Wang T H,Zou J et al,2001.Cloning and expression analysis of rainbow trout Oncorhynchus mykiss tumour necrosis factor-α.Eur J Biochem,268(5): 1315—1322
Lam F W-S,Wu S-Y,Lin S-J et al,2011.The expression of two novel orange-spotted grouper (Epinephelus coioides)TNF genes in peripheral blood leukocytes,various organs,and fish larvae.Fish Shellfish Immunol,30(2): 618—629
Livak K J,Schmittgen T D,2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod.Methods,25(4): 402—408
Lu X J,Chen J,He Y Q et al,2013.Molecular characterization of an IL-1β gene from ayu,Plecoglossus altivelis.Fish Shellfish Immunol,34(5): 1253—1259
Lu X J,Chen Q,Yang G J et al,2015.The TNFα converting enzyme (TACE)from ayu (Plecoglossus altivelis)exhibits TNFα shedding activity.Mol Immunol,63(2): 497—504
Ordás M C,Costa M M,Roca F J et al,2007.Turbot TNFα gene:molecular characterization and biological activity of the recombinant protein.Mol Immunol,44(4): 389—400
Rajmani R S,Singh P K,Kumar G R et al,2015.In-vitro characterization and evaluation of apoptotic potential of bicistronic plasmid encoding HN gene of Newcastle disease virus and human TNF-α.Anim Biotechnol,26(2): 112—119
Saeij J P J,Stet R J M,de Vries B J et al,2003.Molecular and functional characterization of carp TNF: a link between TNF polymorphism and trypanotolerance?.Dev Comp Immunol,27(1): 29—41
Savan R,Sakai M,2004.Presence of multiple isoforms of TNF alpha in carp (Cyprinus carpio L.): genomic and expression analysis.Fish Shellfish Immunol,17(1): 87—94
Stafford J L,McLauchlan P E,Secombes C J et al,2001.Generation of primary monocyte-like cultures from rainbow trout head kidney leukocytes.Dev Comp Immunol,25(5—6):447—459
Tamura K,Stecher G,Peterson D et al,2013.MEGA6: Molecular evolutionary genetics analysis version 6.0.Mol Biol Evol,30(12): 2725—2729
Van Horssen R,ten Hagen T L M,Eggermont A M M,2006.TNF-α in cancer treatment: molecular insights,antitumor effects,and clinical utility.Oncologist,11(4): 397—408
Wang H,Shen X B,Xu D et al,2013.Lipopolysaccharideinduced TNF-α factor in grass carp (Ctenopharyngodon idella): evidence for its involvement in antiviral innate immunity.Fish Shellfish Immunol,34(2): 538—545
Wang L,Liu L C,Zhou Y et al,2014.Molecular cloning and expression analysis of mannose receptor C type 1 in grass carp (Ctenopharyngodon idella).Dev Comp Immunol,43(1):54—58
Willrich M A V,Murray D L,Snyder M R,2015.Tumor necrosis factor inhibitors: clinical utility in autoimmune diseases.Transl Res,165(2): 270—282
Xiao J,Zhou Z C,Chen C et al,2007.Tumor necrosis factor-alpha gene from mandarin fish,Siniperca chuatsi:Molecular cloning,cytotoxicity analysis and expression profile.Mol Immunol,44(14): 3615—3622
Xie F J,Zhang Z P,Lin P et al,2008.Cloning and infection response of tumour-necrosis factor alpha in large yellow croaker Pseudosciaena crocea (Richardson).J Fish Biol,73(5): 1149—1160
Zanuzzo F S,Urbinatia E C,Rise M L et al,2015.Aeromonas salmonicida induced immune gene expression in Aloe vera fed steelhead trout,Oncorhynchus mykiss (Walbaum).Aquaculture,435: 1—9
Zhang A Y,Chen D Y,Wei H et al,2012.Functional characterization of TNF-α in grass carp head kidney leukocytes: induction and involvement in the regulation of NF-κB signaling.Fish Shellfish Immunol,33(5): 1123—1132
Zou J,Peddie S,Scapigliati G et al,2003.Functional characterisation of the recombinant tumor necrosis factors in rainbow trout,Oncorhynchus mykiss.Dev Comp Immunol,27(9): 813—822
