可口革囊星虫(Phascolosoma esculenta)重组铁蛋白富集Pb2+等重金属特性和功能研究*
2015-04-10初双双张云云陈丽萍君张迪骏司开学苏秀榕
初双双 张云云 苏 倡 王 颖 陈丽萍 周 君张迪骏 司开学 苏秀榕①
(1.宁波大学海洋学院 宁波 315211;2.宁波城市学院 宁波 315800)
可口革囊星虫(Phascolosoma esculenta)属于星虫动物门(Sipuncula)、革囊星虫纲(Phascolosomatidea)、革囊星虫目(Phascolosomatiformes)、革囊星虫科(Phascolosomatidae)、革囊星虫属(Phascolosoma),俗称海丁、沙虫、海蚂蝗、土笋、泥丁等,为我国的特有物种,主要分布在浙江、福建沿海滩涂,在广东、广西、海南、台湾等地也均有分布(周化斌等,2006)。一般营底栖生活,以底栖的硅藻、有机碎屑为食。研究表明可口革囊星虫具有丰富的营养价值(苏秀榕等,2008),同时它在重金属离子污染区的良好生长特性也引起了广泛的关注(李懿等,2008)。
铁结合蛋白(ferritin)简称铁蛋白,最早是于 1937年从脊椎动物马的脾脏中纯化分离出来的。是一类广泛存在于动物、植物和微生物中,由 24个亚基组成的 450 kDa巨大复合体(杜莉莉等,2008;贺静静等,2009)。外形结构呈笼子状球形,由蛋白壳和铁核两部分组成(Crichton et al,2010)。具有耐稀酸(pH=2.1)、耐稀碱(pH=12.1)和较高温度70—75°C不变性等特点(王群力等,2004)。
1995年,Watt实验室就曾报道天然铁蛋白能储存若干种有毒的金属离子如Zn2+、Pb2+、Ni2+等(Pead et al,1995)。林庆梅等(1999)研究的经改造及修饰后的铁蛋白反应器能储存各种重金属离子,并能用于直接监测流动水体的污染程度。黄河清等人将改造后的铁蛋白用于捕获环境中的有机磷农药,于 1999年研究了模拟海水流动系统,研究马脾铁蛋白反应器储存有毒金属离子的能力及规律,然后构建了硒-铁蛋白电化学反应器,发现改造后的硒-铁蛋白不仅引起蛋白的构象变化,而且适当地拓宽了隧道宽度,加速了对有机磷农药的储存(黄河清等,2001);肖志群等(2008)构建鲨鱼肝铁蛋白反应器,推断有机磷分子的储存位点位于表层,储存能力受控于含高磷/铁的铁核表层结构和储存有机磷的场所,并与介质中有机磷分子浓度有关。Cho等(2009)通过培养蛋白晶体的方法解析了幽门螺杆菌重组铁蛋白吸附不同浓度Fe3+的蛋白结构变化,为解析蛋白吸附 Fe3+的过程提供了参考。Ebrahimi等(2013)研究发现磷酸可以促进Fe3+进入铁核内,而当铁核内充满 Fe3+时会加速 Fe2+的氧化速率。李成华等人的研究表明原核表达的浙江枝吻纽虫的重组铁结合蛋白具有富集二价重金属离子Cd2+、Pb2+和Fe2+的能力,并有望成为捕获环境中重金属离子的材料(Li et al,2012)。
本研究以可口革囊星虫重组铁结合蛋白为研究对象,使其最大限度地富集Pb2+、Fe3+、Cd2+、Cr3+、Cu2+、Mn2+、Sn2+和Zn2+8种重金属离子后,利用透射显微镜,对铁蛋白富集Pb2+和其它7种重金属离子后超微结构进行研究,并比较了重组蛋白和天然蛋白的区别;通过傅里叶变换红外光谱研究了重组铁蛋白和标准铁蛋白富集Pb2+和其它7种重金属离子后的基团变化差异。由于Pb2+相对其它几种金属具有更大的离子半径和较高的电负性,更易与蛋白、核酸和脂类结合,造成生物大分子受损而影响细胞功能,进而造成机体损伤(刘洪娟等,2014)。铁蛋白可以富集Pb2+保护细胞不受其毒害,本研究通过细胞实验比较了重组铁蛋白和标准铁蛋白富集重金属离子和保护细胞的能力。
1 材料与方法
1.1 材料
重组铁结合蛋白(rferritin)由原核表达获得,马脾铁蛋白(hferritin)购于Sigma公司。小鼠成骨前体细胞株 MC3T3购于北京北纳创联生物技术研究院;DMEM 培养基和胎牛血清(Hyclone,美国 Thermo Fisher公司);100U/mL青霉素和100μg/mL链霉素(碧云天生物技术研究所);0.25% (W/T)Trypsin-1mmol/L EDTA·4Na(美国Invitrogen,Gbico公司);二甲基亚砜(美国 Amresco公司);甲基噻唑蓝(MTT,美国Amresco 公司)。
硝酸铅[Pb(NO3)2]、氯化铁(FeCl3)、氯化镉(CdCl2)、氯化铬(CrCl3)、氯化铜(CuCl2)、氯化锰(MnCl2)、氯化亚锡(SnCl2)、氯化锌(ZnCl2)等均为分析纯,购于国药集团上海化学试剂有限公司;BCA总蛋白浓度测定试剂盒购于南京建成有限公司。
1.2 方法
1.2.1 铁结合蛋白富集重金属离子 将复性后的重组铁结合蛋白和稀释相同浓度的天然铁蛋白分别浸在 0.25mmol/L 的 Pb(NO3)2、FeCl3、CdCl2、CrCl3、CuCl2、MnCl2、SnCl2和 ZnCl2的重金属离子溶液中12h,然后在 PBS中透析 12h,在这期间更换 3—4次缓冲液,以除去未被吸附的重金属离子,4°C保存备用。
1.2.2 超微结构的观察 将各蛋白液调至浓度为0.2mg/mL左右,用1mL 2.5%戊二醛固定,然后将少量样品滴加到专用铜网的碳膜上,醋酸双氧铀进行负染色富集,并进行透射电镜(transmission electron microscope,TEM H-7650日本日立公司)观察,操作电压80kV。利用软件Image-Pro Plus计算各个蛋白单体的大小。
1.2.3 红外光谱分析 取约 1mg的真空冷冻干燥样品和100mg的KBr混合研磨压片制样,用FTIR光谱仪(TENSOR-27,德国Bruker公司)透射光谱法测定并记录红外光谱。波数扫描范围 400—4000cm-1,光谱采样间隔 4cm-1,实验采用空气为参比在室温下进行光谱采集,采用仪器自带的操作软件进行谱图富集及数据分析。
1.2.4 预防细胞铅中毒的特性研究
(1)细胞的培养
将小鼠成骨细胞株MC3T3在含10%的胎牛血清的 DMEM 培养基(100U/mL青霉素,100μg/mL链霉素)、5% CO2、37°C 恒温培养。
(2)重金属离子Pb2+半数抑制浓度的测定
选取对骨细胞的生长发育最具有毒害作用的重金属离子 Pb2+为研究对象。细胞消化离心后添加于96孔板,调成终浓度为5×104细胞/孔,Pb2+的终浓度设为 200、400、600、800、1000μmol/L。每孔体积共 200μL,置于 37°C,5% CO2条件下培养 12h 后,加入 MTT 50μL 37°C继续孵育4h,弃上清,加入 150μL二甲基亚砜(DMSO)溶解结晶,用酶标仪(MK3,美国Thermo Fisher公司)在495nm检测吸光值(A值),计算并制作细胞的增殖抑制率曲线[增殖抑制率 = (1–实验组吸光值/对照组吸光值)× 100%],计算 Pb2+对MC3T3的半数抑制浓度(IC50)并选取Pb2+最适浓度。
(3)铁蛋白对细胞的保护作用的观察及分析
采用 MTT法测定重金属离子对正常的 MC3T3细胞的影响,然后加入蛋白检测细胞的存活率是否发生变化。hferritin和rferritin分别用DMEM培养基稀释至终浓度分别为0.1mg/mL,0.22μm无菌微孔过滤除菌,4°C保存备用。方法同上,实验分为3组,分别为正常对照组(不含重金属离子和铁蛋白);重金属离子损伤组(50μL重金属离子和50μL DMEM培养基);实验组(50μL Pb2+溶液和 50μL 铁蛋白)。Pb2+的浓度为上述实验结果计算出来的最适浓度,400μmol/L,rferritin和hferritin的终浓度均为0.1mg/mL。37°C,5%CO2条件下培养 12h后,利用荧光倒置显微镜(TE2000-U,日本 Nikon公司)检测细胞形态学变化,并利用MTT法检测铁蛋白对细胞的保护作用。
2 结果与分析
2.1 超微结构的变化
利用透射电镜对蛋白单体的超微结构进行观察发现,在无重金属离子富集的条件下,可以看到很多复性成功的重组铁结合蛋白的单体蛋白环和无规则蛋白聚集体,蛋白环的内径在 8nm 左右,而外径在12nm左右;与文献中天然铁蛋白的直径大小吻合(Harrison et al,1996),说明无规则的铁蛋白聚集体被复性成功。Pb2+和Sn2+富集组的蛋白单体形状较为规则,大小较均一,直径分别在 40nm 和 28nm 左右;Fe3+富集组的重组蛋白单体呈规则的球体,其尺寸大小明显分为两种,直径分别在19nm和22nm左右,可能是由于金属离子Fe3+被还原成Fe2+,蛋白富集直径差别不大的两种阳离子形成的;Mn2+富集组的蛋白聚集体的差别很大,直径在 30—120nm,大小不等,可能是由于金属锰有Mn2+、Mn6+和Mn7+等几种形式,蛋白富集不同化合价的金属离子而呈现出不同直径的单体。由于重金属离子的半径 Pb2+> Sn2+> Mn2+> Fe3+,因此rferritin富集重金属离子后也呈现类似的大小顺序,只是因金属锰的化合价较多,Mn2+富集组蛋白差异较大(图1)。与 Ensign等(2004)研究的结果吻合,Ensign认为含有铜核的铁蛋白的直径比空载的铁结合蛋白的直径要大。
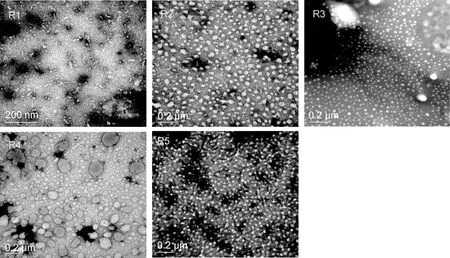
图1 重组铁蛋白富集金属后的超微结构Fig.1 Ultrastructural of rferritin after accumulation metal
2.2 红外光谱分析
酰胺键的特征峰有 NH伸缩振动,CO伸缩振动和NH弯曲振动,蛋白分子中有酰胺单元结构,因此除了它们的特征峰外,也有酰胺特征峰。由图2可知,各富集组蛋白共有的基团有酰胺 A带(3500—3300cm-1)的 N-H 的伸缩振动、酰胺Ⅰ带(1700—1600cm-1)的 C=O伸缩振动及酰胺Ⅲ带(1330—1220cm-1)的NH弯曲振动和CN伸缩振动,这些基团都是蛋白共有的酰胺特征峰(李冰宁等,2011);除此之外共有基团还有 3400—3500cm-1之间的 OH-峰、1450cm-1附近的 CH2和 NH4+特征峰及 1050cm-1附近的P-O-C和NO3-特征峰(谢晶曦等,2001),这些基团可能是铁结合蛋白的特征基团。而星虫重组铁蛋白富集重金属离子后,蛋白出现了-CH3、-CH2-、-CH-、S=O、-P=O-C-、C-S-C等差异基团。各富集组的差异基团如图2和表1所示,各个富集组的差异基团均不相似,说明富集不同重金属离子的基团的种类存在差异,比如富集Fe3+后NH弯曲振动,CN伸缩振动,SO伸缩振动,NH面外弯曲,C=O、C-S-C,S-S的特征峰均消失;而Pb2+富集组-CH3、-CH2、-CH伸缩振动和SO伸缩振动,NH弯曲振动,CN伸缩振动未消失等等,正是这些富集不同重金属离子的基团的差异性构成了蛋白富集重金属离子的特异性。
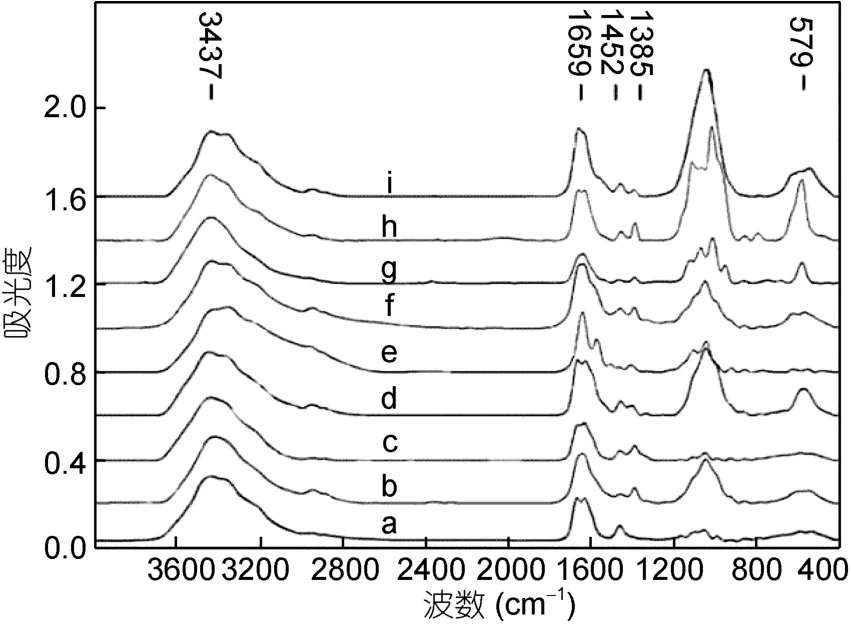
图2 重组铁蛋白富集金属后的红外光谱图Fig.2 FTIR spectra of rferritin after accumulation metal
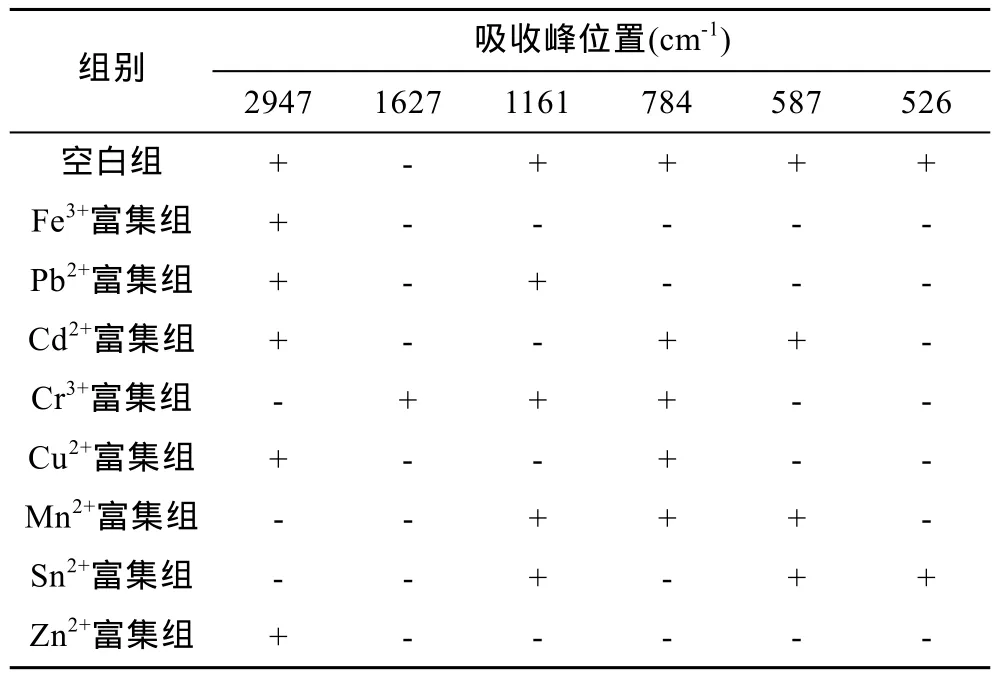
表1 铁蛋白富集重金属后红外光谱的变化Tab.1 The difference of FTIR band assignments of ferritin
标准铁蛋白富集Pb2+和其它7种重金属离子后其红外谱图非常相似,只是个别的出峰强度略有差异,说明天然铁蛋白富集不同重金属离子后基团比较相似,只是富集重金属离子的强度存在差异。这有可能与天然铁蛋白的稳定性有关,蛋白内部由于具有铁核的稳定作用,其功能基团由于内部铁核的螯合作用而不易外漏以富集其它的重金属离子,因此富集不同重金属离子的基团只是外部的一些非特异性的基团。如图3所示,这些共同的非特异性基团主要包括酰胺A带的N-H的伸缩振动、酰胺Ⅰ带的C=O伸缩振动及酰胺Ⅲ带的NH弯曲振动和CN伸缩振动等酰胺特征峰和 3400—3500cm-1之间的 OH-峰、1450cm-1附近的 CH2和 NH4+特征峰及 1050cm-1附近的P-O-C和NO3-特征峰,580cm-1附近的C=O特征峰,这些非特异性基团与重组铁蛋白较相似。标准铁蛋白组的特征峰数量少于重组铁蛋白组,且其特征峰的种类均包含于重组铁蛋白组中,这进一步验证了作者的结论: 标准铁蛋白富集重金属离子的基团只是外部的一些非特异性基团,其内部的基团由于铁核的螯合而没有发生作用。
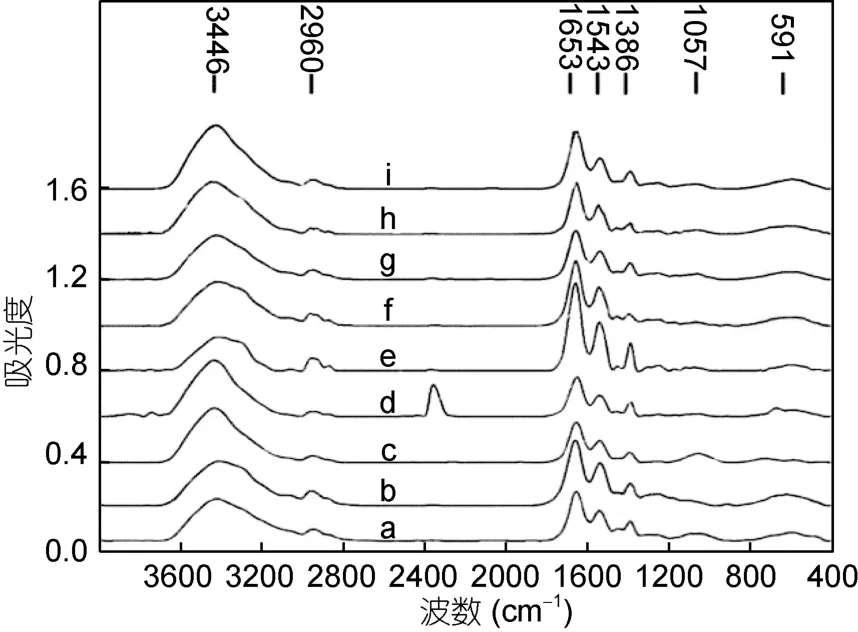
图3 标准铁蛋白富集金属后的红外光谱图Fig.3 FTIR spectra of hferritin after accumulation metal
2.3 对细胞的保护作用
2.3.1 重金属离子Pb2+IC50的计算 将MTT法测出来的数值,用SPSS软件计算细胞对重金属离子的IC50(周一平,2003;赵斌等,2007)。结果显示,Pb2+抑制骨细胞的增长,半数抑制率IC50为1000μmol/L,选取抑制率为40%的浓度800μmol/L。
2.3.2 细胞形态学的观察 各处理组的细胞培养12h后可发现,正常MRC3T3-E1贴壁生长、聚集,细胞形态较规则,生长较密集,伸展成长条形(图4,NTC);Pb处理组的细胞明显比较稀疏,出现漂浮的细胞,贴壁能力减弱,而且出现许多细胞碎片(图4,Pb);而加星虫重组铁蛋白和标准铁蛋白处理组的细胞大而饱满,漂浮的细胞和细胞碎片明显减少,生长活力也有所增高,两处理组之间无明显差异(图4,RF,HF)。
2.4 铁蛋白对细胞的保护作用
MTT法结果如图5所示,与对照组相比,重金属离子 Pb2+可明显减缓 MRC3T3-E1细胞的生长速度,抑制其增殖过程,降低细胞生长率(P<0.05)。当铁蛋白加入后,两组细胞的存活率存在显著差异,说明铁蛋白可以保护细胞免受重金属离子的侵害,使细胞的生长率明显提高。RF处理组细胞的生长状况要优于HF组,可能与星虫重组铁蛋白富集重金属离子的能力强于标准铁蛋白有关,但是两组细胞生长状况差异不明显(P>0.05)。

图4 各实验组的细胞形态Fig.4 Cell morphology of experimental groups
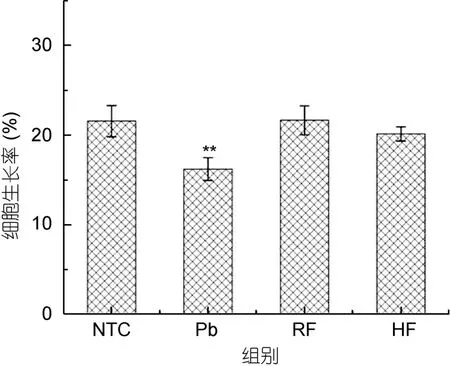
图5 各实验组细胞生长率Fig.5 The cell viability of experimental groups
3 讨论
铁蛋白是生物体内一种重要的铁结合蛋白,具有调节铁代谢平衡、抗氧化胁迫、消除部分重金属和有毒分子等的功能(陈静等,2010)。进一步的研究表明,铁蛋白可以捕获较多数量的非铁重金属离子,因此其可能参与了体内重金属离子解毒(Zhu et al,2011)。本研究利用体外表达的可口革囊星虫重组铁蛋白,富集了Pb2+和其它几种重金属离子。当铁蛋白富集重金属离子后,铁蛋白的超微结构发生了明显变化,富集重金属离子的蛋白直径均大于空白组,而且蛋白直径的大小与所富集重金属离子的种类直接相关,富集Pb2+组蛋白直径明显大于其它金属离子组,而且大小分布均匀。这可能与Pb2+本身具有较大的离子半径和很高的电负性相关(刘洪娟等,2014)。
铁蛋白的通道及空腔内部有着许多带负电的酸性氨基酸残基(Glu和 Asp),在正常生理 pH条件下,这些残基都可以结合Pb2+。据报道,铁蛋白空腔表面高浓度的羧基基团更有助于金属离子在铁蛋白内部成核(Zhao et al,2003)。除此之外,Asp也可以与金属离子通过静电作用的方式结合。铁蛋白通道中负电氨基酸残基可构成电势梯度,金属离子可顺着电势到达铁蛋白内部空腔(赵广华等,2012)。在本研究中星虫重组铁蛋白富集 Pb2+和其它几种重金属离子的能力存在差异,各富集组也出现了特异性的基团,富集 Pb2+组相比于其它金属富集组出现了-CH3、-CH2-、-CH-和-SO-、-NH-、-CN等基团。说明重组铁蛋白在富集Pb2+过程中这些基团与 Pb2+发生反应,将其储存到铁蛋白的核内,从而实现了铁蛋白富集Pb2+的功能。
星虫重组铁蛋白是体外重组蛋白,内部无铁核的支撑,因此富集Pb2+和其它几种重金属离子的基团均暴露在外侧。而标准铁蛋白富集Pb2+和其它几种不同重金属离子后其红外谱图非常相似,只是个别峰的出峰强度略有差异。这可能与天然铁蛋白的稳定性有关,蛋白内部由于具有铁核的稳定作用,其功能基团由于内部铁核的螯合而不易外漏以富集其它的重金属离子,因此富集不同重金属离子的基团只是外部特定的一些非特异性基团,从而造成了星虫重组铁蛋白富集重金属离子的能力明显优于标准铁蛋白的现象。
Pb2+对人体无任何生理作用,并且进入人体后造成的损伤不可修复。Pb2+对细胞的毒性很强,可以引起遗传物质损伤和诱导细胞凋亡。目前,临床上治疗铅中毒大多采用巯基络合物。络合物进入人体后可以结合重金属,但同时会产生副作用,干扰体内其它矿物质的代谢(于立博等,2013)。本研究中的铁结合蛋白与Pb2+的竞争性结合而非络合物的形式,保护细胞不受其毒害,通过细胞学实验作者发现Pb2+使细胞破碎死亡,而加入铁蛋白的处理组细胞形态与空白组没有明显区别,细胞的死亡率明显下降(P<0.05),细胞学实验进一步验证了星虫重组铁蛋白具有富集Pb2+和保护细胞免受Pb2+毒害的功能。
于立博,刘继文,2013.鹰嘴豆-金属硫蛋白拮抗小鼠骨髓干细
胞铅毒性的机制.中国老年学杂志,33(023): 5930—5931王群力,孔 波,黄河清,2004.铁蛋白纳米蛋白壳结构与功
能研究新进展.化学进展,16(4): 516—519
刘洪娟,吕 翠,刘晓丽等,2014.铅毒性拮抗剂的研究进展.环境与职业医学,11: 882—886
苏秀榕,纪其雄,丁理发等,2008.可口革囊星虫体液细胞的显微和亚显微结构.动物学报,54(1): 157—163
杜莉莉,李太武,苏秀榕等,2008.可口革囊星虫(Phascolosoma esculenta)铁结合蛋白基因的研究.海洋与湖沼,39(3): 252—256
李 懿,李太武,苏秀榕,2008.Cd2+、Hg2+、As3+对可口革囊星虫的急性毒性试验.水产科学,26(2): 71—74
李冰宁,武彦文,欧阳杰等,2011.应用红外光谱技术研究中
药水蛭的炮制过程.光谱学与光谱分析,31(4): 979—982肖志群,翁朝红,黄河清,2008.鲨鱼肝铁蛋白理化特性及其
储存有机磷农药分子的初步研究.集美大学学报: 自然科学版,13(3): 193—198
陈 静,赵永亮,王 丹,2010.铁蛋白研究现状.河南师范大学学报: 自然科学版,38(1): 152—155
林庆梅,乔玉欢,黄河清,1999.铁蛋白反应器储存有毒金属离子的初步研究.厦门大学学报: 自然科学版,38(6):871—876
周一平,2003.用SPSS软件计算新药的LD50.药学进展,27(5):314—316
周化斌,张永普,吴洪喜等,2006.可口革囊星虫的营养成分分析与评价.海洋湖沼通报,2006(2): 62—68
赵 斌,葛金芳,朱娟娟等,2007.小议在MTT法测细胞增殖
抑制率中IC50的计算方法.安徽医药,11(9): 834—836
赵广华,云少君,2012.植物铁蛋白结构,性质及其在纳米材料制备中的应用.山西大学学报: 自然科学版,35(2):285—292
贺静静,李 晔,李太武等,2009.泥蚶(Tegillarca granosa)cDNA文库的构建.海洋与湖沼,40(3): 289—295
黄河清,吴 楠,林庆梅等,2001.硒-铁蛋白电化学反应器储存含磷化合物的研究.生物物理学报,17(3): 554—560
谢晶曦,常俊标,王绪明,2001.红外光谱在有机化学和药物化学中的应用(修订版).北京: 科学出版社,302—346
Cho K J,Shin H J,Lee J H et al,2009.The crystal structure of ferritin from Helicobacter pylori reveals unusual conformational changes for iron uptake.Journal of Molecular Biology,390(1): 83—98
Crichton R R,Declercq J P,2010.X-ray structures of ferritins and related proteins.Biochimica et Biophysica Acta(BBA)-General Subjects,1800(8): 706—718
Ebrahimi K H,Hagedoorn P L,Hagen W R,2013.Phosphate accelerates displacement of Fe (III)by Fe (II)in the ferroxidase center of Pyrococcus furiosus ferritin.FEBS Letters,587(2): 220—225
Ensign D,Young M,Douglas T,2004.Photocatalytic synthesis of copper colloids from Cu (II)by the ferrihydrite core of ferritin.Inorganic Chemistry,43(11): 3441—3446
Harrison P M,Arosio P,1996.The ferritins: molecular properties,iron storage function and cellular regulation.Biochimica et Biophysica Acta-Bioenergetics,1275(3): 161—203
Li C H,Li Z,Li Y et al,2012.A ferritin from Dendrorhynchus zhejiangensis with heavy metals detoxification activity.PloS One,7(12): e51428
Pead S,Durrant E,Webb B et al,1995.Metal ion binding to apo,holo,and reconstituted horse spleen ferritin.Journal of Inorganic Biochemistry,59: 15—27
Zhao G,Bou-Abdallah F,Arosio P et al,2003.Multiple pathways for mineral core formation in mammalian apoferritin.The role of hydrogen peroxide.Biochemistry,42(10): 3142—3150
Zhu B,Lin Q,Ke C H et al,2011.Single subunit type of ferritin from visceral mass of Saccostrea cucullata: cloning,expression and cisplatin-subunit analysis.Fish &Shellfish Immunology,31(3): 453—461
