浒苔微观繁殖体与亚历山大藻相互作用的研究*
2015-04-10周名江张清春林佳宁
刘 青 颜 天 周名江 张清春 林佳宁
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071;2.中国科学院大学 北京 100049;3.中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室 烟台 264003)
大型海洋绿藻大量繁殖或聚集形成的藻华现象为“绿潮(Green Tides)”,是世界沿海各国普遍发生的一种生态现象。自2007年以来,我国黄海海域连续8年发生了大规模的绿潮灾害,该绿潮主要原因种为浒苔Ulva prolifera (Leliaert et al,2009;Shimada et al,2010;中国海洋环境质量公报,2007—2014)。浒苔作为一种机会型的大型绿藻,生活史非常复杂,整个生命过程由微观繁殖体阶段和可见的藻丝体阶段交替进行。浒苔微观繁殖体作为浒苔生长发育的早期形成产物,主要包括孢子、配子、合子这些无细胞壁保护的裸露单细胞,在适宜的温盐等条件下,微观繁殖体遇到合适附着基就会固着,进而萌发生长成藻丝体,固着和萌发是浒苔生长发育的必要阶段(Chapman,1986;Clayton,1992;Fletcher et al,1992;Santelices et al,2002)。大量的调查数据表明浒苔微观繁殖体不仅是浒苔绿潮形成过程的重要产物,而且作为绿潮发生的“种子库”在整个绿潮的发生发展过程中发挥重要作用(Li et al,2014;Song et al,2015)。
亚历山大藻是一种世界沿海分布较广、危害严重的赤潮原因种,由其引发的赤潮规模呈现逐年扩大的态势。在我国沿岸的南北海域中,亚历山大藻也广泛分布,是近年来常见的赤潮生物(周名江等,2003)。该藻不但能产生麻痹性贝毒(PSP,Paralytic Shellfish Poisoning),还产生其它有毒有害物质危害海洋生态环境(Simonsen et al,1995;Yan et al,2001;Emura et al,2004)。
Jasser(1995)指出形成绿潮的大型海藻可通过与其它浮游植物的相互作用而影响绿潮发生海域的种类分布与生态格局;秦玉涛等(2011)发现浒苔绿潮暴发期间南黄海海域浮游植物种类、细胞数、多样性均发生一定变化。Sfriso等(1994)发现绿潮暴发的水域赤潮却很少暴发;夏斌等(2009)在非浒苔区发现有小面积的裸甲藻赤潮,临近的浒苔暴发海域内却未发现赤潮。上述研究均反映了自然水体中绿潮对浮游植物的影响效应,甚至可以影响赤潮的发生。
绿潮暴发后对海域中浮游植物的影响是通过多种途径进行的,其中部分研究结果表明大型绿藻的藻体会通过分泌化感物质来影响微藻生长(霍元子等,2010;Wang et al,2013)。浒苔微观繁殖体作为其生长发育过程的早期形成产物,细胞结构较为简单,对微藻的影响效应的开端和发展、对黄海绿潮的贡献,以及微藻对于浒苔微观繁殖体的反向作用,目前关于这类两者间的相互影响效应还未见报道。
本文针对以上问题,选取了浒苔微观繁殖体中极具代表力的配子以及上述常见有害赤潮藻种亚历山大藻,通过营养盐充足条件下的浒苔配子与赤潮藻的共培养实验,在实验室模拟了浒苔微观繁殖体早期2个重要阶段(固着和萌发阶段)与亚历山大藻间的影响作用,以期为绿潮和赤潮相关研究提供参考。
1 材料与方法
1.1 微藻与浒苔的培养
实验所用微藻全部取自中国科学院海洋研究所海洋生态实验室。塔玛亚历山大藻(Alexandrium tamarense)ATHK藻株分离自南海香港海域,链状亚历山大藻(A.catenella)ACDH藻株分离自东海长江口海域,这两株藻均由暨南大学提供;微小亚历山大藻(A.minutum)AM-LYG藻株分离自黄海连云港海域;以上三种亚历山大藻均可以产生PSP毒素。不产PSP毒素的相关亚历山大藻(A.affine)ASCH分离自黄海,由国家海洋局第三海洋研究所提供。将微藻分别在f/2-Si培养液(Guillard,1975)中培养至指数生长期待用,培养温度为20°C,光照4000 lx,光暗比为14∶10。实验海水为管道海水(取自青岛太平角),经沙滤、沉淀,0.45μm混合纤维滤膜过滤,再用高温煮沸灭菌。
浒苔采集于青岛汇泉湾。将采集的鲜活浒苔去除泥沙,用混合抗生素进行灭菌处理,再用灭菌海水漂洗3—4次,镜检确认无杂藻后,无菌培养于f/2-Si培养液中,同时添加 1mg/L GeO2以消除硅藻的影响。培养条件、所用海水均同微藻。
1.2 浒苔配子的获得
采集到浒苔的繁殖方式为单性生殖(Liu et al,2015)。浒苔配子体产生的配子未经融合形成合子,而是直接发育成配子体,继续释放配子完成单性循环。浒苔配子主要是通过形态学观察及趋光性检测来判断: 形态学观察到配子个体大小约为 6μm×3μm,呈长椭圆形,前端透明,后端为绿色的色素体,细胞内一般含有一个橘红色的眼点和一个蛋白核,顶生两根鞭毛使其可以快速运动;在趋光性检测中呈现明显的正趋光。
利用断裂的方法诱导浒苔释放配子(Dan et al,2002)。将单株浒苔配子体切为1—2cm长的片段,放入盛有f/2-Si培养液的培养皿中,每天更换新鲜培养液,诱导配子囊的形成。2—3天后,待藻体颜色由浅绿色变为黄褐色,在光下刺激浒苔释放配子,待其释放完毕变为白色后,取出藻段,将配子液收集,迅速进行实验。
1.3 浒苔配子固着阶段与亚历山大藻的相互影响效应
1.3.1 亚历山大藻对浒苔配子固着的影响 实验采用共培养的方法进行,将刚释放的浒苔配子接种到50mL小烧杯中,其中对照组为浒苔配子单培养组(培养介质为无菌海水),实验组分别加入四株不同的亚历山大藻藻株,为浒苔配子与亚历山大藻共培养组,浒苔配子的终密度设为 2.0×104cells/mL,微藻密度分别设为 0.01×104cells/mL和 0.1×104cells/mL,反应体系为40mL。每个小烧杯底部放置1个盖玻片,便于固着配子的计数。全部对照组和实验组避光培养1天,以保证浒苔配子的随机固着。1天后取出盖玻片,在灭菌海水中轻微震荡数次,洗去未附着的配子。光学显微镜下随机观察20个视野(40×10倍),取其平均值计算固着的配子量,以此固着量作为统计指标。实验开始前加入 f/2培养液,保证整个实验过程中不受营养盐的限制。每组实验设置3个平行组。
1.3.2 浒苔配子固着对亚历山大藻生长的影响实验同样采用共培养的方法进行,培养条件同1.3.1。但是对照组为四株亚历山大藻单培养组,实验组依旧为浒苔配子与亚历山大藻共培养组。统计指标为亚历山大藻的藻细胞密度。实验结束后从每个烧杯中各取1mL藻液,用碘液固定,计数板计数,每个样品计数3次,取其平均值。每个处理包含3个平行组。
1.4 浒苔配子萌发阶段与微藻的相互影响效应
1.4.1 亚历山大藻对浒苔配子萌发的影响 实验开始前1天,将浒苔配子接种到40mL含f/2培养液的 50mL小烧杯中,接种密度为 2.0×104cells/mL,避光培养以保证浒苔配子的随机固着。实验开始时恢复光照培养,并分别加入四株不同的亚历山大藻藻株,对照组为浒苔配子单培养组,实验组为浒苔配子与亚历山大藻共培养组,微藻密度设置为 0.1×104cells/mL。烧杯底部放置1个盖玻片便于观察配子萌发,实验持续7天。每天用显微镜计数盖玻片上配子的萌发率(以分裂为两细胞为萌发标准),每个盖玻片计数20个视野。萌发率(%)=N/N0×100% (N0,一个视野中总的配子数;N,一个视野中萌发的配子数)。每次取样结束后,向实验体系中补充200μL f/2营养液,以保证实验过程中不受营养盐限制。每组实验设置3个平行组。
1.4.2 浒苔配子萌发阶段对亚历山大藻的影响整个实验培养条件同 1.4.1。但是对照组设定为 4株不同的亚历山大藻单培养组,实验组为浒苔配子与亚历山大藻共培养组,以亚历山大藻细胞密度作为统计指标。实验开始前1天,将浒苔配子接种到40mL含 f/2培养液的 50mL小烧杯中,接种密度为 2.0×104cells/mL,避光培养以保证浒苔配子的随机固着。实验开始时恢复光照培养,持续 7天。每天取出200μL藻液,用碘液固定,计数板计数,每个样品计数3次,取其平均值,计算微藻细胞密度。微藻生长抑制率I=(1–N1/N2)×100% (N1为共培养组藻细胞密度;N2为单培养组藻细胞密度)。
1.5 亚历山大藻对浒苔配子固着的可能影响效应研究
1.5.1 相关亚历山大藻(ASCH)不同组分对浒苔配子固着的影响效应 将处于指数生长期的相关亚历山大藻液用10μm筛绢过滤,得到藻细胞过滤液和藻细胞,将得到的藻细胞重新悬浮于灭菌的海水中,得到藻细胞重悬液。利用超声波细胞破碎仪将藻细胞破碎后,离心 15min,取上清液得到藻细胞内容物,收集到的沉淀则为藻细胞碎片。将上述组分以灭菌海水稀释到相当于藻细胞密度为50cells/mL后用于实验。实验方法同1.3.1。
1.5.2 相关亚历山大藻(ASCH)去藻过滤液组分对浒苔配子固着的影响效应
(1)温度和pH对相关亚历山大藻(ASCH)去藻过滤液毒性的影响 用10μm筛绢过滤相关亚历山大藻,得到去藻过滤液,分别置于温度为60、80、100°C的水浴中处理30min,然后取出恢复到室温20°C,进行对浒苔配子固着的影响实验,培养条件及实验方法同1.3.1。
将得到的去藻过滤液,分别用HCl和NaOH将其pH调为 2.1、6.1、12.1,30min后再调回到起始的pH 8.1,进行对浒苔配子固着的影响实验,培养条件及实验方法同1.3.1。
(2)去蛋白组分对相关亚历山大藻(ASCH)去藻过滤液毒性的影响 将得到的相关亚历山大藻去藻过滤液,加热蒸发去除蛋白组分。然后进行对浒苔配子固着的影响实验,培养条件及实验方法同1.3.1。
1.6 浒苔配子萌发阶段对塔玛亚历山大藻生长的可能影响效应研究
实验采用共培养的方法进行,实验方法同1.4.2。对照组为塔玛亚历山大藻(ATHK)单培养组,实验组分别为浒苔配子、浒苔配子培养过滤液与塔玛亚历山大藻共培养组。将密度为 2×104cells/mL的浒苔配子在含 f/2培养液的小烧杯中培养,培养液经灭菌的0.45μm混合纤维滤膜过滤,得到培养过滤液。立即接种处于对数生长期的塔玛亚历山大藻,初始密度设置为0.1×104cells/mL。每隔1天将小烧杯中的培养液移出 4mL,然后添加 4mL新鲜浒苔培养滤液以保持培养液体积的恒定。对照组添加4mL灭菌海水,实验时间7天,计算微藻生长抑制率。
1.7 数据处理
实验数据采用Excel 2007作图,SPSS16.0统计软件进行样本检验分析,所得数据均以平均值±标准误表示(n=3)。并进行单因素方差分析(ANOVA),用Duncan进行多重比较检验和差异显著性分析,P<0.05被认为是在α=0.05水平上差异性显著。
2 结果
2.1 亚历山大藻对浒苔配子固着与萌发的影响
2.1.1 亚历山大藻对浒苔配子固着的影响 四株亚历山大藻藻株对浒苔配子的固着均有强烈的抑制效应,并且随着浓度的升高,其抑制效应逐渐加强(图1)。其中四株亚历山大藻在生物量为0.01×104cells/mL时(野外赤潮密度),对浒苔配子的固着就存在着显著的影响,最大固着量仅达到 7cells/mm2,显著低于对照组(P<0.05);在其密度达到 0.1×104cells/mL时,与之共存的浒苔配子数量急剧减少,甚至可以完全“杀死”浒苔配子,从而影响其固着。
以 24h时浒苔配子的固着量分别对不同亚历山大藻藻株的藻密度作图,并进行回归分析,根据回归曲线方程计算半致死密度,得出不同亚历山大藻藻株对浒苔配子固着的影响大小(图2): 四株亚历山大藻在较低生物量水平时就对浒苔配子固着产生半数抑制作用,塔玛亚历山大藻(ATHK)、链状亚历山大藻(ACDH)、相关亚历山大藻(ASCH)和微小亚历山大藻(AM-LYG)的 24h ID50分别为 12、13、36和49cells/mL。从结果中可以看出,不产 PSP毒素的相关亚历山大藻(ASCH)依然对浒苔配子的固着存在强烈的抑制作用,所以亚历山大藻对浒苔的这种影响效应与其所产毒素特征不符,因此其对浒苔配子固着的抑制作用与赤潮藻毒素无直接相关关系,PSP毒素并非是亚历山大藻抑制浒苔配子固着的主要原因。
2.1.2 亚历山大藻对浒苔配子萌发的影响 图3显示了四株亚历山大藻对浒苔配子萌发率的影响。尽管四种亚历山大藻在 3—5天对浒苔配子萌发表现出了一定的促进效果,不同程度地加速了浒苔配子的萌发,但培养7天后实验对照组和处理组的浒苔配子均完全萌发。即在这些藻种存在的情况下,浒苔配子的萌发率与对照组均无显著差异性。
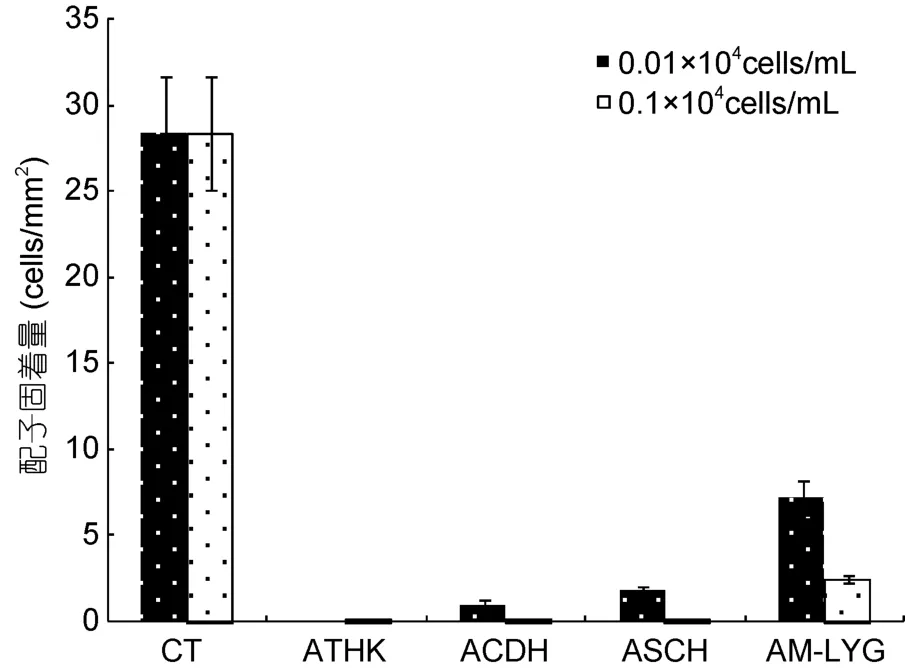
图1 四株亚历山大藻在不同密度下对浒苔配子固着的影响Fig.1 Effect of four Alexandrium strains in different density on the settlement of U.prolifera gametes
2.2 浒苔配子固着、萌发阶段对亚历山大藻的影响
2.2.1 浒苔配子固着阶段对亚历山大藻生长的影响表 1中分别列出了实验结束时四株亚历山大藻在浒苔配子是否存在下的生物量,由于配子固着阶段时间较短(1天),且在黑暗条件下进行,实验组与对照组细胞数量并无显著性差异(P>0.05)。所以浒苔配子对不同株亚历山大藻的生长并没有明显的抑制或“杀死”作用。
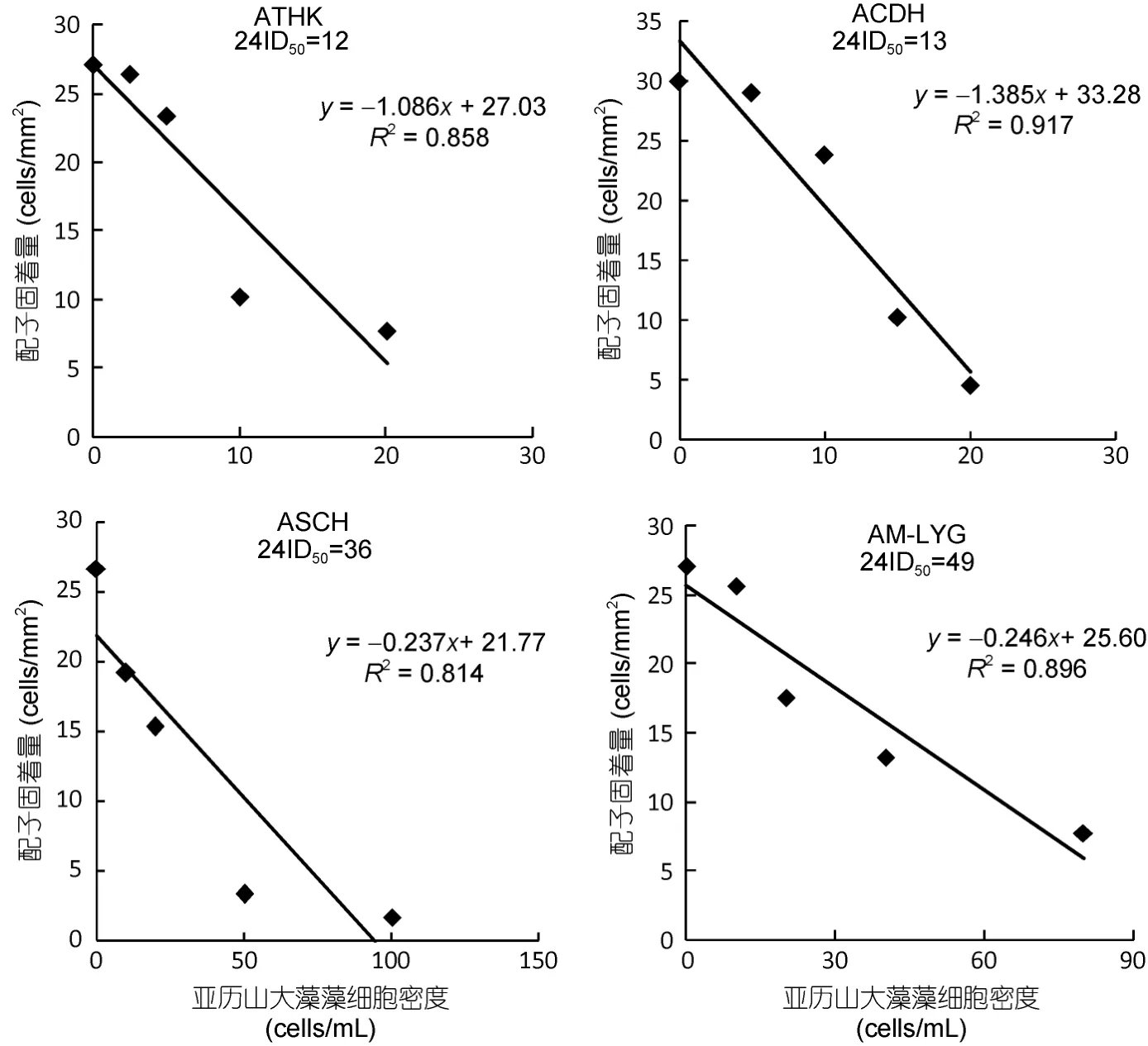
图2 四株亚历山大藻对浒苔配子固着的半数致死密度(24h ID50)Fig.2 The 50% lethal dose (24h ID50)of four Alexandrium strains in different density on settlement of U.prolifera gametes after 24h of treatment
2.2.2 浒苔配子萌发阶段对亚历山大藻生长的影响浒苔配子在萌发阶段对四株亚历山大藻生长的影响效应见图4: 与对照组(微藻单培养体系)相比,实验中各处理组(浒苔与微藻共培养体系)中亚历山大藻的生长均受到了不同程度的影响。在第 7天对塔玛亚历山大藻(ATHK)、链状亚历山大藻(ACDH)和微小亚历山大藻(AM-LYG)的生长抑制率分别达到27%、18%和 4%,其中塔玛亚历山大藻(ATHK)处理组与对照组相比差异性显著(P<0.05),细胞密度明显降低;但浒苔配子与相关亚历山大藻(ASCH)共培养过程中对这株微藻的抑制程度并不明显,并未达到显著性差异水平。
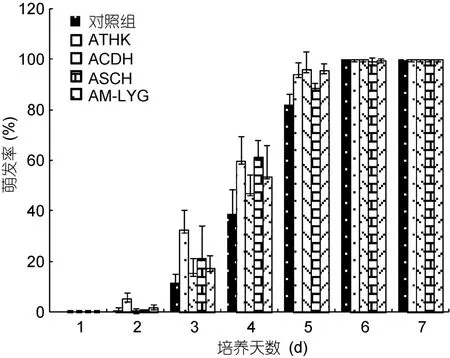
图3 四株亚历山大藻对浒苔配子萌发的影响Fig.3 Effect of four Alexandrium strains in different culture durations on germination of U.prolifera gametes

表1 浒苔配子在固着阶段对四株亚历山大藻生长的影响Tab.1 The effect of four Alexandrium strains on growth of U.prolifera at settlement stage

图4 浒苔配子在萌发阶段对四株亚历山大藻生长的影响(*与对照组差异显著P<0.05)Fig.4 Effect of four Alexandrium strains on growth of U.prolifera gametes at germination stage (*P<0.05 as compared to the control)
2.3 亚历山大藻抑制浒苔配子固着的可能影响效应研究
2.3.1 相关亚历山大藻(ASCH)不同组分对浒苔配子固着的影响效应 为进一步探讨亚历山大藻对浒苔配子产生强烈抑制作用的致毒机理,本研究以不产PSP毒素的相关亚历山大藻为例,研究了该藻的不同组分分别对浒苔配子的影响,结果如图5所示: 相关亚历山大藻的五种组分均对浒苔配子的固着产生强烈的抑制,和对照相比均有显著影响(P<0.05)。其中藻液、藻细胞重悬液和去藻过滤液对配子的不利影响最为显著,表明该抑制组分可能产生于细胞内,并且能分泌到细胞外。
2.3.2 相关亚历山大藻(ASCH)去藻过滤液对浒苔配子固着的可能影响物质分析 由图6a可知,与室温下(20°C)相关亚历山大藻去藻过滤液的毒性相比,经过不同温度处理的去藻过滤液对浒苔配子固着的抑制作用均显著减弱,表明温度对过滤液毒性有一定的影响,去藻过滤液中可能含有易受温度影响的蛋白类物质。但是处理组与对照组浒苔配子固着量仍有显著差异,说明该类物质在高温处理后亦可影响浒苔配子的固着,组成中还含有耐高温的非蛋白成分。
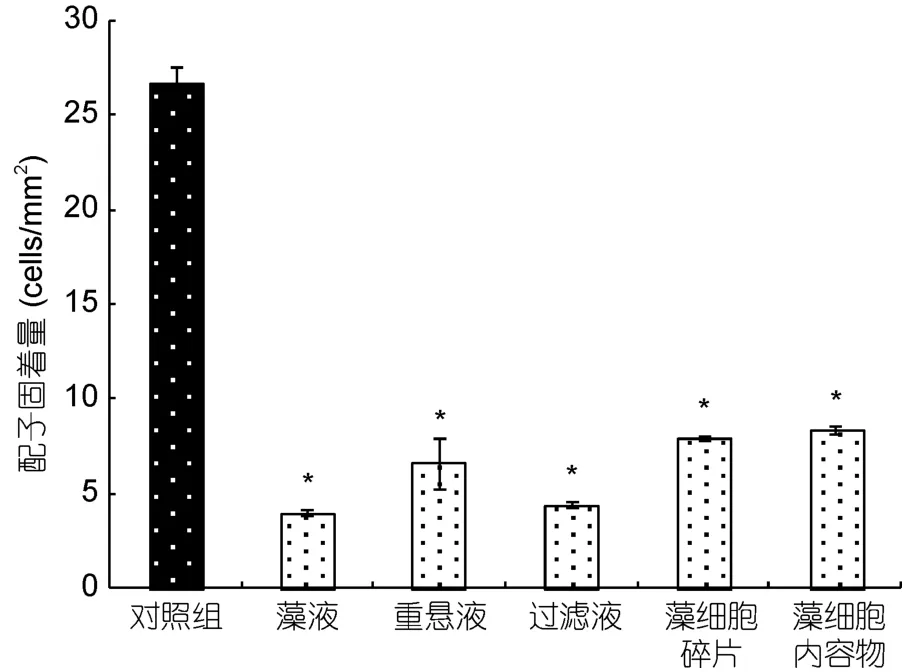
图5 相关亚历山大藻(ASCH)不同组分对浒苔配子固着的影响效应(*与对照组差异显著P<0.05)Fig.5 Effect of A.affine (ASCH)in different fractions on settlement of U.prolifera gametes (*P<0.05 as compared to the control)
与初始 pH(8.1)相比(图6b),经过酸碱处理的去藻过滤液对浒苔配子固着的影响有所降低,说明去藻过滤液中含有容易受到酸碱影响的成分。但是与对照组相比配子固着量仍显著减少,说明过滤液中仍然含有耐酸碱的成分。由以上结果可知,影响浒苔配子固着的相关亚历山大藻去藻过滤液中可能包含蛋白类和非蛋白类两种成分。
与对照组相比(图6c),去藻过滤液去除蛋白后,对浒苔配子固着的抑制效应依然比较显著。因此进一步说明该类影响物质含有非蛋白成分。
2.4 浒苔配子萌发阶段抑制亚历山大藻的可能影响效应研究
由图7可知,与对照组相比,浒苔配子添加组和浒苔滤液连续添加组均显著抑制了塔玛亚历山大藻的生长(P<0.05)。这说明浒苔配子可以分泌一些物质来影响微藻的生长,且该抑藻物质不但存在于浒苔组织中,还可以分泌到培养液中。
综合以上结果得出: 浒苔配子在不同阶段与亚历山大藻间的相互作用关系不同。固着期主要体现在微藻对浒苔配子固着的抑制作用,这是亚历山大藻通过分泌某些蛋白类和非蛋白类共同组成的化感物质造成的,PSP毒素并未起到主导作用;萌发期主要体现在浒苔对微藻生长的抑制作用,是由浒苔配子分泌的化感物质造成的。
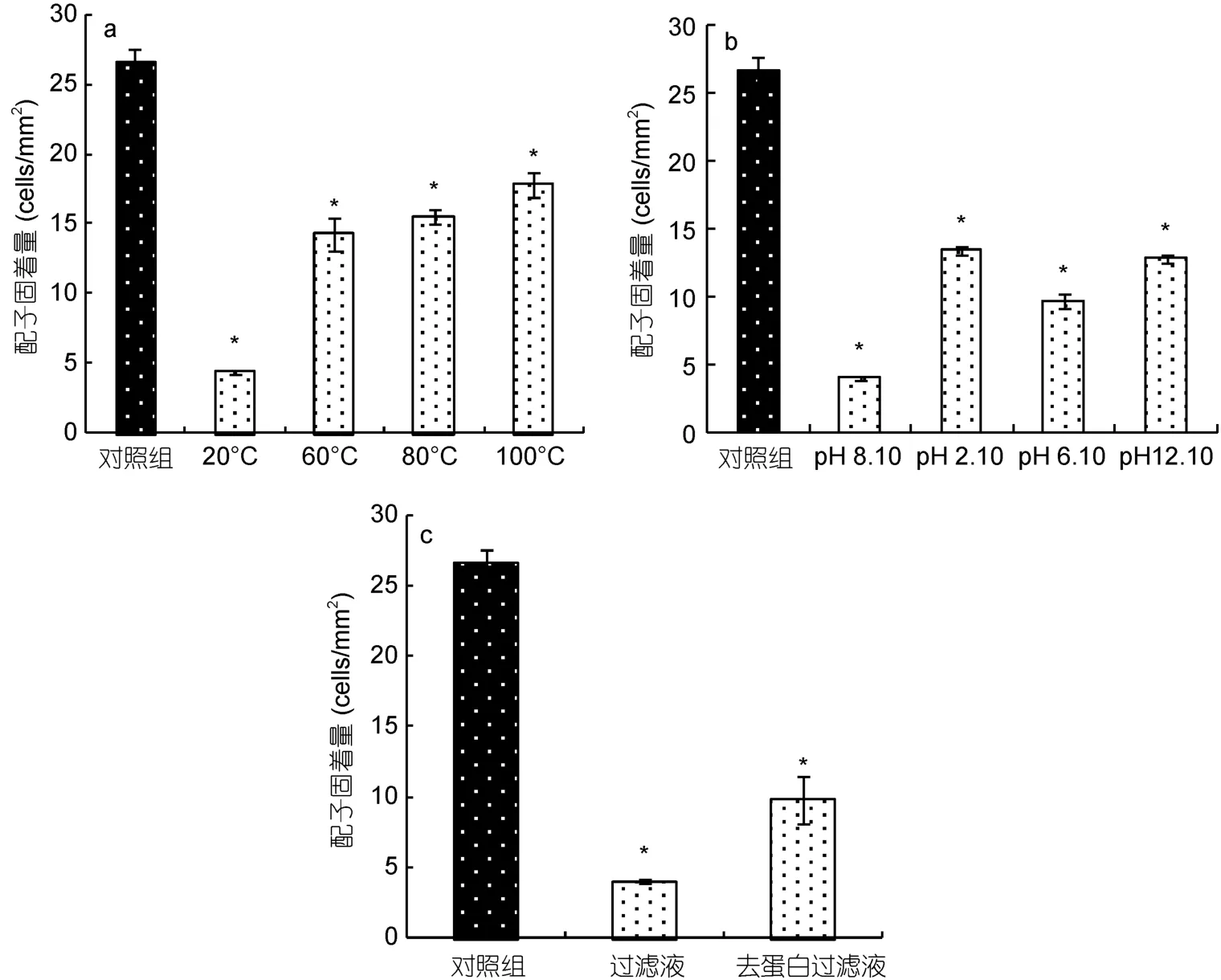
图6 相关亚历山大藻(ASCH)去藻过滤液对浒苔配子固着的可能影响物质分析(*与对照组差异显著P<0.05)Fig.6 Possible substance in A.affine (ASCH)cell-free medium on settlement of U.prolifera gametes (* P<0.05 as compared to the control)

图7 浒苔配子不同组分对塔玛亚历山大藻生长的影响效应分析(*对照组差异显著P<0.05)Fig.7 Effect of U.prolifera gametes in different fractions on growth of A.tamarense (ATHK)(*P<0.05 as compared to the control)
3 讨论
我国黄海海域连年暴发大面积的浒苔绿潮,对近海生态系统造成了极大的危害,而微藻作为海洋初级生产力的主要贡献者,对维持生态系统平衡具有举足轻重的作用。近年来人们提出利用大型藻藻华来抑制微藻藻华的理念。针对黄海浒苔绿潮对赤潮藻的影响效应,国内的研究主要集中在浒苔多细胞成熟藻丝体的层面上,对作为浒苔形成早期阶段的细胞结构较简单的微观繁殖体的影响研究尚有缺乏,因此本研究对浒苔微观繁殖体(配子)在早期生长发育的不同时期与微藻间的相互作用关系进行探讨。研究发现浒苔配子在固着和萌发阶段与微藻间的相互作用关系不同,两者轮流体现出优势地位。固着期主要体现在微藻对浒苔配子固着的抑制作用,萌发期主要体现在浒苔对微藻生长的抑制作用。这种差异性可能与浒苔自身生长特性有关: 固着期浒苔微观繁殖体为裸露的单细胞,无细胞壁保护,较脆弱,抵御外界环境能力稍弱;萌发期以后,细胞逐渐增多,细胞壁已形成,自身结构较完整,抵御外界环境影响能力强(Christie,1973)。
首先在浒苔微观繁殖体的固着阶段,亚历山大藻在生物量较低时(<50cells/mL)就通过影响浒苔配子的存活而对其固着产生明显的抑制;而浒苔对亚历山大藻的生长无明显的抑制或“杀死”作用。分析原因可能是亚历山大藻分泌的化感物质造成了这种效应,因为本研究是在室内控制条件下进行,首先排除温度、营养盐变化等环境因素可能对试验结果产生的影响。光照虽然会造成配子固着的不均匀性,但是对其固着发育的生理状况和最终固着量并没有显著地影响(Christie et al,1968)。就化感作用而言,利用PSP毒素对亚历山大藻来说可能是最为有利的,然而通过对结果的分析比较,发现不同亚历山大藻藻株对浒苔配子固着的影响效应与所产毒素特征不符,不产 PSP毒素的相关亚历山大藻在生物量水平仅36cells/mL时就对浒苔配子的固着有明显的抑制作用。因此,PSP毒素并非关键,除藻毒素之外的化感物质可能发挥着积极作用。通过进一步对相关亚历山大藻培养液不同组分的比较,发现该影响物质不但存在于藻细胞中而且可以分泌到胞外起到一定的作用,并且该类物质可能由蛋白类和非蛋白类成分共同组成,所以亚历山大藻细胞分泌的1种甚至几种次生代谢物质可能共同参与化感作用。而目前的一些研究均表明亚历山大藻可以分泌多种化感物质对其它藻类产生影响。Hansen等(1989),Tillmann等(2002)将其归因于 PSP以外的未知毒素;Emura等(2004),Yamasaki等(2008)分别认为是分子量>10kDa的具有溶血活性的蛋白复合物和分子量大小为 1000kDa的多聚糖;张彬等(2008)发现相关亚历山大藻能产生极性多糖类毒素;Ma等(2011)得出亚历山大藻的化感物质至少包含两部分具有不同极性的成分,其中一部分组成为分子量在 7—15kDa间的非蛋白成分,但具体化学结构未知。这些研究报道的亚历山大藻藻株分泌化感物质的特性与本研究结果相吻合,同时也为下一步特异性的针对抑制浒苔的化感物质进行分离、鉴定奠定了基础,也许将来可以实现选择性的抑制浒苔的生长发育,从而为浒苔绿潮的减灾政策提供理论依据。
在随后浒苔的萌发阶段,两者间相互作用主要体现在浒苔对亚历山大藻生长的抑制: 浒苔配子添加组在其完全萌发的第 7天对塔玛亚历山大藻的生长抑制率达到了27%,明显影响了其生长,并且连续添加的培养滤液也对塔玛亚历山大藻的生长产生了显著的抑制。王悠等(2006)指出细菌可能会影响环境中微藻的生长及种群动态。然而本实验的浒苔经过灭菌处理,环境细菌对微藻生长的影响基本可以忽略。另外本研究排除了光照、营养盐等环境因素的影响,结合浒苔成熟藻丝体的研究,推断是浒苔微观繁殖体分泌的化感物质造成了这种效应,进一步说明浒苔在早期发育过程中就已经开始分泌化感物质,而并不仅仅局限于成熟藻丝体阶段(霍元子等,2010;张建恒等,2011;贾睿等,2012;Wang et al,2013)。
结合国内外关于浒苔化感作用的研究结果以及本研究的实验结果可以发现,微藻对浒苔的抑制作用只体现在浒苔微观繁殖体的固着阶段,而浒苔对微藻的竞争优势从早期的萌发阶段到逐渐发育成熟的藻丝体阶段都有所体现,如果这种相互作用在自然界发生,其生态效应是复杂的。倘若作为绿潮发生“种子库”的大量微观繁殖体在最初的固着过程中未被亚历山大藻抑制,那么在随后生长发育阶段浒苔逐渐开始占据优势: 首先在萌发阶段便开始分泌化感物质抑制微藻生长;然后浒苔逐渐生长发育,并在合适的风场流场作用下逐渐向北漂移,漂移过程中在合适的光照温度等条件下生物量迅速扩增,继而通过遮蔽阳光、分泌化感物质以及大量吸收营养盐等途径,进一步增强对微藻的抑制作用,这一过程从现场调查和试验研究中可以得到明显的体现(夏斌等,2009;霍元子等,2010;秦玉涛等,2011)。然而,在个别河口也可能存在生物量较高的亚历山大藻,一旦它们从最初固着阶段对浒苔微观繁殖体产生强烈的抑制作用,便可从早期阶段抑制浒苔的生长发育继而影响绿潮的发生发展过程。因此,浒苔微观繁殖体与微藻之间的化感作用很可能通过影响浒苔的生长发育,进而密切影响绿潮的发生规模;同时浒苔绿潮对黄海海域微型浮游植物的影响也并不局限于成熟的藻丝体阶段,而是从发育早期的萌发阶段就开始体现,这种潜在的危害效应值得深入评估。
王 悠,俞志明,宋秀贤等,2006.共培养体系中石莼和江蓠对赤潮异弯藻生长的影响.环境科学,27(2): 246—252
中国海洋环境质量公报,2007—2014.http: //www.coi.gov.cn/gongbao/huanjing/
张 彬,颜 天,陈桃英等,2008.相关亚历山大藻(Alexandrium affine)(非 PSP产毒株)毒理的初步研究.海洋与湖沼,39(4): 419—426
张建恒,霍元子,王阳阳等,2011.浒苔与球等鞭金藻相互抑制的实验验证.上海海洋大学学报,20(2): 211—216
周名江,颜 天,邹景忠,2003.长江口邻近海域赤潮发生区基本特征初探.应用生态学报,14(7): 1031—1038
秦玉涛,纪焕红,宋晨瑶等,2011.南黄海绿潮分布区浮游植物的生态特征.海洋环境科学,30(3): 394—397
贾 睿,吴 敏,蔡春尔等,2012.浒苔对赤潮异湾藻的克生作用.水产学报,36(4): 562—567
夏 斌,马绍赛,崔 毅等,2009.黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系.渔业科学进展,30(5): 94—101
霍元子,田千桃,徐栅楠等,2010.浒苔对米氏凯伦藻生长的克生作用.海洋环境科学,29(4): 496—499,508
Chapman A R O,1986.Population and community ecology of seaweeds.In: Blaxter J H S,Southwood A J eds.Advances in Marine Ecology.London: Academic Press,1—161
Christie A O,1973.Spore settlement in relation to fouling by Enteromorpha.In: Acker R F ed.Proceedings of the Third International Congress on Marine Corrosion and Fouling.Evanston: Northwestern University Press,674—681
Christie A O,Shaw M,1968.Settlement experiments with zoospores of Enteromorpha intestinalis (L.)Link.British Phycological Bulletin,3(3): 529—534
Clayton M N,1992.Propagules of marine macroalgae: structure and development.British Phycological Journal,27(3):219—232
Dan A,Hiraoka M,Ohno M et al,2002.Observations on the effect of salinity and photon fluence rate on the induction of sporulation and rhizoid formation in the green alga Enteromorpha prolifera (Müller)J.Agardh (Chlorophyta,Ulvales).Fisheries Science,68(6): 1182—1188
Emura A,Matsuyama Y,Oda T,2004.Evidence for the production of a novel proteinaceous hemolytic exotoxin by dinoflagellate Alexandrium taylori.Harmful Algae,3(1): 29—37
Fletcher R L,Callow M E,1992.The settlement,attachment and establishment of marine algal spores.British Phycological Journal,27(3): 303—329
Hansen P J,1989.The red tide dinoflagellate Alexandrium tamarense: effects on behaviour and growth of a tintinnid ciliate.Marine Ecology Progress Series,53: 105—116
Jasser I,1995.The influence of macrophytes on a phytoplankton community in experimental conditions.Hydrobiologia,306(1): 21—32
Leliaert F,Zhang X W,Ye N H et al,2009.Research note:identity of the Qingdao algal bloom.Phycological Research,57(2): 147—151
Li Y,Song W,Xiao J et al,2014.Tempo-spatial distribution and species diversity of green algae micro-propagules in the Yellow Sea during the large-scale green tide development.Harmful Algae,39: 40—47
Liu Q,Yu R C,Yan T et al,2015.Laboratory study on the life history of bloom-forming Ulva prolifera in the Yellow Sea.Estuarine,Coastal and Shelf Science,163: 82—88
Ma H Y,Krock B,Tillmann U et al,2011.Isolation of activity and partial characterization of large non-proteinaceous lytic allelochemicals produced by the marine dinoflagellate Alexandrium tamarense.Harmful Algae,11: 65—72
Santelices B,Aedo D,Hoffmann A,2002.Banks of microscopic forms and survival to darkness of propagules and microscopic stages of macroalgae.Revista Chilena de Historia Natural,75(3): 547—555
Sfriso A,Pavoni B,1994.Macroalgae and phytoplankton competition in the central Venice lagoon.Environmental Technology,15(1): 1—14
Shimada S,Nagano M,Hiraoka M et al,2010.Phylogeographic analysis of the genus Ulva (Ulvales,Chlorophyta),including bloom sample in Qingdao,China.Coastal Marine Science,34(1): 117—122
Simonsen S,Møller B L,Larsen J et al,1995.Haemolytic activity of Alexandrium tamarense cells.In: Lassus P ed.Harmful Marine Algal Blooms.Paris: Lavoisier,513—518
Song W,Li Y,Fang S et al,2015.Temporal and spatial distributions of green algae micro-propagules in the coastal waters of the Subei Shoal,China.Estuarine,Coastal and Shelf Science,163: 29—35
Tillmann U,John U,2002.Toxic effects of Alexandrium spp.on heterotrophic dinoflagellates: an allelochemical defence mechanism independent of PSP-toxin content.Marine Ecology Progress Series,230: 47—58
Wang R J,Wang Y,Zhou J et al,2013.Algicidal activity of Ulva pertusa and Ulva prolifera on Prorocentrum donghaiense under laboratory conditions.African Journal of Microbiology Research,7(34): 4389—4396
Yamasaki Y,Katsuo D,Nakayasu S et al,2008.Purification and characterization of a novel high molecular weight exotoxin produced by red tide phytoplankton,Alexandrium tamarense.Journal of Biochemical and Molecular Toxicology,22(6):405—415
Yan T,Zhou M J,Fu M et al,2001.Inhibition of egg hatching success and larvae survival of the scallop,Chlamys farreri,associated with exposure to cells and cell fragments of the dinoflagellate Alexandrium tamarense.Toxicon,39(8):1239—1244
