长牡蛎(Crassostrea gigas)Wnt4基因cDNA克隆与表达分析*
2015-04-10张国范
杨 梅 许 飞 刘 俊 李 莉 张国范①
(1. 中国科学院海洋研究所海洋生态养殖技术国家地方联合工程实验室 青岛 266071; 2. 中国科学院大学 北京 100049)
Wnt蛋白是一类由Wnt基因编码并经脂质化修饰的分泌性糖蛋白(Smolichet al,1993)。Wnt基因最初由 Nusse等人于 1982年发现于鼠类乳腺癌病毒(mouse mammary tumor vious, MMTV)诱导的小鼠乳腺癌, 称为 int-1基因。后发现, 该基因与 1973年发现的果蝇wingless基因为同源基因, 故将两者合并命名为Wnt(Nusseet al, 1992)。在随后的研究中人们在从线虫到脊椎动物的体内均发现了该类蛋白,且成员数目越来越多(Parret al, 1994; Bergstainaet al, 1997)。由Wnt蛋白所介导的Wnt信号通路参与了动物体内多种生物学过程的调控, 包括胚胎的生长发育、组织的稳定、能量代谢的平衡及干细胞多功能性的维持等(韩琳等, 2008)。Wnt信号通路被阻断或有异常时, 动物胚胎的生长发育会遭到破坏,甚至诱发多种癌症(Klauset al, 2008; 尹定子等,2011)。
Wnt4是Wnt家族成员之一, 其蛋白序列富含半胱氨酸残基, 迄今该基因已在人、小鼠(Mus musculus)、斑马鱼(Daniorerio)、沙蚕(Platynereis dumerilii)、果蝇(Drosophila melanogaster)、栉孔扇贝(Chlamys farreri)、日本血吸虫(Schistosoma japonicum)等多个物种中进行了相关的表达和功能研究。人类和小鼠中,Wnt4在控制雌性发育、参与调节缪勒氏管的形成、控制卵巢内固醇的生成及抑制睾丸的形成中起关键作用; 同时, Wnt4是肾发育的正调控因子,其突变小鼠会在出生后 24小时内因肾较小并退化而死于肾衰(向阳等,2007); 另外, Sato等(2006)发现, 果蝇的Wnt4蛋白能够参与调控视网膜成像的特异性, 并通过调节细胞的运动来参与卵巢的形态发生; 日本血吸虫Wnt4在调控虫体表皮生长和雌虫产卵过程中发挥重要作用(陶丽红等, 2007); 栉孔扇贝的Wnt4基因在多个组织中(外套膜, 鳃, 闭壳肌, 肝胰腺, 精巢和卵巢)均有表达, 并可能参与两性性腺的发育(李海龙等, 2013)。目前, Wnt4在贝类发育中的表达特点和功能鲜有报道。长牡蛎是一种具有较高营养和经济价值的滤食性贝类, 是目前我国乃至全球产量最大的经济贝类(王如才等, 2008),同时也是研究得较为充分的贝类(Hedgecocket al, 2005)。本研究采用RACE技术克隆了长牡蛎(Crassostrea gigas)的Wnt4基因全长cDNA序列,并结合荧光定量 RT-PCR技术分析该基因在成体不同组织和幼体不同发育时期中的表达特点, 旨在探究 Wnt4基因在长牡蛎个体发育过程中的作用,为进一步开展双壳贝类 Wnt基因家族的功能研究提供基础。
1 材料与方法
1.1 实验动物
长牡蛎亲贝来自青岛崂东海珍品良种培育有限公司。解剖雌贝收集卵子, 放入10L过滤海水中; 收集雄性亲贝精子放入一个大烧杯中。卵子先用 90μm尼龙网过滤, 然后用25μm尼龙网漂洗, 最后放入5L过滤海水中并调节卵子浓度为50000个/mL。受精前收集卵子样品放入液氮。向卵子中添加精子使其密度保持在10—20个精子包围1个卵子, 获得受精卵, 在26ºC 25m3的砂滤海水中孵育, 盐度保持在30。幼虫生长发育时期的样品包括未受精的卵, 胚胎(二细胞期, 桑葚前期, 桑葚期, 囊胚期, 原肠前期, 原肠期),担轮幼虫, D形幼虫, 壳顶幼虫, 眼点幼虫, 稚贝和幼贝(具体的取样见表1)。另外, 解剖获取 5只长牡蛎的各组织样本(外套膜、闭壳肌、鳃、唇瓣、消化腺、血淋巴, 精巢和卵巢), 液氮中速冻后转移到–80°C冰箱保存, 用于不同组织总RNA的提取。
1.2 长牡蛎Wnt4基因的克隆、测序
采用 Trizol法提取长牡蛎的总 RNA。用 NanoDrop 2000(Thermo Scientific)检测提取的RNA浓度; 1.5%琼脂糖凝胶检测 RNA完整性。按照操作指南, 使用PrimeScript II 1st Strand cDNA Synthesis Kit (TaKaRa,Japan)合成RACE cDNA第一条链。

表1 长牡蛎幼虫不同发育时期样品取样Tab.1 Sampling of C. gigas different developmental stages
从GenBank下载人、小鼠、沙蚕、栉孔扇贝等物种的Wnt4蛋白序列, 并将这些序列与长牡蛎基因组数据库进行比对,获得长牡蛎Wnt4基因的片段。然后,根据获得的Wnt4基因片段设计引物, 对该基因片段进行验证后, 根据测序结果设计RACE引物, 采用巢式PCR扩增得到长牡蛎 Wnt4基因的全长, 所用引物见表2。

表2 长牡蛎Wnt4基因引物信息Tab.2 The information of C.gigasWnt4 primers
1.5%琼脂糖凝胶电泳检测PCR产物后用DNA凝胶纯化试剂盒(Axygen)回收目的片段产物, 纯化后连接到pEASY-T1载体(北京全式金生物技术公司)上并转化到大肠杆菌 DH5α 感受态细胞(北京全式金生物技术公司)中, 涂平板, 37°C培养过夜, 挑取抗氨苄青霉素的阳性克隆, 经菌液PCR检测后, 交由上海生工生物工程有限公司进行测序。
1.3 长牡蛎Wnt4基因序列分析及系统进化分析
用Lasergene软件包对测序得到的序列进行拼接,理论分子量Mw(Molecular weight)和等电点pI (Isoelectric point)采用 Expasycompute pI/Mw(http:// web.expasy.org/compute_pi/)进行预测, 氨基酸的多重比对采用Clustal X和 DNAMAN 完成, 信号肽区域预测用SignalP 4.1(http://www.cbs.dtu.dk/services/ SignalP/)进行, 系统发生树的构建采用在线软件phyML3.0(http://www.atgc-montpellier.fr/phyml/)进行。
1.4 荧光定量RT-PCR
分别取长牡蛎未受精的卵, 胚胎(二细胞期, 桑葚前期, 桑葚期, 囊胚期, 原肠前期, 原肠期), 担轮幼虫, D形幼虫, 壳顶幼虫, 眼点幼虫, 稚贝和幼贝的样本, 以及成体长牡蛎各组织样本(外套膜、闭壳肌、鳃、唇瓣、消化腺、血淋巴, 精巢和卵巢), 并分别获得它们的cDNA模板。由已获得的cDNA全长序列设计长牡蛎 Wnt4基因特异性引物 Wnt4-real F(5′AAGAACGCCGCCTACCCA3′), Wnt4-real R(5′ACA GCCACAGTTGTCCAG3′)(扩增片段长度 239bp), 以18S rRNA(RS18)基因的表达量作为内参(RS18-real F:5′GCCATCAAGGGTATCGGTAGAC 3′; RS18-real R:5′CTGCCTGTTAAGGAACCAGTCAG 3′; 扩增片段长度168bp)(Duet al, 2013)。使用ABI7500 Fast荧光定量 PCR仪进行 Wnt4 基因在长牡蛎不同幼体发育阶段和成体不同组织中的定量表达分析, 每个样本做3个平行检测。荧光定量RT-PCR反应条件: 94°C 30s, 1 个循环; 94°C 5s, 60°C 30s, 40 个循环。利用溶解曲线峰的单一性和 1.5%琼脂糖凝胶电泳检测, 确保产物没有引物二聚体的影响。通过 ABI7500 Fast SDS software V2.0软件输出数据, 采用2–△△Ct法对基因的相对表达量进行分析, 使用SPSS 11.0软件进行数据统计分析。
2 结果与讨论
2.1 长牡蛎 Wnt4基因全长 cDNA序列特征和系统进化分析
Wnt蛋白是分泌性糖蛋白, 成员均为由350—380个氨基酸构成的保守蛋白, 含23—24个保守的半胱氨酸残基, 有很强的疏水性, 其合成、加工和分泌过程需要保守半胱氨酸残基的棕榈酰化、内质网Porcupine脂蛋白修饰作用和脂蛋白颗粒分子的协同完成(Bergsteinaet al, 2006)。其首个保守的半胱氨酸残基的棕榈酰化对维持Wnt蛋白的疏水性和Wnt与Frizzled间的结合作用必不可少(Mikelset al, 2006)。本研究表明, 长牡蛎Wnt4基因完整cDNA序列全长1999bp, 5′非编码区(Untranslated region, 5'UTR)466bp,3′UTR465bp, 开放阅读框(open reading frame, ORF)为1068bp, 编码355个氨基酸(图1)。长牡蛎Wnt4蛋白的理论分子质量为40.397kD, 等电点为9.12。该蛋白序列含100多个保守的Wnt4蛋白保守位点; 24个Wnt蛋白家族最重要的半胱氨酸残基, 可交联形成二硫键(图1; 图2), 同时还含有一段长为22个氨基酸的信号肽序列。
长牡蛎Wnt4蛋白序列与人(Homo sapiens), 文昌鱼(Branchiostoma floridae), 沙蚕(Platynereis dumerilii)、小头虫(Capitella teleta)、乌贼(Euprymna scolopes)和栉孔扇贝(Chlamys farreri)Wnt4蛋白的相似性分别为44%, 43%, 48%, 45%, 42%和46%(图2)。使用phyML 3.0软件构建的Wnt4蛋白序列系统进化树显示, 长牡蛎Wnt4首先与同为双壳贝类的栉孔扇贝聚为一支,之后依次与冠轮动物沙蚕和脊索动物文昌鱼聚类(图3), 表明该基因的系统进化关系与传统的物种进化地位基本一致。

图1 长牡蛎Wnt4基因完整cDNA序列与推导的氨基酸序列Fig.1 The cDNA sequence of C. gigas Wnt4 gene and the deduced amino acids sequence
2.2 长牡蛎 Wnt4基因在成体各组织及不同幼体发育阶段中的定量表达分析
荧光定量RT-PCR结果表明, 长牡蛎Wnt4mRNA在外套膜、鳃、唇瓣、消化腺、雄性性腺、雌性性腺中均有表达, 但各组织间存在差异, 在唇瓣、鳃和消化腺中的表达量相对较高, 同时在雌性性腺中的表达量高于雄性性腺(图4)。

图2 不同物种Wnt4蛋白序列多重比对分析Fig.2 Multiple alignment of Wnt4 proteins from different species
在长牡蛎个体发育过程中, 我们发现 Wnt4基因在卵(E)、二细胞期(TC)和桑葚前期(EM)几乎没有表达, 桑葚期(MS)表达量升高, 并在接下来的囊胚期(BS)出现最高表达, 约为桑葚期的 3倍(P<0.05); 原肠胚期(GS)的表达量次之, 在随后的担轮幼虫期(T1,T2)和 D形幼虫期(D1,D2,D3)表达量基本呈逐步下降的态势, 壳顶幼虫期(U1, U2, U3)至稚贝期(S1, S2,S3), 表达量相对稳定但较低, 仅为囊胚期的 20%左右, 幼贝期(J)该基因的表达量已经很低了(图5)。
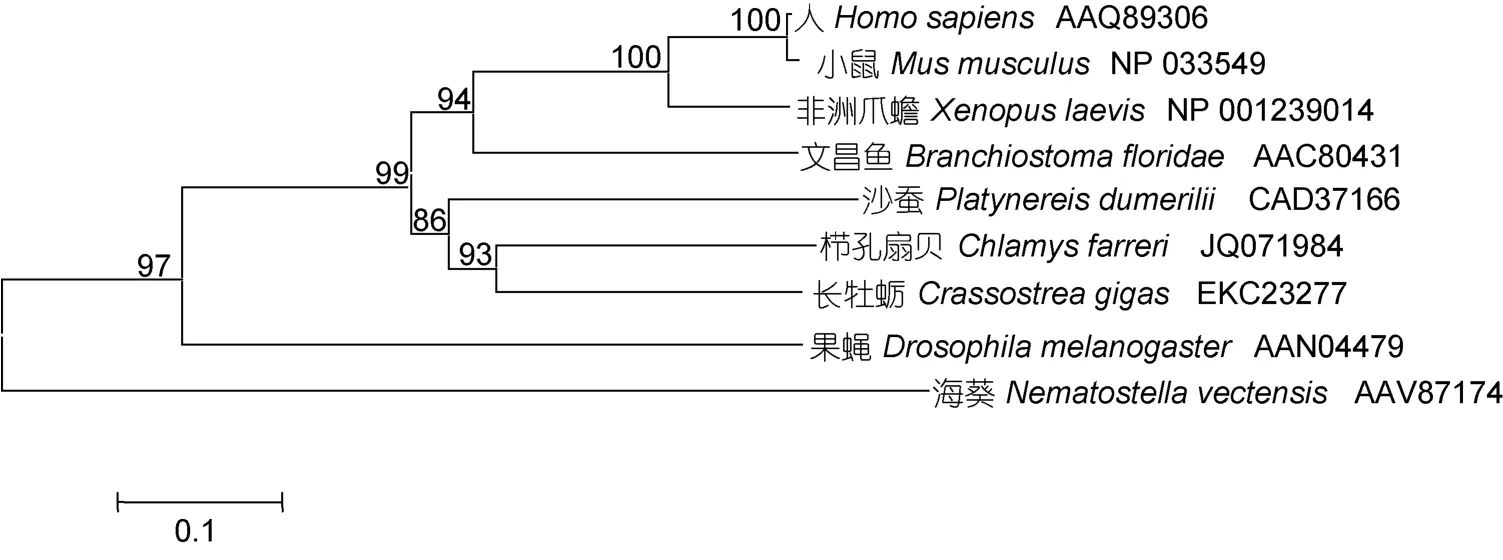
图3 基于最大似然法 (ML) 构建的长牡蛎Wnt4氨基酸序列系统进化树Fig.3 Molecular phylogenetic analysis of Wnt4amino acids sequences in C. gigas based on maximum likelyhood(ML) method

图4 长牡蛎Wnt4 基因在成体不同组织中的表达情况Fig.4 Relative expression of the Wnt4 gene in different tissues of C.gigas

图5 Wnt4 基因在长牡蛎幼虫不同发育时期的表达情况Fig.5 Relative expression of the Wnt4 gene in different developmental stages of C.gigas.
Wnt4基因参与动物体的多种生命活动。Yu等(2006)发现, 袋鼠Wnt4基因在肌肉、肝、肾、肺、精巢和卵巢组织中都有表达; 在青鳉、斑马鱼、虹鳟等鱼类中存在两种Wnt4基因, Wnt4a和Wnt4b(李建中等, 2012; Nicolet al, 2012)。虹鳟Wnt4a蛋白与人、小鼠等脊椎动物Wnt4蛋白序列同源性大于80%, 并且其mRNA在多种组织, 包括脑、鳃、肝、肌肉、皮肤、头肾、卵黄发生晚期的卵巢和Ⅱ期精巢中都有表达; 而Wnt4b蛋白与上述脊椎动物Wnt4蛋白的同源性低于 60%,仅在神经系统如脑和垂体中表达(Nicolet al, 2012)。李海龙等(2013)通过半定量RT-PCR表明,栉孔扇贝的Wnt4 mRNA在外套膜、闭壳肌、鳃、肝胰腺、精巢和卵巢组织中均有表达, 但表达量较低。与已有研究的结果类似, 长牡蛎 Wnt4基因也具有广泛的组织表达特点, 在所检测的多种组织(外套膜、鳃、唇瓣、消化腺、雄性性腺、雌性性腺)中均有表达, 但最高表达水平仅为发育过程中囊胚期表达水平的17%左右(图4), 所以我们推测长牡蛎的Wnt4基因可能也以信号分子的形式参与多种组织细胞的生命过程。
之前的研究表明, Wnt4基因与多种动物的性别决定和性别分化紧密相关(Bernardet al, 2007)。小鼠Wnt4mRNA在性别决定之前的性腺中均存在表达,性别决定之后, 在卵巢中仍持续表达,但精巢中的表达特异性地下调(Barrionuevoet al, 2006)。Wnt4 基因在牙鲆雌雄鱼各组织中广泛表达, 有卵巢强于精巢1.5倍的性别二态性, 并在幼鱼性腺分化期起到了一定的作用(翁申达, 2012)。本实验中, 长牡蛎Wnt4mRNA在成体的成熟期两性性腺中亦均有表达, 同时雌性性腺的表达量是雄性性腺的1.2倍。而栉孔扇贝的研究发现, Wnt4基因在扇贝不同发育时期的性腺中均有表达, 在成熟期性腺中的表达量最高, 而且成熟期精巢的表达量约为同时期卵巢表达量的两倍(李海龙等, 2013)。同时, 在某些非哺乳动物如海龟和蛙中,Wnt4 基因在性腺分化中却没有性别表达差异(Yukiet al, 2005), 因此关于 Wnt4基因在多种动物雌雄个体间的差异表达并不具有保守性, 在不同物种中的功能以及在进化中的变异有待深入研究。虽然, 长牡蛎Wnt4mRNA在雌性性腺中的表达量高于雄性性腺,但在其个体发育过程中, 在卵里并未检测到该基因的表达, 暗示该基因可能参与两性性腺的发育并在性腺的其他组织细胞类型中发挥作用。
长牡蛎中Wnt4基因的高表达主要集中在胚胎发育的早期, 早期胚胎发育是个体形成不可逾越的初始阶段, 又是组织器官形成的基础, 该基因可能在早期发育阶段参与了某些器官的形成。Wnt4基因在哺乳动物胚胎发育过程中,参与很多器官及系统的发育,例如肾脏、肾上腺、乳腺和生殖系统的形成(Bernardet al, 2007)。长牡蛎Wnt信号通路的其它关键成员, Frizzled,glycogen synthase kinase 3β(GSK-3β), Dishevelled, βcatenin和T-cell factor (TCF)等基因也主要在胚胎发育的早期进行表达(Yanget al, 2014), 而动物在早期发育过程中, 体轴极性的建立乃至整个体轴的形成,都需要这类表达于胚胎发育早期的基因的参与(钱光辉等, 2011)。
3 结语
Wnt4基因是Wnt基因家族的重要成员之一, 在动物的早期发育和器官发生过程中都发挥着重要的作用。长牡蛎的Wnt4基因具有广泛的组织表达特点,在所检测的多种组织中均有表达, 推测长牡蛎的Wnt4蛋白会以信号分子的形式参与多种组织细胞的生命过程。长牡蛎中Wnt4基因的高表达主要集中在胚胎发育的早期, 作为研究得较为充分的双壳贝类,长牡蛎的个体发育涉及到复杂的形态和生理学转变,该基因可能在早期发育阶段参与了某些器官的形成。
王如才, 王昭萍, 2008. 海水贝类养殖学. 青岛: 中国海洋大学出版社, 116—140
尹定子, 宋海云, 2011. Wnt信号通路: 调控机理和生物学意义.中国细胞生物学学报, 33(2): 103—111
向阳, 高基民, 胡志明等, 2007. Wnt基因的类别及功能. 生命的化学, 27(2): 138—141
李建中, 刘琼, 王德寿等, 2012.日本青Wnt4基因的克隆与鉴定. 水生生物学报, 36(5): 983—986
李海龙, 刘建国, 刘晓玲等, 2013. 栉孔扇贝Wnt4基因cDNA克隆及表达分析. 中国水产科学, 20(2): 260—268
翁申达,2013. 牙鲆相关性别基因的克隆与表达分析. 青岛:中国科学院海洋研究所硕士学位论文, 63
钱光辉, 王义权, 2011. Wnt信号通路与后口动物体轴的进化发育. 遗传, 33(7): 684—694
陶丽红, 姚利晓, 傅志强等, 2007. 日本血吸虫信号转导蛋白Sjwnt-4基因的克隆、表达及功能分析. 生物工程学报,23(3): 392—397
韩琳, 冯新港, 2008. Wnt信号通路及其在动物生长发育过程中的作用. 中国兽医寄生虫病, 16(3): 47—52
Banziger C, Soldini D, Schutt Cet al, 2006. Wntless, a conserved membrane protein dedicated to the secretion of Wnt proteins from signaling cells. Cell, 125(3): 509—522
Barrionuevo F, Bagheri-Fam S, Klattig Jet al, 2006.Homozygous inactivation of Sox9 causes complete XY sex reversal in mice. Biology of Reproduction, 74(1): 195—201
Bergsteina I, Eisenbergb L M, Bhaleraoc Jet al, 1997. Isolation of two novel WNT genes, WNT14 and WNT15, one of which (WNT15) is closely linked to WNT3 on human chromosome 17q21. Genomics, 46(3): 450—458
Bernard P, Harley V R, 2007. Wnt4 action in gonadal development and sex determination. International journal of biochemistry & cell biology, 39(1): 31—43
Du Y S, Zhang L L, Xu Fet al, 2013. Validation of housekeeping genes as internal controls for studyinggene expression during Pacific oyster (Crassostreagigas) development by quantitative real-time PCR. Fish and Shellfish Immunology,34(3): 939—945
Hedgecock D, Gaffney P M, Goulletquer Pet al, 2005. The case for sequencing the Pacific oyster genome. Journal of Shellfish Research, 24(2): 429—441
Klaus A, Birchmeier W, 2008. Wntsignalling and its impact on development and cancer. Nature Reviews Cancer, 8(5):387—398
McElroy M D, Elrefaei M, Jones Net al, 2006. Coinfection withSchistosomamansoniis associated with decreased HIVSpecific cytolysis and increased IL-10 production. Journal of Immunology, 174(8): 5119—5123
Mikels A J, Nusse R, 2006. Wnts as ligands: processing,secretion and reception. Oncogene, 25: 7461—7468
Nicol B, Guerin A, Fostier Aet al, 2012. Ovary-predominant wnt4 expression during gonadal differentiation is not conserved in the rainbow trout (Oncorhynchus mykiss).Molecular Reproduction and Development, 79(1): 51—63
Nusse R, Varmus H E, 1982. Many tumors induced by the mouse mammary tumor virus contain a provious integrated in the same region of the host genome. Cell, 31(1): 99—109
Nusse R, Varmus H E, 1992. Wnt genes. Cell, 69(7): 1073—1087
Oshima Y, Hayashi T, Tokunaga Set al, 2005. Wnt4 Expression in the differentiating gonad of the frogRana rugosa.Zoological Science, 22(6): 689—693
Parr B A, McMahon A P, 1994. Wnt genes and vertebrate development. Current Opinion in Genetics & Development,4(4): 523—528
Sato M, Umetsu D, Murakami Set al, 2006. DWnt4 regulates thedorsoventral specificity of retinal projections in theDrosophilamelanogastervisual system. Nature Neuroscience,9(1): 67—74
Smolich B D, McMahon J A, McMahon A Pet al, 1993.Wnt family proteins are secreted and associated with the cell surface. Molecular Biology of The Cell, 4(12): 1267—1275
Ungar A R, Kelly G M, Moon R T, 1995. Wnt4 affects morphogenesis when misexpressed in the zebrafish embryo.Mechanism of Development, 52(2—3): 153—164
Yang M, Xu F, Liu Jet al, 2015 Identification and expression patterns of Wnt signaling pathway-related genes inCrassostrea gigas. Unpublished
Yu H S, Pask A J, Shaw Get al, 2006. Differential expression of Wnt4 in testicular and ovarian development in a marsupial.BMC Developmental Biology, 6(44): 1—13
Yuki O, Toshiyuki H, Shuichi Tet al, 2005. Wnt4 expression in the differentiating gonad of the frog Rana rugosa. Zoological Science, 22(6): 689—693
