山羊传染性胸膜肺炎的实验室诊断
2015-04-10莫昌院李玉武杨雪贞程振涛
莫昌院,覃 岚,孟 姣,李玉武,杨雪贞,程振涛
(贵州大学动物科学学院,贵州 贵阳 550025)
羊传染性胸膜肺炎(Contagious caprine pleuropneumonia,CCPP)是山羊的高度接触性传染病,被国际兽疫局列为B类动物疫病,临床上以高热、卡他性鼻液、咳嗽、眼结膜炎、呼吸道啰音、纤维素性胸膜炎以及部分母羊流产、进行性消瘦为主要特点[1]。国内外研究结果表明,引起山羊传染性胸膜肺炎的支原体有多种,我国羊传染性胸膜肺炎病原主要为丝状支原体山羊亚种(Mmc)和绵羊肺炎支原体(Mo)[2],其中较早资料多认为病原为 Mmc,但近年来全国各地不断报道Mo引起的CCPP病例,且呈逐年上升趋势。1999年,贵州省也曾报道CCPP病例的发生,且病原为 Mmc[3]。2010年,贵州省首次报道发病山羊组织中分离到Mo菌株[4]。因临床上2种病原感染所致症状很难区分,最终诊断尚需实验室检测。
1 材料与方法
1.1 病料与菌株 临床病例材料采自贵州省开阳县某养殖场;丝状支原体山羊亚种标准株(PG3)、绵羊肺炎支原体标准株Y98均由贵州大学预防兽医学实验室提供。
1.2 试剂 DNA提取试剂盒、PCR扩增试剂购自宝生物(大连)科技有限公司;支原体肉汤培养基购自青岛高科园海博生物技术有限公司;其余试剂均为国产分析纯。
1.3 病原分离培养与初步鉴定
1.3.1 培养基制备:(1)液体培养基:取支原体肉汤培养基2.752 g,蒸馏水80 mL加热溶解,调pH值至7.4 ~7.6,分装试管(4 mL/支),121 ℃高温高压灭菌30 min后,每支试管加入马血清(终浓度200 mL/L)、10%醋酸铊(终浓度20 mL/L)、青霉素(终浓度200 IU/mL)。(2)固体培养基:取支原体肉汤培养基2.752 g、琼脂粉1 g、蒸馏水80 mL加热溶解,调 pH 值至7.4~7.6,121℃高温高压灭菌30 min后,待冷却至70℃左右加入马血清(终浓度200 mL/L)、10%醋酸铊(终浓度20 mL/L)、青霉素(终浓度200 IU/mL),混匀,无菌分装平皿。以上培养基4℃保存备用。
1.3.2 病原分离培养:无菌采集病羊肺组织,用剪刀剪碎后放入液体培养基内,37℃、5%CO2环境中培养 3~7 d,待培养基颜色变化后,用0.45 μm微孔滤器过滤,进行传代培养,同时接种固体培养基,每隔2~3 d观察1次,待出现单个菌落,挑取接种于液体培养基培养。如此连续传代纯化3次以上。
1.3.3 形态学鉴定:将纯化的菌株接种固体培养基,37℃培养3~7 d观察生长状况,至出现针尖大小透明菌落,置低倍显微镜下观察菌落形态,并拍照记录。
1.3.4 生化鉴定:按照OIE提供的生化试验方法,对分离纯化的菌株进行细菌L型还原试验合格后,作发酵葡萄糖、水解精氨酸、分解尿素、分解甘露醇、四氮唑还原试验,同时以Mmc标准株PG3、绵羊肺炎支原体标准株Y98作对照。
1.4 病原核酸PCR检测
1.4.1 引物设计与合成:参照GenBank Mo标准菌株16S rRNA基因序列(登录号:NR-025989),设计合成特异性引物Mo1/Mo2(见表1),送上海捷瑞生物工程有限公司合成。

表1 Mo 16S rRNA基因引物序列
1.4.2 病原核酸检测:取支原体液体培养物应用DNA提取试剂盒提取所需DNA样本。以引物Mo1/Mo2对所提DNA进行PCR扩增,建立50.0 μL体系:10 ×buffer(含 Mg2+)5 μL,dNTP(10 mmol/L)1 μL,Taq DNA 聚合酶(2.5 U/μL)1 μL,引物Mo1/Mo4(10 μmol/L)各1 μL,DNA 模板3 μL,灭菌ddH2O补足。扩增条件为:94℃预变性3 min;94 ℃变性45 s,53 ℃退火40 s,72 ℃延伸1.5 min,共34个循环。最后72℃延伸10 min。在凝胶成像仪上观察结果。

图1 菌落形态
2.2 生化试验鉴定结果 见表2。
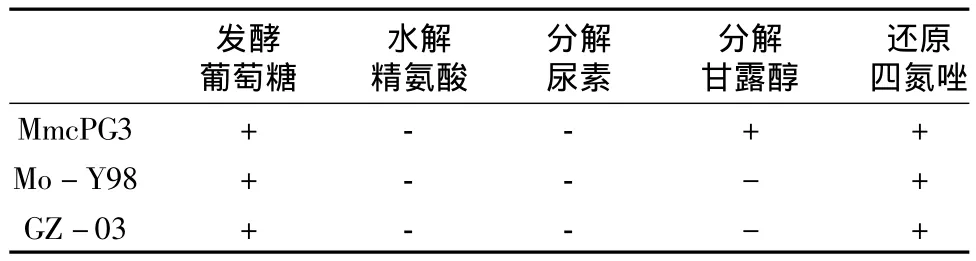
表2 生化鉴定结果
由表2可见,本试验支原体分离株生化试验结果与绵羊肺炎支原体标准株Y98完全相同,而与Mmc标准株存在差异。
2.3 PCR鉴定结果 初步确定分离株为Mo后,为进一步确定支原体分离株分类地位,用PCR方法对支原体分离培养物进行鉴定,以标准菌株16S rRNA基因特异性引物对分离株及标准菌株进行PCR扩增,1%琼脂糖凝胶电泳检测,结果见图2。由图2可见,支原体分离株可扩增出与Mo标准株大小一致的1 149 bp目的条带,进一步确定所分离支原体确为Mo。
2 结果
2.1 病原分离与形态观察 液体培养基颜色由红色变为黄色;经固体培养基培养5 d后,低倍镜观察,可见分离菌株菌落不呈典型的支原体“油煎蛋”状,而呈圆形凸起,无中心脐。见图1。
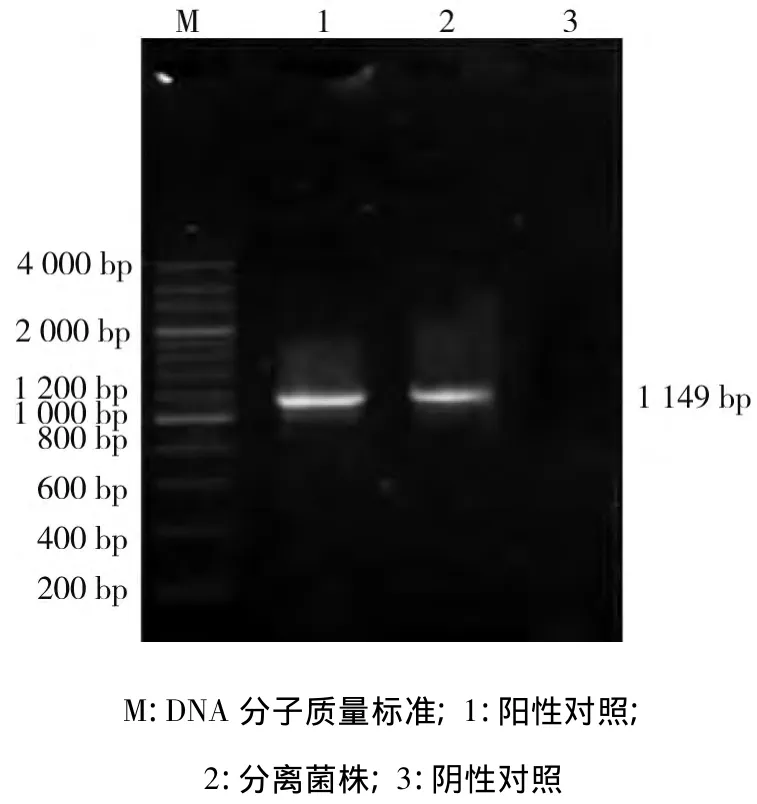
图2 支原体分离株PCR鉴定
3 结论与讨论
3.1 我国自20世纪40年代在甘肃有本病报道后,内蒙古、四川、河北、云南、江西等地相继有临床病例报道[5,6]。王栋等[7]对中国兽医药品监察所保存的CCPP病原进行了鉴定,结果发现这些病原在形态特征、培养特性、生化特性和血清学反应方面均与丝状支原体山羊亚种(Mmc)国际模式株PG3一致,因而认为引起我国CCPP的病原应该是Mmc。而后国内研究者先后从甘肃、辽宁等地分离到致病性绵羊肺炎支原体(Mo)[8]。统计数据显示,Mmc和Mo为山羊传染性胸膜肺炎的主要病原。在贵州,万一元等[9]2001年于罗甸等地分离到 Mmc,2011 年张双翔等[4]首次分离到Mo。本试验结果显示,绵羊肺炎支原体感染病例在我省山羊病例中持续存在,且存在区域扩大趋势。
3.2 目前,我国对CCPP病原鉴定工作多基于分离培养技术及生化试验,但存在诸多困难,一是支原体个体微小,生物合成代谢能力有限,营养要求高,人工培养增殖难度较大,致使其分离培养也十分困难;二是仅通过传统的形态学、生化鉴定等方法难以准确确定支原体分类地位。随着分子生物学技术的出现与发展,现代分子生物学成为鉴定支原体的有效手段[10]。本试验通过形态学观察、生化试验特性等传统方法对分离菌株进行初步鉴定,结果显示,分离株与绵羊肺炎支原体模式株Y98相符,与丝状支原体山羊亚种模式株PG3存在差异,初步判定分离株为Mo,命名为 Mo-GZ-03。研究资料表明,16S rRNA基因序列分析是鉴定支原体种属的一个可靠方法[11]。综合分离株的菌落形态、生化试验特点以及PCR检测结果,可证明本次疫情病原分离株为绵羊肺炎支原体,为疫情的有效控制提供了理论依据。
[1] Manual of Diagnostic Tests and Vaccines for Terrestrial Animals,4th edition,2004.
[2] 邓光明.类山羊传染性胸膜肺炎诊断和防治的研究[J].中国兽医科技,1991,21(6):6 ~9.
[3] 万晴姣.山羊传染性胸膜肺炎病原的生化鉴定[J].贵州畜牧兽医,1999,(5):22 ~23.
[4] 张双翔,周碧君,姜汉雯,等.山羊传染性胸膜肺炎继发大肠埃希氏菌感染的诊断[J].贵州农业科学,2011,39(6):144 ~146.
[5] 汪代华,徐刚毅.山羊传染性胸膜肺炎的流行现状和防制技术[J].四川畜牧兽医,2005,32(10):48 ~49.
[6] 褚岳峰,赵萍,高鹏程,等.羊霉形体与霉形体病[J].安徽农业科学,2008,36(19):8 106 ~8 109.
[7] 王栋,张瑞亭.我国山羊传染性胸膜肺炎病原的研究[J].中国兽医科技,1988,(9):4 ~7.
[8] 邓光明,赵煊,梁桂香,等.类山羊传染性胸膜肺炎诊断和防治的研究—病原诊断[J].中国兽医科技,1991,(6):5 ~9.
[9] 万一元,龙鳌,万晴姣,等.贵州山羊传染性胸膜肺炎病原的分离鉴定[J].中国草食动物,2001,3(4):44~46.
[10] Taylor T K,Bashiruddin J B.Relationship between members of the Mycuplasma mycoides cluster as shown by DNA probes and sequence analysis[J].Int J Syst Bactirol,1992,42(4):593 ~601.
[11] 郭晗,褚岳峰,赵萍,等.山羊支原体山羊肺炎亚种甘肃株的分离及鉴定[J].中国兽医学报,2011,31(3):352~356.
