空心莲子草铵转运体Ap AMT1;3 基因的 克隆及功能鉴定
2015-04-08宋志忠杨顺瑛郝东利岳光振苏彦华
宋志忠,杨顺瑛,郝东利,岳光振,苏彦华
(1.中国科学院南京土壤研究所 土壤与农业可持续发展国家重点实验室,江苏 南京210008;2.江苏省农业科学院园艺研究所,江苏 南京210014;3.中国科学院大学,北京100049)
氮是植物生长发育最关键的矿质营养元素之一,其占植物干重的1%~5%。氮素是蛋白质、核酸和核蛋白的重要组成成分,也是叶绿素的主要成分,从而影响光合作用[1-2]。在土壤尤其是淹水条件下,铵是主要的无机氮存在形式[3-4]。无论是在土壤还是在水体中,铵是植物优先吸收的氮素营养[5-6],而过量的铵会对植物的正常生长造成毒害[7]。
铵吸收主要由整合在细胞膜上的特定的铵转运体(A MT)完成。近年来,铵转运体已经在多种生物中如细菌、真菌、藻类、植物和动物中得以鉴定。铵转运体主要分为A MT1 及A MT2 两大亚家族[8]。部分AMT1家族的成员,如拟南芥(Arabidopsis thaliana)中 的At AMT1;1、At AMT1;2 和At AMT1;3[6,9],欧洲油菜(Brassica napus)中的Bn AMT1;2[10],百脉根中(Lotus j aponicus)的Lj AMT1;1、Lj AMT1;2 及Lj AMT1;3[11-12],番 茄(Lycopersicon esculentum)中 的Le AMT1;1、Le AMT1;2 及Le AMT1;3[13-14],杨 树(Populus trichocarpa)中 的Pt AMT1;2、Pt AMT1;5、Pt AMT1;6、Pt AMT2;1 和Pt AMT2;2[15],以 及 水 稻(Or yza sativa)中的Os A MT1;1、Os AMT1;2、Os-A MT1;3和Os A MT2;1[16-17],其功能都在酵母或蛙卵中得以鉴定。
在拟南芥中,At AMT1;1、At AMT1;2、At AMT1;5及At AMT2;1 主要在根部和地上部表达,而At AMT1;3 和At AMT1;4 则分别在根部和花粉特异表 达[2,9,18]。在 氮 饥 饿 条 件 下,At AMT1;1 及At AMT1;3 表达丰度增加[6,19],T-DNA插入突变体研究表明,At A MT1;1 和At AMT1;3 双突变使得的吸收相对于野生型下降了约70%[20],表明在高亲和的条件下,At A MT1;1 和At A MT1;3 对的吸收起到了非常重要的作用。此外,番茄和百脉根中AMT1亚家族成员的表达特征也得到了研究[11-13,21]。
空心莲子草(Alter nanther a philoxeroides)是一种水生杂草,因其繁殖速度快及富钾能力强而闻名[22],对极端条件尤其是受氮严重污染的水体或海岸带有超强的适应能力,对日益富营养化的水体有潜在的修复能力。然而,对其铵吸收及转运系统的研究甚少。本研究通过RACE 克隆技术从空心莲子草中分离了一个铵转运体Ap AMT1;3,利用半定量PCR 及定量PCR 对其表达特征进行分析,并通过异源酵母功能互补对其功能进行验证以期为探索空心莲子草铵的吸收反馈调控机制及在富营养化水体植物修复方面奠定理论基础。
1 材料与方法
1.1 材料和试剂
空心莲子草采自南京玄武湖畔,用1/4 MS营养液[23]培养繁殖于温室中。试验用苗在1/4 MS营养液中添加1 mmol·L-1NH4Cl培养,缺铵处理条件不添加NH4Cl。温室条件为16 h 光照/8 h 黑暗,温度为光照条件下28℃,黑暗条件下23℃,每两天更换一次营养液。酵母试剂中的克隆载体p MD19-T购自Ta Ka Ra公司,酵母表达载体p YES2购自Invitrogen 公司。YNB 培养基(Yeast Nitr ogen Base w/o Ammoniu m Sulfate and Amino Acids,本研究所用YNB 培养基均不含硫酸铵和氨基酸)购于Difco公司,D-半乳糖、精氨酸、氯化铵和甲基胺(Methylammoniu m,Me A+)购于Sig ma公司,PCR 扩增高保真酶Pri meSTAR®购自Ta Ka Ra公司,T4DNA 连接酶、限制性核酸内切酶KpnⅠ和NotⅠ购于New England Biolabs公司,引物由上海英骏生物技术有限公司合成。
1.2 RNA 提取及第一链c DNA合成
普通的分子生物学操作方案参照文献[24]。利用RNAiso Plus Kit(Ta Ka Ra,Kyoto,Japan)分离纯化总RNA。第一条单链c DNA 的合成参照the Pri mescript 1st Strand c DNA Synt hesis Kit(Ta Ka-Ra),用于扩增保守区或基因全长CDS的模板。
1.3 AMT1;3全长c DNA 的克隆
通过生物信息学分析,以At A MT1;1氨基酸序列为参考序列,在NCBI上通过Blast P 比对,检索到已报道植物A MT 成员的氨基酸序列,然后通过氨基酸序列比对,选定植物A MT 氨基酸水平的高度保守区,设计简并引物对(表1),通过PCR 扩增保守区片段,获得1 条640 bp 的保守区扩增产物(图1 A)。经测序验证及编码产物比对为A MT 的保守区,分别设计序列特异性引物(表1),用于3′-RACE或5′-RACE扩增。
3′和5′RACE 克隆过程参照文献[22]。末端RACE 克隆所需的模板按照SMARTerTMRACE c DNA Amplification Kit(BD Biosciences Clontech)试剂盒操作:以1μg 总RNA 为 模 板,以3′-(5′-)CDS Pri mer A 为锚定引物,通过反转录获得3′-(5′-)RACE-ready first-strand c DNA。根据上述保守区设计的特异性引物GSPs,通过巢式PCR 进行RACE扩增:第一轮,以3′-(5′-)RACE-ready firststrand c DNA 为模板,UPM/GSPout为引物对扩增;第二轮,以第一轮产物为模板,以NUP/GSPin为模板进行扩增,分别获得3′-端RACE的1 520 bp(图1B)和5′-端RACE 的1 200 bp的特异性片段(图1C),连接p GEM-T 载体送北京华大基因测序公司测序。测序验证后,拼接获得A MT1;3 基因的全长c DNA,通过DNAstar软件寻找其ORF,并在NCBI通过Blast P比对,明确其编码产物为铵离子转运体蛋白。根据基因ORF 序列设计上下游引物,扩增获得1条1 389 bp的目的片段(图1D)。

表1 Ap AMT1;3 全长c DNA克隆及q RT-PCR引物Table 1 Primer pairs used f or c DNA cloning and q RT-PCR of Ap AMT1;3
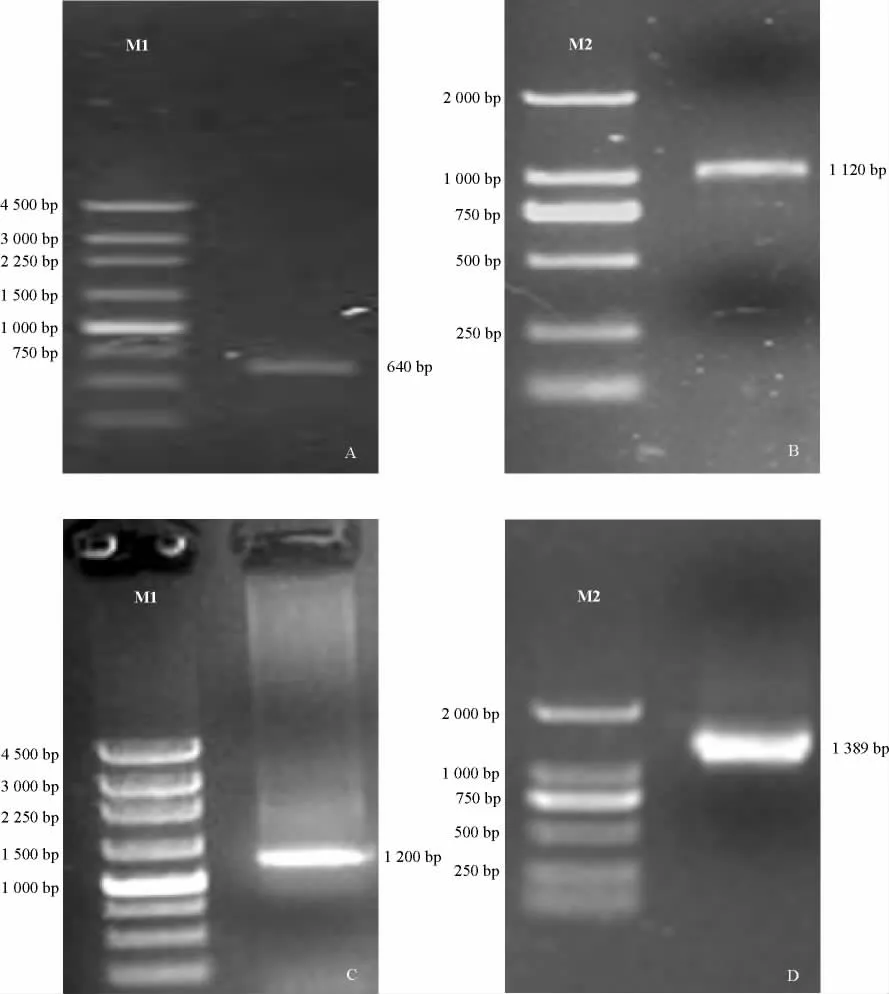
图1 Ap AMT1;3 末端RACE及全长ORF克隆Fig.1 RACE cloning and f ull-length open reading frame amplification of Ap AMT1;3
1.4 q RT-PCR分析
通 过NCBI/Pri mer-BLAST 在 线 服 务 器 设 计Ap AMT1;3 基因的特异性表达引物,以水稻Actin基因作为内参(引物序列见表1),由上海Invitrogen生物公司合成。q RT-PCR 在Light Cycler 480Ⅱ(Roche)实时定量PCR 仪进行,荧光染料使用SYBR Green(Ta Ka Ra,大 连)。反应程序为:95℃,35 s,1个循环;95 ℃,5 s,59 ℃,35 s,38 个 循环;72 ℃,15 s,1 个 循 环。定 量PCR 的 表 达 量 用相对表达量表示,通过2-△Ct法来计算。试验设3个生物重复。
1.5 进化树分析
利用在线软件CLUSTAL W(http://www.ebi.ac.uk/Tools/msa/clustal w2/)的Neighbor-joining 方法及通过对植物A MT 蛋白的多重序列比对构建进化树。用于构建进化树的A MT1家族成员在NCBI网站上通过BLAST 已报道A MT1 成员的氨基酸序列获得。Ap A MT1;3 跨膜结构域通过TMHMM(http://www.CBS.dk)和HMMTOP(http://www.enzim.hu/hmmtop/server/hmmtop.cgi)在 线 软 件 预测完成。
1.6 p YES2-Ap AMT1;3 表达载体构建
设计构建p YES2-Ap A MT1;3 表达载体的引物(表1),上游引物引入KpnⅠ酶切位点,下游引物引入SalⅠ酶切位点,由上海Invitrogen 生物公司合成。扩增产物通过KpnⅠ/SalⅠ(TOYOBO,上海)双酶切作用后,利用T4DNA 连接酶(New England Biolabs,美国)克隆到同样双酶切的p PAB404载体质粒多克隆位点中,转化大肠杆菌感受态细胞,挑选阳性克隆并经酶切验证正确后,送去测序再次验证其序列正确。
1.7 酵母功能互补
通过电转化方法将空载体p YES2及重组载体p YES2-Ap AMT1;3 转 入 酵 母 菌 株31019b(MATa meplΔmep2Δ::LEU2 mep3Δ::Kan MX2 ura3)[25]。电击后加入1 mL预冷的1 mol·L-1山梨醇,30 ℃温育2 h,于酵母选择性培养基(0.17% YNB +2 mmol·L-1精氨酸+2% D-半乳糖+2%琼脂)平板上30 ℃黑暗培养3 d;挑取单菌落在酵母液体选择培养基中30 ℃震荡培养36 h,经PCR 鉴定为阳性的 单 菌 落 即 为 重 组 酵 母p YES2-Ap A MT1;3/31019b。重组酵母菌株在YNB 液体选择性培养基上 培 养 至OD600至1.0,经10 倍 梯 度 稀 释 成10-1、10-2、10-33个浓度,分别取4个浓度梯度的菌液5 μL 点 样 于 以2 mmol·L-1精 氨 酸 或2 mmol·L-1NH4Cl为唯一氮源、p H 为5.8的固体培养基(0.17% YNB+2% D-半乳糖+2%琼脂)上,于30 ℃黑暗培养,观察菌落生长状况并拍照。转空载体pYES2 的31019b 酵 母p YES2/31019b为对照[26]。
1.8 统计和作图
试验数据通过SPSS 13.0 软件统计分析(SPSS,Chicago,IL,USA),用Origin 8.0 软件作图,所有图表都通过Adobe Photoshop 7.0整理。
2 结果与分析
2.1 空心莲子草Ap AMT1;3 基因的克隆
铵转运是氮代谢的一个关键过程,而铵的吸收和转运由特定的铵转运体完成[21]。为了进一步了解空心莲子草铵吸收和转运的分子基础,本研究利用RACE技术成功获得了空心莲子草Ap AMT1;3 的全长c DNA 序列(GenBank Accession No.JQ917908),克隆过程如图1所示,具体描述见1.3。
2.2 Ap AMT1;3 基因的特征分析
Ap AMT1;3 基因CDS大小为1 389 bp,蛋白分子质量为50.00 k D,跨膜预测软件T MH MM 和H MMTOP分析表明,Ap A MT1;3 有11个跨膜区(图2),和已经报道的A MT1 型的铵转运体类似[15,21,27]。进化 树 分 析 表 明,Ap A MT1;3 属 于 植物A MT1 家族的成员,在进化关系上与番茄Le AMT1;3 紧密聚类在一起(图3),预示其具有相似的基因功能或表达模式。基因结构克隆结果表明,Ap AMT1;3 的基因组序列中没有内含子结构,这和除百脉根Lj AMT1;1[11]以外的其他的AMT1型家族成员的情况一致。
2.3 Ap AMT1;3 的表达分析
实时定量PCR 结果表明,Ap A MT1;3 主要在地上部表达(图4),在茎和叶中的表达丰度明显高于根中的表达丰度。AMT1 基因的表达丰度与植物的氮素营养状态密切相关,在缺铵条件下,无论在地上部还是地下部,Ap AMT1;3 的表达丰度都大大增强(图4B),表明铵饥饿大大增强了Ap A MT1;3在整个植株体内的表达丰度。
2.4 Ap AMT1;3 的酵母功能鉴定
酵母菌株31019b 能够在小于5 mmol·L-1作为唯一氮源的培养基中生长[28]。重组p YES2-Ap AMT1;3/31019b菌株和转化空载体的菌株p YES2/31019b都能够在酵母选择性培养基(0.17%YNB+2 mmol·L-1精氨酸+2% D-半乳糖+2%琼脂)上正常生长(图5 A),而在2 mmol·L-1NH4Cl为唯一氮源、p H 为5.8的筛选培养基(0.17% YNB+2%D-半乳糖+2%琼脂)上,只有重组菌株p YES2-Ap AMT1;3/31019b能够恢复生长,转化空载体的菌株不能生长(图5B),表明Ap AMT1;3 具有吸收铵的功能,能够介导铵的吸收。

图2 已报道植物Ap AMT1;3的氨基酸比对及跨膜区分析Fig.2 Tr ansmembrane domain analysis of Ap AMT1;3
3 讨论与结论
空心莲子草,通称水花生,苋科(Amarant haceae)莲子草属(Alter nanther a)多年生宿根草本植物,是一种外来杂草,生长迅速、抗逆性强,适应于水生和陆生环境[28]。虽然对生态环境有负面影响,然而,由于空心莲子草在饲料、绿肥、中药、食用菌培养料有着重要的利用价值[29-30]及其超强的富钾能力而受到重视[31]。研究报道,空心莲子草种植对污水中N、P 和Cl等有较好的净化效果,也能有效降低COD,对悬浮物也有一定去除效果[32]。是水体中要的N 素存在形式[33],为了深入研究空心莲子草在修复N 污染水体方面的潜力,本研究通过RACE技术从空心莲子草中成功克隆了一个铵转运体(图1D),具有11 个跨膜区(图2),且不含内含子。进化树分析表明,该铵转运体归类于A MT1亚家族,命名为Ap A MT1;3(图3)。酵母功能互补研究表明,Ap AMT1;3 能够介导铵的吸收(图5B)。
已有报道表明,拟南芥的At AMT1;3,番茄的LeAMT1;1 及LeAMT1;2 主 要 定 位 在 根 部[6,11-12]。而Ap AMT1;3 主要在地上部表达(图4 A),与番茄的Le AMT1;3 及 百 脉 根 的Lj AMT1;1-1;3 类似[12-13,21],这种相似的表达模式也反映出其与在进化关系上与番茄Le AMT1;3 聚类密切(图3)。Ap AMT1;3也存在于根部,表明除具有铵吸收功能以外,可能还具有将铵从地下部运至地上部调配体内铵的能力及运输光呼吸产生的NH3的能力。A MT1家族基因的转录水平与植物的氮素营养状态紧密相关,铵饥饿极大增强了Ap A MT1;3在整个植株体内的表达水平(图4B),这有可能是空心莲子草在氮素营养缺乏条件下产生“饥饿响应”以适应内部代谢机制的一个线索,与拟南芥、百脉根等有着类似的响应模式[12,20-21]。
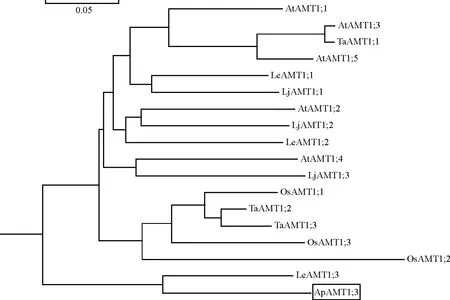
图3 Ap AMT1;3与其他植物AMT1家族成员的进化树分析Fig.3 Phylogenetic tree analysis bet ween Ap AMT1;3 and other AMT1 f amily members f ound in plants
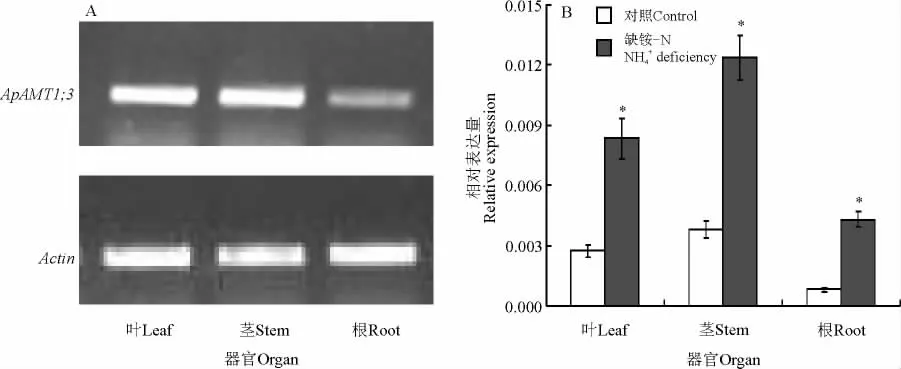
图4 Ap AMT1;3 的表达分析Fig.4 Expression analysis of Ap AMT1;3

图5 Ap AMT1;3 的酵母功能互补验证Fig.5 Yeast functional complementation test of Ap AMT1;3
本研究为分析空心莲子草NH4+的吸收和利用提供了新的基因资源,将有助于进一步了解水生植物的铵吸收和转运机制,也为富营养化水体的植物修复提供一些分子层面的理论支持。
[1] Aerts R,Chapin F S.The mineral nutrition of wild plants revisited:A re-evaluation of processes and patter ns[J].Advances in Ecological Research,1999,30:1-67.
[2] Ludewig U,Neuhauser B,Dynowski M.Molecular mechanisms of ammoniu m transport and accu mulation in plants[J].FEBS Letters Plant Transporters and Channels,2007,581:2301-2308.
[3] Bloom A J,Sukrapanna S S,Warner R L.Root respiration associated with ammonium and nitrate absorption and assi milation by barley[J].Plant Physiology,1992,99:1294-13011.
[4] Kronzucker H J,Siddiqi M Y,Glass A D M.Root discri mination against soil nitrate and the ecology of forest succession[J].Nature,1997,385:59-61.
[5] Dortch Q.The interaction bet ween ammoniu m and nitrate uptake in phytoplankton[J].Marine Ecology Progress Series,1990,61:183-202.
[6] Gazzarrini S,Lejay L,Gojon A,Ninnemann O,Fro mmer W B.Three f unctional transporters f or constitutive,diur nally regulated and starvation-induced uptake of ammoniu m into Ar abidopsis roots[J].Plant Cell,1999,11:937-947.
[7] Britto D T,Kronzucker H J.NH4+toxicity in higher plants:A critical review[J].Jour nal of Plant Physiology,2002,159:567-584.
[8] Guether M,Neuhäuser B,Balestrini R,Dynowski M,Ludewig U,Bonfante P.A mycorrhizal-specific ammonium transporter from Lotus j aponicus acquires nitrogen released by arbuscular mycorrhizal fungi[J].Plant Physiology,2009,150:73-83.
[9] Ninnemann O,Jauniaux J C,Fro mmer W B.Identification of a high affinity NH4+transporter fro m plants[J].The EMBO Jour nal,1994,13:3464-3471.
[10] Pearson J N,Finnemann J,Schjoerring J K.Regulation of the high-affinity ammoniu m transporter(Bn AMT1;2)in the leaves of Br assica napus by nitrogen status[J].Plant Molecular Biology,2002,49:483-490.
[11] Salvemini F,Marini A M,Riccio A,Patriarca E J,Chiurazzi M.Functional characterization of an ammonium transporter gene fro m Lotus j aponicus[J].Gene,2001,270:237-243.
[12] D’Apuzzo E,Rogato A,Si mon-Rosin U,El Alaoui H,Barbulova A,Betti M,Di mou M,Katinakis P,Marquez A,Marini A M,Udvardi M K,Chiurazzi M.Characterization of three f unctional high-affinity ammoniu m transporters in Lotus j aponicus with differential transcriptional regulation and spatial expression[J].Plant Physiology,2004,134:1763-1774.
[13] Lauter F R,Ninnemann O,Bucher M,Ries meier J W,Frommer W B.Preferential expression of an ammonium transporter and of t wo putative nitrate transporters in root hairs of tomato[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93:8139-8144.
[14] Ludewig U,von Wiren N,Fro mmer W B.Uniport of NH4+by the root hair plasma membrane ammoniu m transporter Le AMT1;1[J].The Journal of Biological Chemistry,2002,277:13548-13555.
[15] Couturier J,Montanini B,Martin F,Brun A,Blaudez D,Chalot M.The expanded family of ammonium transporters in the perennial poplar plant[J].New Phytologist,2007,174:137-150.
[16] Sonoda Y,Ikeda A,Saiki S,von Wirén N,Yamaya T,Yamaguchi J.Distinct expression and f unction of three ammoniu m transporter genes(Os AMT1;1-1;3)in rice[J].Plant Cell Physiology,2003,44:726-734.
[17] Suenaga A,Moriya K,Sonoda Y,Ikeda A,von Wiren N,Hayakawa T,Yamaguchi J,Ya maya T.Constitutive expression of a novel-type ammoniu m transporter Os A MT2 in rice plants[J].Plant Cell Physiology,2003,44:206-211.
[18] Yuan L,Graff L,LoquéD,Koji ma S,Tsuchiya Y N,Takahashi H,von Wirén N.At A MT1;4,a pollen-specific high-affinity ammonium transporter of the plasma membrane in Ar abidopsis[J].Plant Cell Physiology,2009,50(1):13-25.
[19] Gansel X,Munos S,Tillard P and Gojon A.Differential regulation of the NO3-and NH4+transporter genes At Nrt2;1 and At Amt1;1 in Ar abidopsis:Relation with long distance and local controls by N status of t he plant[J].Plant Jour nal,2001,26:143-155.
[20] Yuan L,LoquéD,Koji ma S,Rauch S,Ishiyama K,Inoue E,Takahashi H and von Wirén N.The organization of high-affinity ammoniu m uptake in Ar abidopsis r oots depends on t he spatial arrangement and biochemical properties of A MT1-type transporters[J].Plant Cell,2007,19:2636-2652.
[21] von Wirén N,Gazzarini S,Gojon A,For mmer W B.The molecular physiology of ammonium uptake and retrieval[J].Current Opinion in Plant Biology,2000(3):254-261.
[22] Song Z Z,Su Y H.Distinctive potassiu m-accu mulation capability of alligator weed(Alter nanther a philoxer oides)links to high-affinity potassiu m transport facilitated by K+-uptake systems[J].Weed Science,2013,61:77-84.
[23] Murashige T,Skoog F.A revised mediu m for the rapid growth and bioassays with tobacco cultures[J].Physiologia plantarum,1962,15:473-497.
[24] Sambrook J,Russell D W.Molecular Cloning:A Laboratory Manual[M].3r d ed.Cold Spring Har bor,NY,USA:Cold Spring Har bor Laboratory,2001.
[25] Marini A M,Soussi-Boudekou S,Vissers S,Andre B.A family of ammonium transporters in Saccharomyces cerevisiae[J].Molecular and Cellular Biology,1997,17:4282-4293.
[26] LoquéD,Mora S I,Andrade S L A,Pantoja O,Fro mmer W B.Pore mutations in ammoniu m transporter A MT1 with increased electrogenic ammoniu m transport activity[J].The Jour nal of Biological Chemistr y,2009,284(37):24988-24995.
[27] Schwacke R,Schneider A,van der Graaff E,Fischer K,Catoni E,Desi mone M,Frommer W B,Flugge U I,Kunze R.ARA MEMNON,a novel database f or Ar abidopsis integr al membrane proteins[J].Plant Physiology,2003,131:16-26.
[28] 娄远来,邓渊钰,沈纪冬,李亚浩.我国空心莲子草的研究现状[J].江苏农业科学,2002(4):46-48.
[29] 陈振武,沈武孝.空心莲子草治疗带状疱疹50例[J].江西中医药(增刊),1994,25:16-17.
[30] 肖红,杨占秋,文莉.空心莲子草口服治疗乳鼠流行性出血热病毒感染的研究[J].中国病毒学,1996,11(4):348-351.
[31] 胡笃敬,杨敏元,刘国华.高钾植物研究[J].湖南农学院学报,1980(4):5-13.
[32] 庞金华,沈瑞芝,程平宏.三种植物对COD 的耐受极限与净化效果[J].农业环境保护,1997,16(5):209-213.
[33] Xie Y X,Xiong Z Q,Xing G X,Sun G Q,Zhu Z L.Assessment of nitrogen pollutant sources in surface waters of Taihu Lake region[J].Pedosphere,2007,17:200-208.
