Argonaute-2蛋白在膀胱移行上皮癌组织中的表达及其临床意义
2015-04-07杨丰强车建平郑军华
李 军,李 伟,杨丰强,鄢 阳,车建平,刘 敏,郑军华
(1. 上海市浦东新区人民医院泌尿外科,上海 201200; 2. 同济大学附属第十人民医院泌尿外科,上海 200072)
·基础研究·
Argonaute-2蛋白在膀胱移行上皮癌组织中的表达及其临床意义
李 军1,2,李 伟2,杨丰强2,鄢 阳2,车建平2,刘 敏2,郑军华2
(1. 上海市浦东新区人民医院泌尿外科,上海 201200; 2. 同济大学附属第十人民医院泌尿外科,上海 200072)
目的 研究Argonaute-2蛋白在膀胱移行上皮癌组织中的表达及临床意义。方法 通过实时荧光定量PCR、免疫组化法测定88例经病理确诊的膀胱移行上皮癌患者配对的肿瘤组织、癌旁组织中Argonaute-2蛋白的表达,分析该蛋白表达与预后和其他临床病理参数的相关性。结果 膀胱移行上皮癌组织中Argonaute-2 mRNA表达明显高于癌旁组织(P<0.05);Argonaute-2蛋白表达明显高于癌旁组织(P<0.05)。高表达Argonaute-2与肿瘤的病理分级、临床分期以及淋巴结转移情况显著相关。利用Kaplan-Meier生存曲线和Log-Rank检验分析显示,肿瘤组织中Argonaute-2蛋白高表达组患者的5年生存率较低表达组患者明显降低(62.2%vs. 86.3%,P<0.05)。结论 Argonaute-2蛋白的异常表达可能参与膀胱移行上皮癌的发生、发展,可作为膀胱癌预后评估的一个重要生物学指标。
膀胱癌;Argonaute-2蛋白;实时荧光定量PCR;免疫组织化学法
在我国,膀胱癌是泌尿生殖系统中最常见的恶性肿瘤,预后与病理分级、临床分期等密切相关且复发率极高[1]。Argonaute蛋白(AGO蛋白)是RNA诱导沉默复合物(RNA induced silencing complex, RISC)中重要的组成部分之一,共同参与基因沉默即RNA干扰的过程[2]。近年来Argonaute蛋白家族在结肠癌和前列腺癌中作为潜在的肿瘤相关因素,逐渐成为新的研究热点[3-4]。但在膀胱癌中尚鲜见研究报道。本研究将通过实时荧光定量PCR、免疫组化方法检测AGO-2蛋白在膀胱癌组织中的表达情况,探寻其在膀胱癌发生、发展中的潜在作用,探讨其与膀胱癌患者预后的相关性。
1 材料与方法
1.1 临床资料本研究共选取2008年5月至2010年9月上海市第十人民医院泌尿外科接受手术治疗(行膀胱全切或者部分切除)并经术后病理确诊的膀胱移行上皮癌病例88例,其中男性69例、女性19例,中位年龄61(32~79)岁。入选患者术前均签署书面同意书,并经伦理委员会的批准。术中肿瘤切除后即取配对的肿瘤标本及瘤旁组织(距离肿瘤组织2 cm)所有患者进行随访,直到2012年8月(中位数35个月的观察时间)。
1.2 主要试剂及仪器TRIzol购自美国Invitrogen公司,逆转录试剂盒购自日本TaKaRa公司,荧光定量PCR检测试剂盒购自日本TaKaRa公司,兔抗人AGO-2单克隆抗体购自美国CST公司,免疫组织化学检测试剂盒和DAB显色试剂盒购自Dako公司,Mayer苏木精购自美国Sigma公司,倒置相差显微镜购自日本Olympus公司,7900HT Fast Real-time PCR仪购自美国ABI公司。
1.3 实时荧光定量PCR检测AGO-2 mRNA的表达将-80℃保存的膀胱移行上皮癌及正常组织标本按TrIzol试剂盒说明书提取组织总RNA,紫外分光光度计测定RNA的浓度和纯度,要求A260/A280=1.8~2.0,并用1%琼脂糖凝胶电泳检测RNA的完整性。电泳鉴定并定量后,依据TaKaRa公司逆转录说明书将提取的RNA逆转录成cDNA,实时荧光定量PCR反应:SYBR反应体系共25 μL,反应条件:95℃、2 min,95℃、10 s,60℃、30 s,40个循环,溶解曲线95℃、2 min,95℃、15 s,60℃1 min,95℃,15 s。根据公式ΔΔCt=[膀胱癌CtAGO-膀胱癌CtGAPDH]-[正常组织CtAGO-正常组织CtGAPDH]。以 2-ΔΔCt表示目的基因mRNA的相对表达量,每组重复3次取平均值。所检测的目的基因Argonaute-2和内参基因GAPDH的相关引物设计及合成由上海生工生物工程有限公司完成。引物序列见表1。
表1 实时荧光定量PCR引物序列
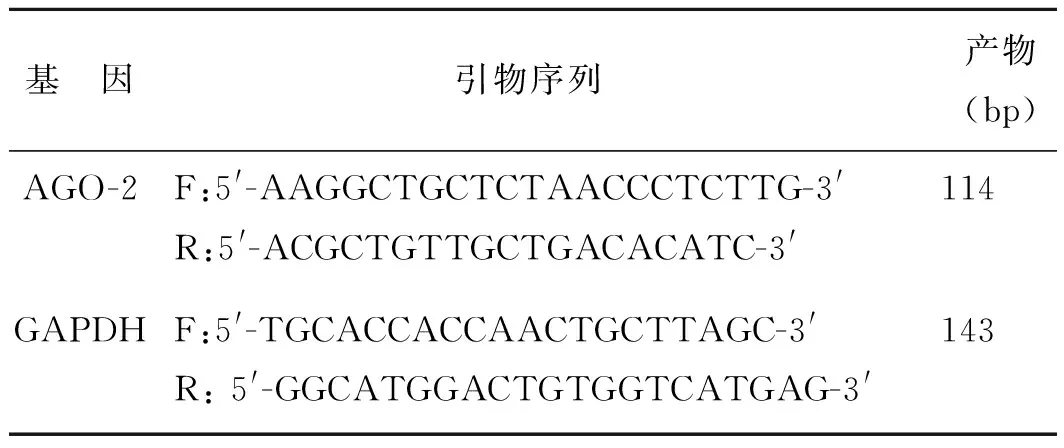
基 因引物序列产物(bp)AGO-2F:5'-AAGGCTGCTCTAACCCTCTTG-3'R:5'-ACGCTGTTGCTGACACATC-3'114 GAPDHF:5'-TGCACCACCAACTGCTTAGC-3'R:5'-GGCATGGACTGTGGTCATGAG-3'143
1.4 免疫组织化学染色检测AGO -2蛋白的表达88例膀胱癌患者肿瘤标本常规经4%甲醛固定,石蜡包埋,制成4 μm厚度切片、脱蜡,3% H2O2室温下孵育10 min,阻断内源性过氧化物酶以消除非特异性着色,0.1 mmol/L枸橼酸缓冲液煮沸修复抗原,10%山羊血清封闭10 min,加入一抗4℃过夜(Argonaute-2,1∶200稀释),再加相应生物素标记的二抗37℃孵育30 min(1∶100稀释),常规DAB显色,苏木精复染,封片后光镜下观察。以PBS代替一抗作为阴性对照,其余步骤相同。
根据相关文献以染色强度和染色阳性细胞所占百分比率相结合进行综合分析[5],标准如下:0,没有染色的肿瘤细胞;+,轻度染色;++,中度染色;+++,明显的染色。染色的面积进行评价和记录的百分比:0,小于5%;+,5%~25%;++,26%~50%;+++,51%~75%;++++,75%以上。结合分数记录和分级如下:-,0;+,1~2;++,3~5;+++,6~7。
1.5 统计学处理采用SPSS 18.0 统计学软件行分析,不同组织之间的AGO-2 表达差异采用Mann-WhitneyU检验,临床数据的差异分析采用Spearman检验。以P<0.05表示差异具有统计学意义。
2 结 果
2.1 膀胱移行上皮癌及癌旁组织中AGO-2 mRNA的表达实时荧光定量PCR结果显示(图1):AGO-2 mRNA在膀胱移行上皮癌中的表达较癌旁组织中明显增高,差异具有统计学意义(P<0.05)。
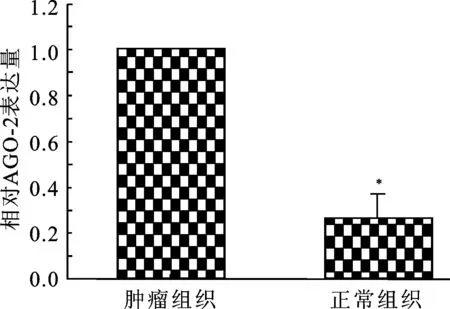
图1 AGO-2 mRNA在膀胱移行上皮癌及正常组织中的表达(n=3)
2.2 膀胱移行上皮癌及癌旁组织中的AGO-2 蛋白表达通过对88例膀胱肿瘤和癌旁正常组织进行免疫组化,同时对其染色强度和阳性的百分率进行半定量分析,结果显示,AGO-2蛋白的主要表达在肿瘤细胞的细胞质中(图2)。AGO-2蛋白在肿瘤组织中的表达(4.76±1.452)%明显高于癌旁组织的表达(2.21±1.088)%,差异具有统计学意义(P<0.05)。
2.3 膀胱移行上皮癌AGO-2 蛋白的表达与病理参数间的相关性细胞质中的AGO-2蛋白的表达水平与临床分期(P<0.001)、病理分级(P=0.009)及有无淋巴结转移(P=0.023)相关,而与患者年龄、性别、肿瘤大小以及有无远处转移之间无统计学差异(P>0.05,表2)。
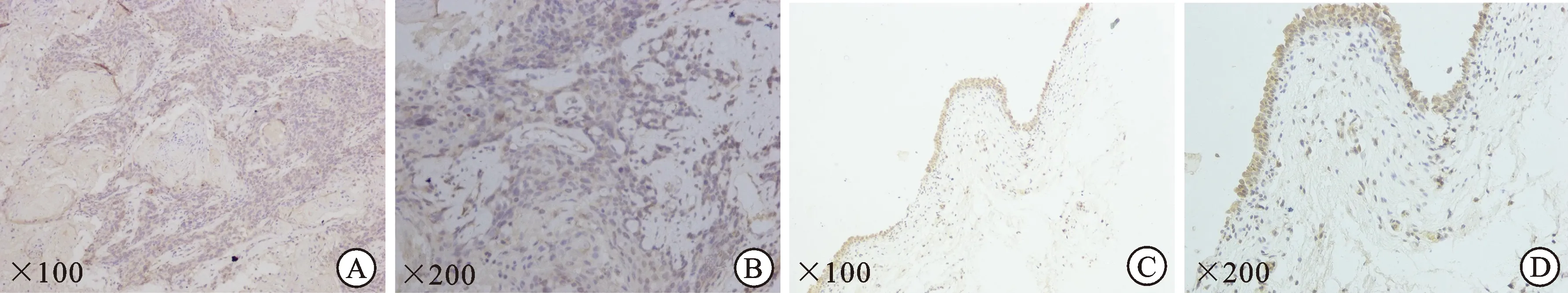
图2 AGO-2蛋白在膀胱癌组织与癌旁组织中的表达情况
A、B:肿瘤组织;C、D:癌旁组织。
表2 AGO-2蛋白的表达与膀胱癌临床病理特征的关系
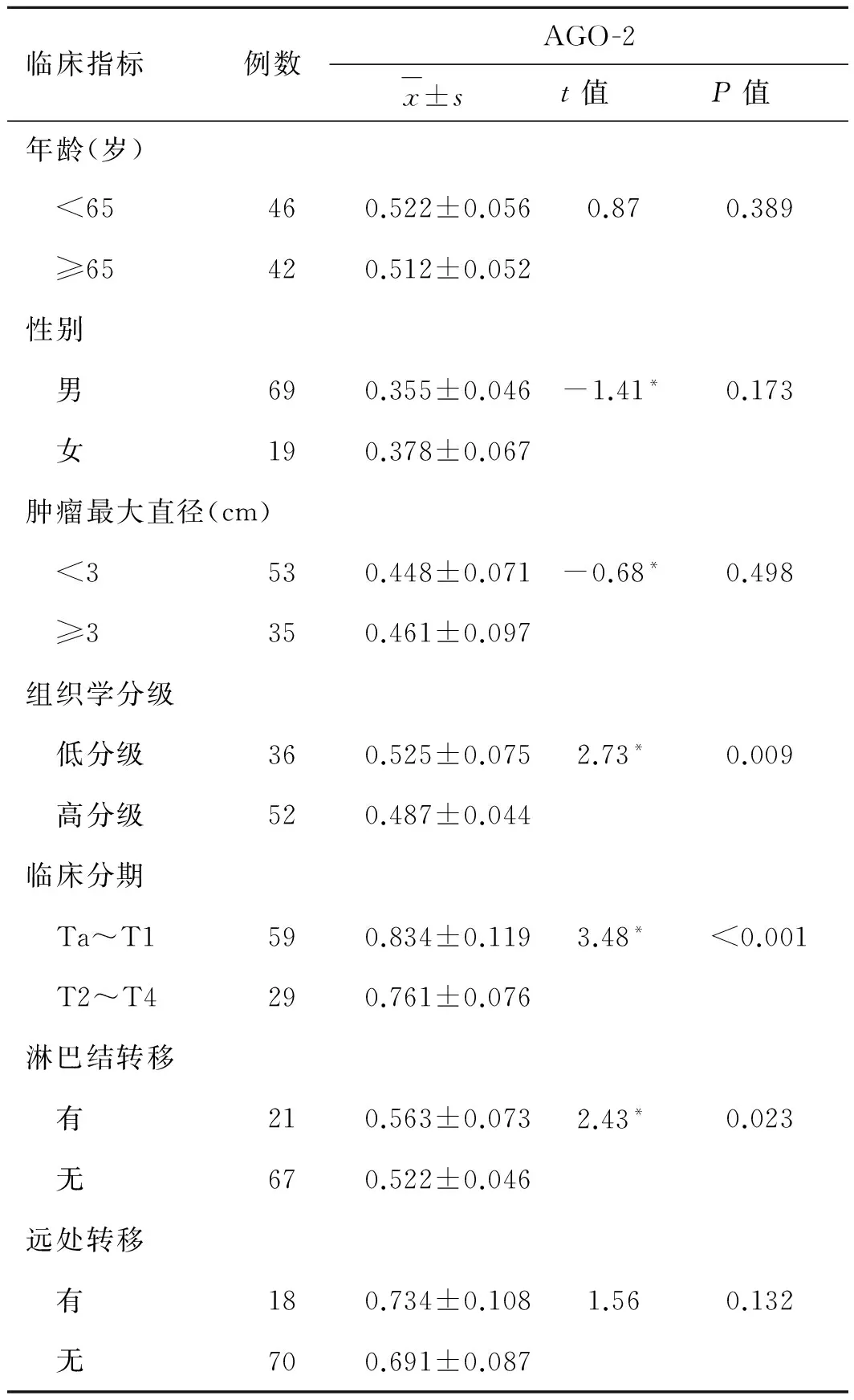
临床指标例数AGO-2x±st值P值年龄(岁) <65460.522±0.0560.870.389 ≥65420.512±0.052性别 男690.355±0.046-1.41*0.173 女190.378±0.067肿瘤最大直径(cm) <3530.448±0.071-0.68*0.498 ≥3350.461±0.097组织学分级 低分级360.525±0.0752.73*0.009 高分级520.487±0.044临床分期 Ta~T1590.834±0.1193.48*<0.001 T2~T4290.761±0.076淋巴结转移 有210.563±0.0732.43*0.023 无670.522±0.046远处转移 有180.734±0.1081.560.132 无700.691±0.087
*代表所标记项为校正的t值。
2.4 膀胱移行上皮癌组织中AGO-2表达与患者预后的相关性术后随访至2012年8月,88例患者在整个观察期间内有21例因膀胱癌相关死亡,而其余67例患者仍然存活或失访,中位随访时间35个月(8~54个月)。生存分析采用Kaplan-Meier生存曲线和Log-rank检验,结果显示:肿瘤组织中AGO-2蛋白高表达患者的5年生存率62.2%明显低于低表达者86.3%,差异具有统计学意义(P<0.05)。生存曲线见图3。
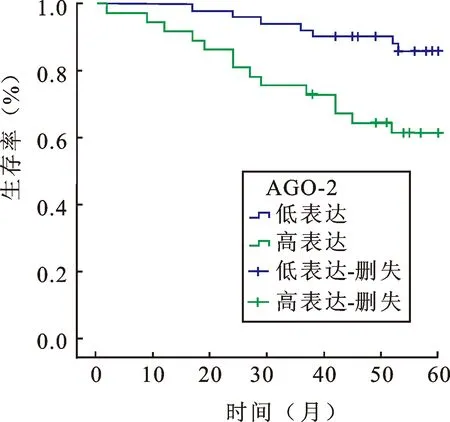
图3 膀胱移行上皮癌AGO-2蛋白的表达与患者5年生存率的分析
3 讨 论
目前小非编码RNA在基因转录和转录后调控中起到的重要作用受到越来越多的关注。据统计,人体中约有30%的基因受到如RNAi的基因沉默机制的调控[6],而几乎所有的这些生物学过程都需要Argonaute蛋白的参与,但目前对于Argonaute蛋白在肿瘤发生、发展中具体的作用机制仍不清除。Argonaute蛋白是一个高度保守的家族,存在于不同物种RISC中,虽然不同的种属拥有数量、分类不一的成员组成,但都有着共同的两个结构域,即PAZ和PIWI,位于Argonaute蛋白N端的PAZ结构域是RISC中小RNAs的结合位点;位于Argonaute蛋白C端的PIWI结构域有着与RNase H相似的结构特征,是RISC中的酶切割活性中心,而miRISC能够直接集募miRNA,同时在miRNA与目标mRNA之间起到连接作用[7]。哺乳动物中存在涉及miRNA途径的四个Argonautes蛋白(AGO1-4),其中AGO-2最特别,它使miRNA和siRNA具有能够裂解完全匹配的靶基因的能力[8-9]。全基因组蛋白质组学和Argonautes定量分析研究表明,AGO-2是含量最丰富的Argonaute蛋白,敲除AGO-2基因的的小鼠,将发生表皮发育缺陷。DENG等[10]研究表明,Argonautes蛋白能够定量操纵miRNA的活性,但目前对于与mRNA的调节序列完全匹配的miRNA的生物信息学和实验分析,都未能解释清楚为何AGO-2在哺乳动物的不同器官、组织普遍存在miRNA功能的调控及具体调控机制。目前哺乳动物不同发育时相中各个Argonaute蛋白的作用及其在miRNA途径中的量化作用是国际研究的热点[11]。最新研究结果[12-13]显示,Argonautes蛋白与人类多种肿瘤的发生、进展有密切关系。VAKSMAN等[14]认为,通过miRNA特定诱导基因翻译Argonautes蛋白能够影响肿瘤的发展。作为RISC部分的AGO-2能结合miRNA或piRNA,而AGO-2对于这些小RNA的异常调节可能诱导正常细胞向恶性细胞的分化,同时在人类RNA干扰中,AGO-2是目前惟一具有RNA酶切活性的蛋白,调控miRNA和小干扰RNA(siRNA)对目标mRNA的剪切分解[15]。TSUCHIYA等[16]研究发现,作为RISC部分的SND1在人结肠癌组织早期病变时即发生过度表达。通过对AGO-2和小RNA之间的相互作用及对目标mRNA鉴定的研究,可能会促使我们进一步深入了解AGO-2在膀胱癌发生、发展中的复杂作用。
本实验共选取88例膀胱移行上皮癌病例,检测了AGO -2 mRNA及蛋白的表达情况;结果显示:AGO-2在膀胱移行上皮癌的表达明显高于正常组织(P<0.05),这与WANG等[17]是在结肠癌组织中的研究结论相符,认为AGO-2蛋白的异常表达可能与结肠致癌的发生相关。此外,我们还将AGO-2蛋白的表达情况与膀胱癌的临床资料如临床分期、病理分级及淋巴结转移情况进行了综合比较,结果发现Argonaute-2蛋白的表达与这些临床资料存在着显著的相关性。研究发现,AGO-2的表达水平分别与临床分期(t= 3.48,P=0.001),病理分级(t=2.73,P=0.009)以及淋巴结转移(t=2.43,P=0.023)均显著相关。CHEN等[18]在SCID小鼠体内注射人乳腺癌细胞MDA-MB-231,发现let-7和miR-103/107能显著诱导血管内皮细胞生成,而AGO-1恰恰被证实为它们的下游靶蛋白,提示AGO-1其实具有促肿瘤血管生成的作用。为此我们猜测AGO-2可能参与肿瘤进展及侵袭的过程,其可能是通过干扰细胞信号转导通路、细胞分裂周期和肿瘤血管生成,最终影响了肿瘤细胞的生物学行为。通过与术后长期随访资料结合分析,我们发现:AGO-2蛋白高表达的膀胱癌患者,有着较差的预后,而AGO-2蛋白低表达的膀胱癌患者,与较高表达患者相比有更好的整体生存率。
本研究利用实时荧光定量PCR技术及免疫组化技术,发现AGO-2在膀胱癌组织中存在异常高表达,且AGO-2蛋白的过表达与临床进展相关;提示AGO-2蛋白高表达的患者可识别为高危膀胱癌患者,AGO-2蛋白可能为膀胱癌治疗的一种新颖的分子靶点。本研究结果有助于更全面的认识AGO-2蛋白的作用,对膀胱癌发病机制及病因学的研究提供可靠的理论依据。
[1] XYLINAS E, KLUTH L A, RIEKEN M, et al. Urine markers for detection and surveillance of bladder cancer[J]. Urol Oncol,2014,32(3):222-229.
[2] BRAUN J E, HUNTZINGER E, IZAURRALDE E. The role of GW182 proteins in miRNA-mediated gene silencing[J]. Adv Exp Med Biol,2013,768:147-163.
[3] LI L, YU C, GAO H, et al. Argonaute proteins: potential biomarkers for human colon cancer[J]. BMC Cancer,2010,10:38.
[4] YOO N J, HUR S Y, KIM M S, et al. Immunohistochemical analysis of RNA-induced silencing complex-related proteins AGO2 and TNRC6A in prostate and esophageal cancers[J]. APMIS,2010,118(4):271-276.
[5] LYNCH H T, SMYRK T C. Identifying hereditary nonpolyposis colorectal cancer[J]. N Engl J Med,1998,338(21):1537-1538.
[6] LEWIS B P, BURGE C B, BARTEL D P. Conserved seed pairing, of ten flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell,2005,120(1):15-20.
[7] 汤朝晖,刘颖斌,全志伟. RNA基因沉默关键蛋白Argonaute在人类肿瘤中的表达及其作用[J]. 中华实验外科杂志,2010,27(12):1967-1968.
[8] CHEN S, CHAHAR H S, ABRAHAM S, et al. Ago-2-mediated slicer activity is essential for anti-flaviviral efficacy of RNAi[J]. PLoS One,2011,6(11):e27551.
[9] SHEKAR P C, NAIM A, SARATHI D P, et al. Argonaute-2-null embryonic stem cells are retarded in self-renewal and differentiation[J]. J Biosci,2011,36(4):649-657.
[10] DENG Y, DENG H, BI F, et al. MicroRNA-137 targets carboxyl-terminal binding protein 1 in melanoma cell lines[J]. Int J Biol Sci,2011,7(1):133-137.
[11] WANG D, ZHANG Z, O'LOUGHLIN E, et al. Quantitative functions of Argonaute proteins in mammalian development[J]. Genes Dev,2012,26(7):693-704.
[12] PARKER J S, BARFORD D. Argonaute: A scaffold for the function of short regulatory RNAs[J]. Trends Biochem Sci,2006,31(11):622-630.
[13] SIDDIQI S, MATUSHANSKY I. Piwis and piwi-interacting RNAs in the epigenetics of cancer[J]. J Cell Biochem,2012,113(2):373-380.
[14] VAKSMAN O, HETLAND T E, TROPE′C G, et al. Argonaute, Dicer, and Drosha are up-regulated along tumor progression in serous ovarian carcinoma[J]. Hum Pathol,2012,43(11):2062-2069.
[15] 毛鑫礼,朱洪源,虞朝辉,等.胃癌组织芯片中Argonaute蛋白表达分析[J]. 中华消化杂志,2009,29(11):751-754.
[16] TSUCHIYA N, OCHIAI M, NAKASHIAMA K, et al. SND1, a component of RNA-induced silencing complex, is up-regulated in human colon cancers and implicated in early stage colon carcinogenesis[J]. Cancer Res,2007,67(19):9568-9576.
[17] WANG YX, ZHANG XY, ZHANG B F, et al. Study on the clinical significance of Argonaute2 expression in colonic carcinoma by tissue microarray[J]. Int J Clin Exp Pathol,2013,6(3):476-484.
[18] CHEN Z, LAI TC, JAN YH, et al. Hypoxia-responsive miRNAs target argonaute 1 to promote angiogenesis[J]. J Clin Invest,2013,123(3):1057-1067.
(编辑 何宏灵)
Expression and significance of Argonaute-2 protein in bladder transitional cell carcinoma
LI Jun1,2, LI Wei2, YANG Feng-qiang2, YAN Yang2, CHE Jian-ping2, LIU Min2, ZHENG Jun-hua2
(1.Department of Urology, People’s Hospital of Pudong New Area, Shanghai 201200, China; 2.Department of Urology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To investigate the expression of Argonaute-2 protein in human bladder transitional cel1 carcinoma (BTCC) and the clinica1 significance. Methods Expression of Argonaute-2 protein was assessed by real-time quantitative PCR and immunohistochemistry (IHC) in the tumor tissue and adjacent non-cancer tissue from 88 patients who had undergone surgery for histologically proven BTCC. The correlation with other clinico-pathologic factors were evaluated. Results The expression of Argonaute-2 mRNA and Argonaute-2 protein was significantly higher in tumor tissues than in adjacent non-cancer samples (bothP<0.05). A significant correlation existed between the high expression of Argonaute-2 protein with the pathological grading, clinical stage (T) and lymph node metastasis. Survival analysis by Kaplan-Meier survival curve and log-rank test demonstrated that elevated Argonaute-2 expression in cancer tissue predicted worse overall survival (OS) compared to group with lower expression (86.3%vs. 62.2%). Conclusions The aberrant expression of Argonaute-2 in bladder transitiona1 cel1 carcinoma is possibly involved with tumorigenesis and development, and the Argonaute-2 protein could act as a potential biomarker for prognosis assessment of bladder cancer.
bladder cancer; Argonaute-2 protein; real-time quantitative PCR; immunohistochemistry
2014-08-30
2014-10-23
国家自然科学基金资助项目(No.81270831)
郑军华,E-mail:zhengjunhua0471@sina.com
李军(1980-),男(汉族),硕士研究生,主治医师. 研究方向:泌尿系肿瘤.E-mail:lijunpudong@163.com
R737.14
A
10.3969/j.issn.1009-8291.2015-02-014
