肾癌根治术后围手术区域复发转移28例报告
2015-04-07郑克文李汉忠张玉石李永强邓建华
郑克文,李汉忠,张玉石,李永强,邓建华
(中国医学科学院北京协和医学院北京协和医院泌尿外科,北京 100730)
·临床研究·
肾癌根治术后围手术区域复发转移28例报告
郑克文,李汉忠,张玉石,李永强,邓建华
(中国医学科学院北京协和医学院北京协和医院泌尿外科,北京 100730)
目的 分析肾癌根治术后围手术区域(同侧肾上腺、肾窝、局部淋巴结和腹壁)肿瘤复发转移的临床特点,探讨处理原则。方法 收集2010年1月至2014年8月北京协和医院收治的28例肾癌根治术后围手术区域肿瘤复发转移患者。男性13例,女性15例,年龄24~82岁,中位年龄49岁。透明细胞癌19例,乳头状细胞癌6例(其中II型乳头状癌4例),嫌色细胞癌1例,多房囊性肾细胞癌2例。病理分级Furman Ⅰ级8例,Furman Ⅱ~Ⅲ级20例。开放手术18例,腹腔镜手术10例。原发肾脏肿瘤中T1a期1例,T1b期10例,T2期10例,T3期4例,T4期3例。原发肿瘤直径3~16 cm。结果 本组围手术区域复发转移部位分别为,肾窝19例,局部淋巴结7例,同侧肾上腺6例,腹壁7例。所有患者均行分子靶向药物治疗。5例行挽救性手术或减瘤手术,1例放疗,1例射频消融治疗。随访时间为6~53个月,无进展生存期2~18个月,中位无进展生存期10个月,死亡8例,12例疾病稳定,1年生存率为88.9%,2年生存率为77.8%。结论 围手术区域肿瘤复发转移的肾癌患者原发肿瘤普遍体积偏大、分期偏晚,病理类型以透明细胞癌为主,其次为Ⅱ型乳头状肾细胞癌,病理级别普遍较高。处理上,通常再次手术难度大、风险较高,且肿瘤不易切除干净,推荐结合分子靶向药物治疗的综合治疗方案。
肾癌;围手术区域;复发;转移;靶向药物
肾癌根治术后围手术区域肿瘤复发转移是指同侧肾上腺、肾窝、区域淋巴结及腹壁的新发肿瘤。由于患者就诊时临床分期已属晚期,再次手术的效果有限。对于晚期肾癌患者酪氨酸激酶抑制剂具有较好的疗效,可延长患者的生存时间[1-2]。我院收治28例肾癌根治术后围手术区域肿瘤复发转移患者,现报告如下。
1 材料与方法
1.1 临床资料我院2010年1月至2014年8月共收治28例肾癌根治术后围手术区域肿瘤复发转移的患者,其中23例患者的初次手术由外院施行(表1)。对于术前已经有全身其他部位转移,或者同侧肾上腺受累、局部淋巴结转移的患者排除在外。其中4例T3期肿瘤中1例合并0级瘤栓,1例合并Ⅰ级瘤栓,另2例肿瘤侵犯肾窦脂肪。3例T4期肿瘤中均为合并同侧肾上腺及肾周筋膜受累,而未侵犯其余脏器。18例行开放肾癌根治术中,其中3例T4期肿瘤切除同侧肾上腺及肾周筋膜,2例T3期肿瘤同时行下腔静脉、肾静脉瘤栓取出术;10例行腹腔镜肾癌根治术中,其中各有1例术前误诊为肾盂癌和肾结核分别行肾输尿管全长切除术和肾切除术。图1为肾癌根治术后围手术区域复发转移典型病例CT片。
表1 患者特征及相关临床指标

项 目例 数患者数28中位年龄[岁(年龄跨度)]49(24~82)性别(%) 男13(46.4) 女15(53.6)左侧(%)17(60.7)右侧(%)11(39.3)原发肿瘤直径[cm(中位数(范围)]5.6(3~16) 病理分期 T1a1 T1b10 T210 T34 T43病理类型 透明细胞癌19 乳头状肾细胞癌6 嫌色细胞癌1 多房囊性肾细胞癌2病理分级 FurmanⅠ级8 FurmanⅡ~Ⅲ级20手术方式 开放肾癌根治术18 腹腔镜肾癌根治术10
1.2 治疗方案及随访靶向药物采用舒尼替尼或索拉非尼治疗,纳入研究的患者开始均采用标准方案(舒尼替尼50 mg/d, 1次/d,口服,连续用药4周、间歇2周为1个治疗周期;索拉非尼400 mg 2次/d,口服,间隔12 h),若不良反应严重可酌情适当减量或者短暂停药,严重不良反应导致无法继续规律治疗的患者排除在外。其中有5例行挽救性手术切除或减瘤手术,1例行肾窝放疗,1例行腹壁肿物射频消融治疗。治疗前与患者签署知情同意书并严格随访。
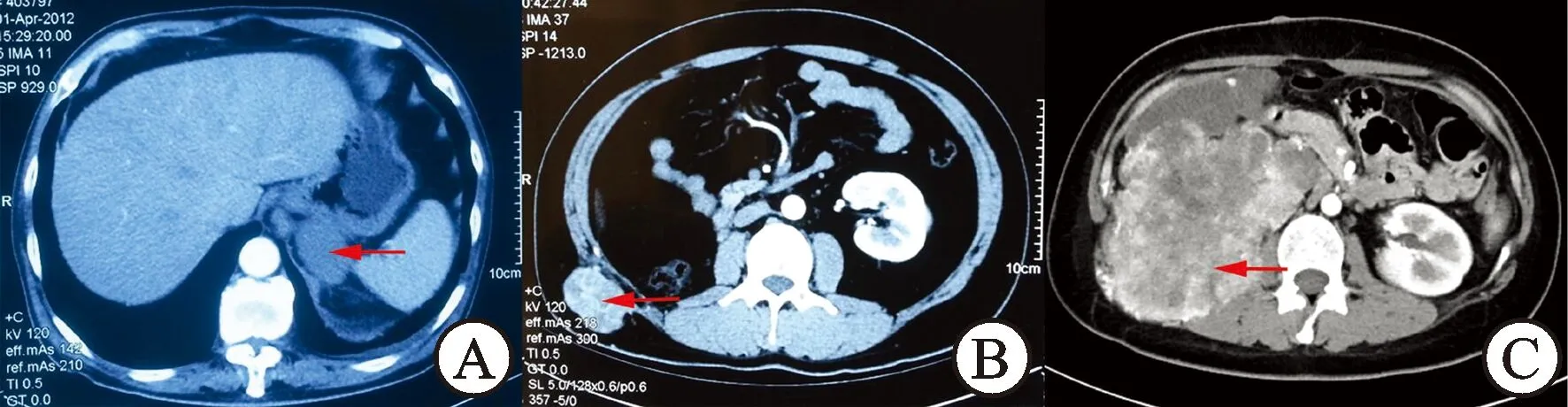
图1 肾癌根治术后围手术区域复发转移典型病例CT
A:腹腔镜左肾癌根治术后左侧肾上腺转移;B:腹腔镜右肾癌根治术后腹壁种植转移;C:囊性肾癌根治术后右侧肾窝及腹壁广泛种植转移。
2 结 果
患者均为复查发现围手术区域复发转移为首诊,首诊时间为术后3~120个月,中位时间为26个月。围手术区域复发或转移的部位分别为肾窝19例,局部淋巴结7例,同侧肾上腺6例,腹壁7例。其中17例为多部位复发或转移。同期CT、MRI、PET、骨扫描等发现17例合并全身其他部位转移。其中肺10例,骨5例,对侧肾上腺4例,肠系膜淋巴结3例,盆腔2例。仅有11例未合并全身其他部位的转移,这其中仅有4例是单发的病灶。
所有患者均行分子靶向药物治疗,其中舒尼替尼6例,索拉非尼22例,开始均采用标准治疗方案。治疗期间共8例(舒尼替尼3例,索拉非尼5例)因副反应较重暂时药物减量或短暂停药。1例患者行肾窝放疗,1例行腹壁肿物射频消融治疗,5例行挽救性手术切除或减瘤手术,其中包括3例腹壁皮下肿瘤切除(肾窝病灶未手术),2例同侧肾上腺病灶切除术,手术均顺利,无重大并发症出现。随访时间为6~53个月,中位随访时间为21个月,随访过程中8例患者死亡,剩余20例患者中12例患者疾病出现进展,8例患者疾病稳定。疾病无进展生存期(progression free survival, PFS)为2~18个月,中位PFS为10个月。患者1年生存率为88.9%,2年生存率为77.8%。患者服药过程中不良反应均耐受良好,个别不良反应较强者通过减药或者短暂停药均可缓解。最常见的不良反应为手足皮肤反应18例(64.3%),腹泻14例(50%),乏力10例(35.7%)。
3 讨 论
肾癌根治术后围手术区域肿瘤复发转移的发生率很低,在0.8%~3%之间[3-7]。其危险因素包括,肿瘤的体积和分期、术中不恰当的操作、肿瘤的生物学行为以及术前是否误诊,另外患者的自身情况,如是否合并慢性免疫系统疾病也是重要的影响因素[8]。肾癌根治术后围手术区域肿瘤复发转移多数发生在分期较晚的患者,但亦可以发生在肿瘤体积较大的T1期患者。在本组病例中,11例(39.3%)患者初始分期为T1期,与文献报道的比例28%~43%较一致[3, 9]。另外,只有7例(25%)患者被确诊时有局部或全身症状。文献中,有将近一半的患者无临床症状[3]。因此,对于术后的患者,即使是肿瘤分期较早或者无临床症状,也应该进行严密的随访[10]。本组中,虽然有11例患者初始T分期为T1期,但这其中仅有1例为T1a期,其余10例均为T1b期。肿瘤最大直径为16 cm,中位直径为5.6 cm。在病理分型中,以透明细胞癌居多(19/28)。其次为乳头状肾细胞癌,共6例,其中Ⅱ型乳头状癌为4例,另外2例未分型。与Ⅰ型乳头状肾细胞癌相比,Ⅱ型乳头状肾细胞癌通常恶性程度更高,而且侵袭性更强[11]。病理分级中以Furman Ⅱ~Ⅲ级为主,占71.4%(20/28),肾透明细胞癌中Furman Ⅱ~Ⅲ级占78.9%(15/19)。对于囊性肾细胞癌患者,手术方式及技巧至关重要。本研究中,有1例患者由于肿瘤体积巨大,在行肾根治性切除之前,抽取囊性。对于此类患者,若术中不慎囊液外溢则极其容易造成肿瘤种植。对于手术过程中应尽量减少出血量,尤其是瘤体出血。1例患者术后引流管口肿瘤复发,考虑可能与术中瘤体出血较多,术后通过引流液种植于皮下。另外1例因肾部分切除术中出血较多,被迫行抢救性肾根治性切除术,术后肾窝复发。此2例均可能与术中瘤体出血较多、肿瘤种植相关。另外分别各有1例术前误诊为肾盂癌和肾结核,行腹腔镜手术,术中可能未彻底切除脂肪囊,另外切口较小,在标本取出时可能造成瘤体挤压、破溢造成种植。另外对于腹腔镜手术,膨腹介质CO2可以造成腹腔内出现局部缺氧状态,造成体内代谢环境的改变,并且CO2造成的压力可以在一定程度上对腹膜的完整性造成破坏,此外,CO2还可以抑制体内巨噬细胞的活性,降低机体免疫力;CO2的“烟囱效应”也可能是肿瘤局部种植及皮下种植的危险因素[12]。
肾癌根治术后围手术区肿瘤复发转移被认为是肾癌患者预后不良的因素[13]。2009年,MARGULIS等[3]报道,经过中位随访41个月的时间,43%的肾癌术后围手术区肿瘤复发转移的患者死亡。BRUNO等[5]报道,在平均随访16.9个月,76%的患者死亡,估计总体的5年生存率为18%。我们的研究中,所有患者均行分子靶向药物治疗,1年和2年的生存率分别为88.9%和77.8%,尚未获得5年生存率。
现有的证据尚无法有效证明围手术区域的新发肿瘤是原发肿瘤微观残留的进展还是播散性转移的形式之一。出于这个原因,过去对于这样病例的治疗方式是选择进行手术切除还是全身治疗如化疗、免疫治疗、放射治疗,或观察一直是有争议的。早期的证据支持积极的手术切除术。ITANO等[14]报道对于无远处转移的围手术区域肿瘤复发转移,手术、放化疗和观察的5年存活率,分别为51%、18%和13%。已经证明对于围手术区域单发病灶的手术切除是有潜在的治疗益处的。单发病灶手术切除的5年生存率为35%~60%[15]。但是积极手术的高并发症发生率也是公认的,文献报道手术切除相关的并发症发生率的范围为的13%~33%[3-5, 7, 14, 16],而且手术常无法将肿瘤切除干净,同时也存在加速肿瘤全身转移的风险。本组病例中,仅有11例未合并全身其他部位的转移,这其中仅有4例是单发的复发病灶,所以手术治疗率不高。对于单一病灶再次手术的价值,由于本文的病例数量较少,未得出有价值的结论。在20世纪90年代,通常采用免疫治疗与外科手术相结合治疗肾癌术后围手术区域的肿瘤复发转移。
近年来越来越多的学者更倾向于将围手术区域新发肿瘤视为全身转移的一部分,并将抗血管生成的分子靶向治疗应用于这些患者中,尤其是广泛的局部肿瘤复发,而手术难度巨大、风险较高的患者,或者合并全身转移的患者。对于转移性肾细胞癌,分子靶向药物治疗可以显著延长患者的生存期[1, 2]。除此之外,新辅助靶向药物治疗可能潜在缩小肿瘤体积从而降低手术切除的难度,并可能减少肿瘤播散的风险。有文献报道,新辅助靶向药物治疗可使肿瘤降期,尤其是肿瘤体积小于5 cm的复发肿瘤体积可减少32%,对5~7 cm之间的肿瘤体积可减少11%[13, 17-18]。然而,在大多数病例中,肿瘤缩小比较少见。在我们的研究中,虽无新辅助病例,但是可以观察到用药后肿瘤体积缩小或者肿瘤内部坏死,并使患者疾病处于稳定。另外靶向药物的不良反应多数患者可以耐受,可以使患者长期应用。新的二线、三线靶向药物的不断诞生,使得疾病进展或者耐药的患者具有更多的选择,提供更多的治疗希望。
综上,我们对肾癌根治术后围手术区域肿瘤复发转移的患者进行了临床资料分析,本组病例中,围手术区域肿瘤复发转移的肾癌患者原发肿瘤体积偏大、分期偏晚,病理类型以透明细胞癌为主,其次为Ⅱ型乳头状肾细胞癌,病理级别普遍较高。二次挽救性手术难度大,且肿瘤不易切除干净,可以考虑靶向药物治疗的综合治疗方案。但是我们的研究属于回顾性研究,样本量小,尚需要更大的样本量以及前瞻性的研究得出更可靠的证据支持。
[1] MOTZER R J, HUTSON T E, TOMCZAK P, et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma[J]. J Clin Oncol,2009,27(22):3584-3590.
[2] MOTZER R J, HUTSON T E, TOMCZAK P, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma[J]. N Engl J Med,2007,356(2):115-124.
[3] MARGULIS V, MCDONALD M, TAMBOLI P, et al. Predictors of oncological outcome after resection of locally recurrent renal cell carcinoma[J]. J Urol,2009,181(5):2044-2051.
[4] BOORJIAN S A, CRISPEN P L, LOHSE C M, et al. Surgical resection of isolated retroperitoneal lymph node recurrence of renal cell carcinoma following nephrectomy[J]. J Urol,2008,180(1):99-103, 103.
[5] BRUNO J N, SNYDER M E, MOTZER R J, et al. Renal cell carcinoma local recurrences: impact of surgical treatment and concomitant metastasis on survival[J]. BJU Int,2006,97(5):933-938.
[6] MASTER V A, GOTTSCHALK A R, KANE C, et al. Management of isolated renal fossa recurrence following radical nephrectomy[J]. J Urol,2005,174(2):473-477, 477.
[7] SANDHU S S, SYMES A, A'HERN R, et al. Surgical excision of isolated renal-bed recurrence after radical nephrectomy for renal cell carcinoma[J]. BJU Int,2005,95(4):522-525.
[8] YAZICI S, INCI K, DIKMEN A, et al. Port site and local recurrence of incidental solitary renal plasmacytoma after retroperitoneoscopic radical nephrectomy[J]. Urology,2009,73(1):210-215.
[9] PAPAREL P, BIGOT P, MATILLON X, et al. Local recurrence after radical nephrectomy for kidney cancer: management and prediction of outcomes. a multi-institutional study[J]. J Surg Oncol,2014,109(2):126-131.
[10] MOTZER R J, AGARWAL N, BEARD C, et al. NCCN clinical practice guidelines in oncology: kidney cancer[J]. J Natl Compr Canc Netw,2009,7(6):618-630.
[11] WARRICK J I, TSODIKOV A, KUNJU L P, et al. Papillary renal cell carcinoma revisited: a comprehensive histomorphologic study with outcome correlations[J]. Hum Pathol,2014,45(6):1139-1146.
[12] 廖维荣,张江南. CO2气腹对肿瘤增殖及转移影响的研究进展[J]. 实用临床医学,2010,11(1):118-121.
[13] BEX A, KROON B K, DE BRUIJN R. Is there a role for neoadjuvant targeted therapy to downsize primary tumors for organ sparing strategies in renal cell carcinoma?[J]. Int J Surg Oncol,2012,2012:250479.
[14] ITANO N B, BLUTE M L, SPOTTS B, et al. Outcome of isolated renal cell carcinoma fossa recurrence after nephrectomy[J]. J Urol,2000,164(2):322-325.
[15] RUSSO P. Multi-modal treatment for metastatic renal cancer: the role of surgery[J]. World J Urol,2010,28(3):295-301.
[16] 蔡伟,宋勇,洪宝发,等. 肾癌局部复发的手术治疗[J]. 中华泌尿外科杂志,2009,30(6):394-396.
[17] THOMAS A A, RINI B I, LANE B R, et al. Response of the primary tumor to neoadjuvant sunitinib in patients with advanced renal cell carcinoma[J]. J Urol,2009,181(2):518-523, 523.
[18] COMEY C L, AMIN C, PRUTHI R S, et al. Neoadjuvant clinical trial with sorafenib for patients with stage II or higher renal cell carcinoma[J]. J Clin Oncol,2010,28(9):1502-1507.
(编辑 王 玮)
《现代泌尿外科杂志》(附手术光盘)少量库存热卖中
《现代泌尿外科杂志》2013年推出手术光盘以来,受到广大读者的热烈欢迎。不少读者联系编辑部要求购买刊物及手术光盘,部分刊期杂志销售较热,如2013年1期(刊有李学松教授的《经腹腔镜肾癌根治术的肾蒂处理经验:手术技巧及出血性并发症的腔镜下处理(附视频)》)等,而由于杂志存量有限,尚有部分读者未能如愿买到所需杂志。现在盘点库存后发现少量余刊,请需要购买的读者尽快联系编辑部购买。
杂志(附光盘)定价:15元/本, 邮寄方式:平邮
购买方式:从邮局汇款,地址:雁塔西路76号,邮编:710061。收款人:现代泌尿外科杂志编辑部。附言注明刊期和数量。如需要寄送快递(收件人付费)请留言及告知收件联系电话。
编辑部联系电话:029-82657054,联系人:张娟妮。
《现代泌尿外科杂志》编辑部
Recurrence and metastasis of perioperative areas of renal cell carcinoma after radical nephrectomy: a report of 28 cases
ZHENG Ke-wen, LI Han-zhong, ZHANG Yu-shi,LI Yong-qiang, DENG Jian-hua
(Department of Urology, Peking Union Medical College Hospital Affiliated to Chinese Academy of Medical Science & Peking Union Medical College, Beijing 100730, China)
Objective To analyze the clinical characteristics of recurrence and metastasis of perioperative areas (including homolateral adrenal gland, renal fossa, regional lymph nodes, and abdominal wall) of renal cell carcinoma after radical nephrectomy, and to explore the management. Methods Clinical data of 28 cases of renal cell carcinoma treated in Peking Union Medical College Hospital during Jan. 2010 to Aug. 2014 were retrospective analyzed. The patients included 13 male and 15 female, aged 24-82 years, median 49 years. There were 19 clear cell carcinoma, 6 papillary carcinoma (4 cases of type Ⅱ), 1 chromophobe carcinoma, and 2 multiple cystic renal cell carcinoma. Pathological grading showed 8 cases of Furman I and 20 cases of Furman Ⅱ-Ⅲ. Of all cases, 18 underwent open radical nephrectomy and 10 laparoscopic radical nephrectomy. The pathological stage included 1 case of T1a, 10 cases of T1b, 10 cases of T2, 4 cases of T3, and 3 cases of T4. The size of primary tumor was 3-16 cm. Results Up to 19 cases had recurrence or metastasis in renal fossa, 7 in regional lymph nodes, 6 in homolateral adrenal gland, and 7 in the abdominal wall. All patients underwent targeted therapy, 5 received salvage or cytoreductive surgery, 1 radiotherapy, and 1 radiofrequency ablation. During the follow-up of 6-53 months, 8 patients died. The progression free survival (PFS) was 2-18 months, and the median PFS was 10 months. The one-year and two-year survival-rate was 88.9% and 77.8% respectively. Conclusions Cases with perioperative regional tumor recurrence or metastasis after radical nephrectomy tend to be in large size and late stage. Clear cell carcinoma is the major pathologic type, followed by type II papillary renal cell carcinoma. Since salvage tumor excision is difficult and risky, we recommend comprehensive treatment including targeted therapy.
renal cell carcinoma; perioperative area; recurrence; metastasis; target therapy
2014-10-08
2014-11-03
李汉忠,主任医师,主要从事泌尿外科肿瘤、肾上腺疾病、泌尿外科疑难杂症、肾移植等方向的研究.E-mail:lihanzhong_pumc@163.com
郑克文(1985-),男(汉族),博士,主要从事泌尿外科肿瘤的研究.E-mail:zkw2121@163.com
时间:2014-12-23
R737.1l
A
10.3969/j.issn.1009-8291.2015-02-008
网络出版地址:http://www.cnki.net/kcms/detail/61.1374.R.20141223.1010.001.html
