转移性前列腺癌早期去势抵抗的预测因素分析
2015-04-07董柏君潘家骅沙建军温晓飞吴鹏飞黄翼然
徐 凡,董柏君,潘家骅,沙建军,温晓飞,刘 辉,吴鹏飞,薛 蔚,黄翼然
(1.上海交通大学医学院附属仁济医院泌尿外科, 上海 200127;2. 上海市东方医院泌尿外科,上海 200120;3. 上海市浦东新区周浦医院泌尿外科,上海 201318;4. 上海市浦东新区光明中医医院泌尿外科,上海 201300)
·临床研究·
转移性前列腺癌早期去势抵抗的预测因素分析
徐 凡1,董柏君1,潘家骅1,沙建军1,温晓飞2,刘 辉3,吴鹏飞4,薛 蔚1,黄翼然1
(1.上海交通大学医学院附属仁济医院泌尿外科, 上海 200127;2. 上海市东方医院泌尿外科,上海 200120;3. 上海市浦东新区周浦医院泌尿外科,上海 201318;4. 上海市浦东新区光明中医医院泌尿外科,上海 201300)
目的 探讨转移性前列腺癌全雄阻断后去势抵抗(CRPC)进展的预测因素及其早期发生的影响因素。方法 回顾性分析102例全雄阻断治疗的前列腺癌骨转移患者的临床资料。采用Logrank检验和Cox回归分析治疗后发生CRPC的预测因素。采用非参数检验、χ2检验、Logistic回归分析早期发生CRPC(1年内)的影响因素。结果 入组患者平均随访时间为21.4±13.3个月,中位CRPC发生时间为25.5月。Gleason评分(HR:2.100;95%CI:1.236~3.567;P=0.006 1)、全雄阻断治疗后PSA最低值(HR:5.287,95%CI:2.816~9.924;P<0.0001)、到达PSA最低值时间(HR:0.275;95%CI:0.137~0.554;P=0.008 7)是发生CRPC的独立预测因子。其中到达最低值时间(OR:0.672;95%CI:0.497~0.908)是早期发生CRPC的独立影响因素。结论 Gleason评分≥9分、治疗后PSA最低值≥0.2 ng/mL、到达最低值时间<9月的患者对单纯全雄阻断治疗反应不佳,特别是治疗后到达PSA最低值时间短的患者,早期CRPC发生可能大。
前列腺癌;内分泌治疗;全雄激素阻断;去势抵抗;预测因素
在美国,2014年前列腺癌发病率已经超过肺癌,是导致男性死亡的第二大肿瘤性疾病[1]; 而在亚洲地区,特别是在我国,前列腺癌的发病率明显低于西方国家[2]。虽然我国前列腺癌的发病率低,但是每年新诊断的患者中绝大多数已经属于疾病晚期阶段,失去了根治的机会[3]。全雄雄激素、完全阻断(以下简称全雄阻断)阻断治疗往往是这一部分患者的首选治疗方案。然而不同的患者接受治疗后发展到去势抵抗阶段(castration resistant prostate cancer,CRPC)的时间有很大的差异,提示了前列腺癌存在显著的个体差异。因此我们希望早期识别出一线全雄阻断治疗不敏感的患者,探索转移性前列腺癌早期制定个性化治疗方案的可能性。
1 资料与方法
1.1 临床资料本研究回顾性分析了2010年1月至2012年6月在上海仁济医院东院泌尿外科行手术去势联合口服抗雄药物治疗的102例前列腺癌骨转移患者的临床资料。所有患者在治疗前常规行经直肠前列腺B超(transrectal ultrasonography,TRUS)、肛门指检(digital rectal examination,DRE)、前列腺特异抗原(prostate specific antigen,PSA)、游离前列腺特异抗原(free prostate specific antigen,fPSA)、全身骨扫描(emission computed tomography,ECT)和前列腺穿刺活检,明确前列腺癌骨转移的诊断。去势手术后患者即开始服用比卡鲁胺或者氟他胺,术后患者定期门诊随访,监测PSA变化。所有入组病例接受全雄阻断治疗至发生CRPC之前未经过其他治疗。针对入组病例,我们收集的临床指标包括:年龄、术前PSA、前列腺体积、活检病理Gleason评分、骨转移灶数量、全雄阻断治疗后PSA的最低值和达到最低值的时间。CRPC按照2014欧洲泌尿外科协会(European Association of Urology,EAU)指南定义为去势水平下连续3次检测PSA升高,且升高超过最低值的50%,把第一次PSA升高的时间定义为CRPC时间。早期CRPC定义为全雄激素阻断治疗后1年内发生的CRPC。
1.2 统计分析通过SAS (Release 8.02 TS level 02M0)软件对以上收集的指标和患者随访的预后情况进行统计分析,P<0.05则认为有统计学差异。计量指标用若无特殊说明采用中位数(四分位数)的格式描述其分布,计数指标采用频数(百分比)的格式描述其分布。Logrank检验用于比较不同亚组间预后的差异,Kaplan-Meier生存分析和Cox回归用于寻找影响全雄阻断治疗疗效的独立影响因素。非参数检验和卡方分析用于比较早期CRPC患者与其他CRPC患者的差异,Logistic回归用于分析早期发生CRPC的独立影响因素。只有在单因素分析中有显著差异的指标才会被引入至多因素分析模型中。
2 结 果
102例患者基本临床信息描述详见表1,随访时间为1.6~49.2月不等,平均21.4±13.3月。随访期间发生CRPC的患者共58例(56.9%),其中1年内发生CRPC的患者有28人,占CRPC患者的48.3%。死亡患者共22例(21.6%),因前列腺癌进展死亡的患者19例(18.6%)。Kaplan-Meier法以CRPC为结局指标对患者作生存分析,中位CRPC发生时间25.5月(95%CI:17.4~37.5)。
表1 患者基本临床特征和预后因素的log rank检验结果
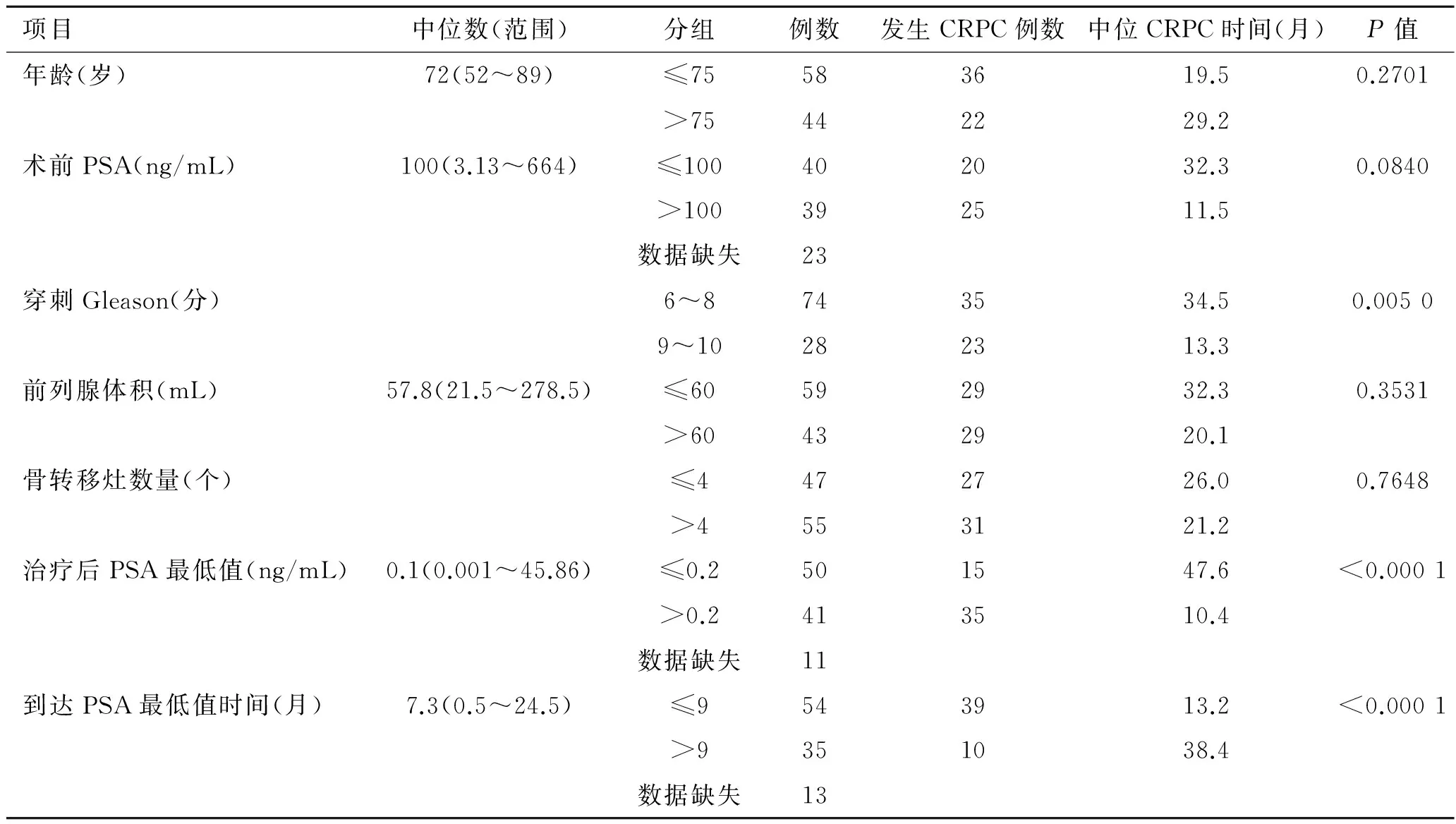
项目中位数(范围)分组例数发生CRPC例数中位CRPC时间(月)P值年龄(岁)72(52~89)≤75583619.50.2701>75442229.2术前PSA(ng/mL)100(3.13~664)≤100402032.30.0840>100392511.5数据缺失23穿刺Gleason(分)6~8743534.50.00509~10282313.3前列腺体积(mL)57.8(21.5~278.5)≤60592932.30.3531>60432920.1骨转移灶数量(个)≤4472726.00.7648>4553121.2治疗后PSA最低值(ng/mL)0.1(0.001~45.86)≤0.2501547.6<0.0001>0.2413510.4数据缺失11到达PSA最低值时间(月)7.3(0.5~24.5)≤9543913.2<0.0001>9351038.4数据缺失13
按照收集的临床指标对患者分组,进行Logrank检验,结果提示穿刺Gleason评分(9~10vs. 6~8)、全雄阻断治疗后PSA最低值、到达PSA最低值的时间与治疗后CRPC的发生有关(表1)。用Cox回归对上述指标进行分析,由单因素分析可知Gleason评分、全雄阻断治疗后PSA最低值、到达PSA最低值时间与前列腺癌骨转移患者全雄阻断治疗后CRPC的发生有关。由多因素分析可知,上述3个指标均为前列腺癌骨转移患者全雄阻断治疗后发生CRPC的独立预测因素, Gleason评分高、治疗后PSA最低值高、到达最低值时间短的患者容易发生CRPC进展(表2)。另外,通过非参数检验与卡方分析比较早期发生CRPC患者与治疗1年后发生CRPC患者,我们发现前者具有PSA最低值高、到达最低值时间短的特点(表3),Logistic回归结果提示到达最低值时间是早期发生CRPC的独立影响因素(表4)。
表2 全雄阻断治疗后发生CRPC的Cox分析

变量分组单因素分析HR95%CIP值多因素分析HR95%CIP值Gleason评分(分)6~8 119~102.1001.236~3.5670.00611.8911.041~3.4360.0364治疗后PSA最低值(ng/mL)≤0.211>0.25.2872.816~9.924<0.00014.0162.088~7.722<0.0001到达PSA最低值时间(月)≤911>90.2750.137~0.5540.00030.3830.187~0.7850.0087
表3 全雄阻断后1年内发生CRPC患者特征(与1年后发生CRPC比较)

变量CRPC时间中位数(四分位数)<1年≥1年P值PSA(ng/mL)126.0(67.5,238.0)131.0(60.2,267.5)0.2096Gleason评分(分)6~815(53.57%)20(66.67%)9~1013(46.43%)10(33.33%)0.3083前列腺体积(mL)57.39(40.1,71.9)66.4(39.1,130.0)0.2075骨转移灶数量(个)<411(39.29%)16(53.33%)≥417(60.71%)14(46.67%)0.2838治疗后PSA最低值(ng/mL)1.63(0.36,12.00)0.38(0.07,1.11)0.0093到达最低值时间(月)4.3(3.3,6.5)8.2(5.7,10.8)<0.0001
表4 全雄阻断后CRPC患者1年内发生CRPC的影响因素分析(Logistic回归)
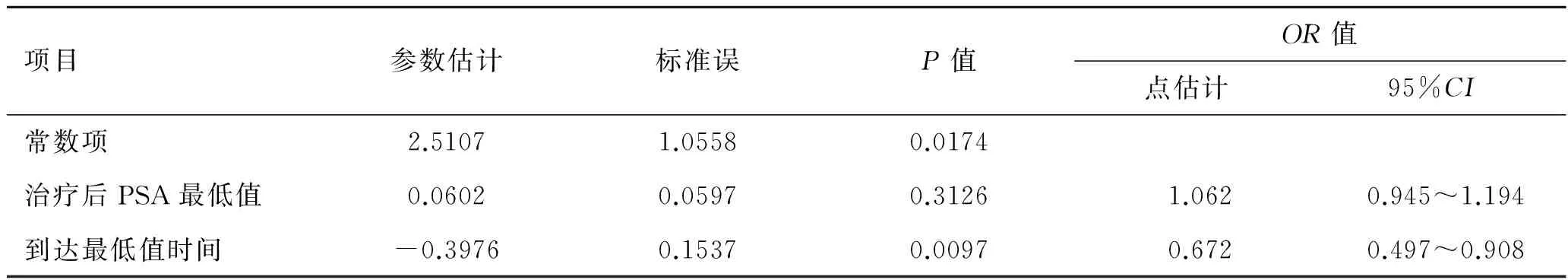
项目参数估计标准误P值OR值点估计95%CI常数项2.51071.05580.0174治疗后PSA最低值0.06020.05970.31261.0620.945~1.194到达最低值时间-0.39760.15370.00970.6720.497~0.908
由以上数据可知,在Gleason<9的患者中,在治疗前的临床常用检查指标中没有发现有价值的预测因素。但是这样一部分患者在接受全雄阻断治疗后的PSA下降模式可以提示出他们发生CRPC的时间(图1)。其中同时具有PSA最低值>0.2 ng/mL、降至最低值时间≤9月特征的患者,CRPC发生最早。而PSA最低值≤0.2 ng/mL、降至最低值时间>9月的患者,CRPC发生最晚(表5)。
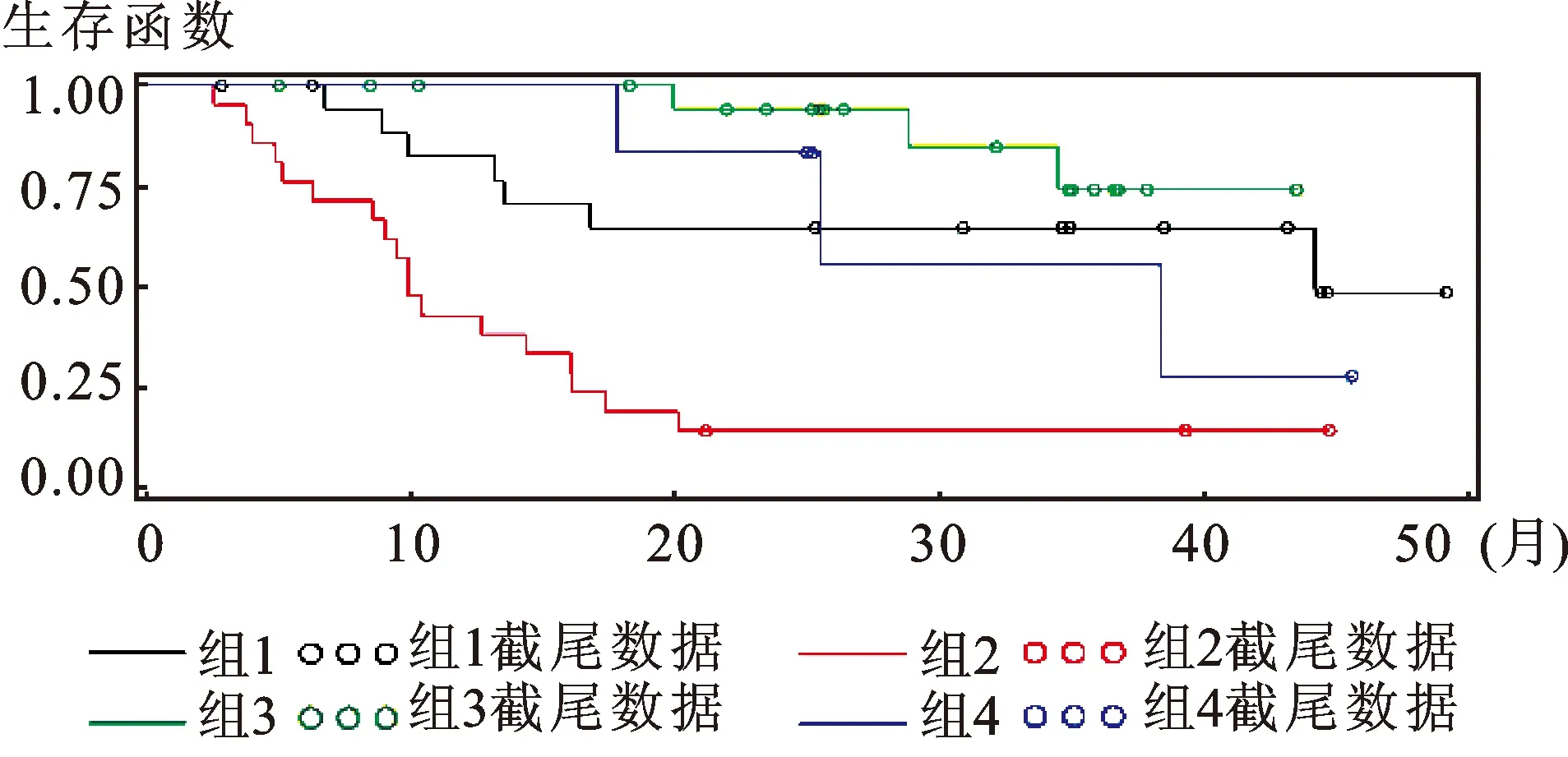
图1 Gleason<9患者全雄阻断后CRPC发生的生存分析
表5 Gleason<9患者全雄阻断后CRPC发生的生存分析

分组至最低值时间(月)PSA最低值(ng/mL)中位CRPC时间(月)1<9<0.244.22<9≥0.29.93≥9<0.2/4≥9≥0.238.4
3 讨 论
全雄阻断是现在临床一线最常使用的治疗晚期前列腺癌的治疗方案,其效果优于单纯去势或抗雄治疗[4-5]。长期的临床实践发现,几乎所有的患者经过一段时间治疗之后都会再次进入疾病进展的阶段,临床称为CRPC。
随着近年来对CRPC研究的不断深入,我们认识到,CRPC是临床上对前列腺癌进入某一特定阶段的概括,就其机制而言还需要进一步细分,目前比较多见的分类是将CRPC分为激素依赖和非依赖两类[6]。激素依赖的CRPC,肿瘤细胞通过雄激素受体(Androgen receptor,AR)扩增、变异,组织内雄激素合成等途径,使得AR通路在去势水平依旧可以激活,支持肿瘤细胞的生存和繁殖[7-9]。激素非依赖的CRPC,肿瘤细胞通过过度激活AR通路以外的信号通路、神经内分泌转化、重要抑癌基因的失活、表观遗传调控改变等变异,使得其存活和生长不再依赖AR通路的激活[10-12]。这些变异,可能是由肿瘤细胞逐步适应低雄激素环境引起的新的变异,也可能是原来生长不占优势的激素非依赖细胞经过低雄激素环境的筛选,逐步变为优势细胞。也就是所谓的“环境适应”与“克隆选择”。
这些理论较好地解释了全雄阻断治疗患者预后差异大的临床现象。在这些研究的基础上,CRPC前列腺癌治疗方式也不断增多,特别是针对激素依赖的CRPC患者,阿比特龙、恩杂鲁胺等药物的临床试验都取得了良好的效果,可以显著延长患者的疾病缓解期[13-14]。但另一方面,也有研究表明,在某些情况下,AR通路反而会对前列腺癌细胞的生长起到抑制作用;甚至某些AR的突变会使得AR拮抗剂反过来起到激活AR受体的作用,在临床表现为抗雄激素撤退综合征(antiandrogen withdrawal syndrome,AWS)[15]。这说明并非所有的患者都能够从传统全雄阻断治疗中获益。
目前国内临床采用全雄阻断治疗作为晚期转移性前列腺癌的首选治疗方案,等到患者出现CRPC的表现之后,再采用撤药、化疗或者阿比特龙等手段进一步干预,这种治疗方法开始并没有考虑到患者的个体差异。现在很多临床研究已经开始关注多种治疗手段在前列腺癌发展至CRPC前的早期应用,包括多西紫杉醇类化疗药物、阿比特龙等[16]。这就需要我们能够找出合适的临床指标或生物标记物,指导临床制定合理的个性化治疗方案,为患者选择最合理的治疗方式。特别是针对一线全雄阻断治疗效果不理想的患者,如果可以找出敏感的预测指标,早期联合其他治疗方法,也许可以取得更好的疗效。
在本次回顾性研究中,我们发现Gleason评分和全雄阻断治疗后的PSA变化与患者治疗效果有关。并且Gleason评分高、治疗后PSA最低值高和到达最低值时间短的患者,发生CRPC的时间明显要早于其他患者,是早期CRPC的独立预测因素。
Gleason评分是前列腺癌危险程度分级中的一个重要参数,Gleason评分高表明肿瘤的分化差。在9~10分的患者中,肿瘤细胞已经或多或少的失去了腺体结构,呈间质细胞样排列。有研究表明Gleason 9~10预后明显差于评分低的患者,这样的患者肿瘤易于转移,且对全雄阻断治疗效果差[17]。YOSHIMOTO等[18]指出Gleason评分高的患者,肿瘤异质性高, 伴有AR通路以外重要抑癌基因变异的可能大,合理解释了这一临床现象。结合本研究数据,转移性前列腺癌患者Gleason评分9~10分患者全雄阻断后CRPC发生早,这部分患者采用单纯全雄阻断治疗效果差,可以考虑早期联合其他治疗方式。
PSA作为前列腺癌诊断和疗效检测指标在临床应用十分普遍。本研究中,全雄阻断治疗前PSA水平与治疗后CRPC发生时间没有显著的关系(P=0.084 0),但是治疗后PSA变化与CRPC发生时间有关。PSA下降最低值在很多临床研究中都被认为与预后有关,SIM等[19]指出全雄阻断治疗后PSA最低值>2 ng/mL提示总体生存率不良[19]。HUSSAIN等[20]在美国的一项多中心临床研究中也证实了这一结论。我们的数据进一步表明,PSA最低值降至无法检测水平(≤0.2 ng/mL)的患者,CRPC发生时间晚,是全雄阻断治疗效果好的标志。
全雄阻断后绝大部分患者PSA在最初1个月可下降80%多,处于快速下降阶段[21]。有研究表明,这样一种PSA下降的方式并不能表明肿瘤细胞的死亡,只是AR通路被抑制导致PSA分泌减少的生物学效应[22]。这一快速下降阶段之后,如果PSA可以进一步缓慢下降被认为是肿瘤负荷减少的反应,因此我们分析了PSA下降至最低值时间与治疗后CRPC发生的关系。我们的数据表明PSA下降至最低值时间>9个月的患者CRPC发生要晚于时间<9个月的患者,我们猜想降至最低值时间过短的患者,PSA下降是肿瘤细胞AR通路抑制的生物学效应,这部分患者早期的CRPC证明肿瘤在全雄阻断的情况下仍可以存活并生长,单纯的抗雄治疗没有起到治疗效果。这一现象也被很多国内外作者的关注,SASAKI等[23]曾做过日本患者的单中心研究,他们发现到达PSA最低值时间长的患者(≥9vs.<9月)总生存期要明显比时间短的患者长。HUANG等[24]在台湾、香港地区针对650例转移性前列腺癌的多中心研究,也得出了一致的结论,他们认为需要进一步的基础研究来解释这一现象。然而KIPER等[25]在土耳其的一项单中心研究分析了149例患者,却得出了相反的结果,他们认为治疗后短期内PSA正常化的患者疾病进展更为缓慢。这些临床研究结果的差异可能由于研究设计的局限性所致,还需要通过Meta分析或者大样本前瞻性研究进一步验证。
从结果来看,我们认为前列腺癌骨转移患者如果具有Gleason评分≥9分、治疗后PSA最低值≥0.2 ng/mL、到达最低值时间<9月的特点,提示他们对单纯全雄阻断治疗反应不佳,可以考虑在CRPC发生前联合多学科制定个性化治疗方案,以期改善患者预后。早期联合治疗的方案和效果,还需要进行相应的临床试验进行研究。
[1] SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014 [J]. CA Cancer J Clin,2014, 64(1):09-29.
[2] SIM HG, CHENG CW. Changing demography of prostate cancer in Asia[J]. Eur J Cancer 2005, 41(6):834-845.
[3] 马春光, 叶定伟. 前列腺癌的流行病学特征及晚期一线全雄阻断治疗分析[J]. 中华外科杂志,2008, 46(12):341-345.
[4] SEIDENFILD J,SAMSON D J,HASSELBLAD V, et al. Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis [J]. Ann Intern Med,2000,132(7):566-577.
[5] CRAWFORD E D,EISENBERGER M A,MCLEOD D G, et al. A controlled trial of leuprolide with and without flutamide in prostate carcinoma [J]. N Engl J Med,1989, 321(7):419-424.
[6] A MIZOKAMI, M NAMIKI. Reconsideration of progression to CRPC during androgen deprivation therapy [J]. J Steroid Biochem Mol Biol 2014. doi: 10.1016/j.jsbmb.2014.03.015. [Epub ahead of print]
[7] KOIVISTO P, KONONEN J, PALMBERG C, et al. Androgen receptor gene amplification: a possible molecular mechanism for androgen deprivation therapy failure in prostate cancer [J], Cancer Res,1997,57 (2):314-319.
[8] MIZOKAMI A, KOH E, FUJITA H, et al. The adrenal androgen androstenediol is present in prostate cancer tissue after androgen deprivation therapy and activates mutated andro-gen receptor [J], Cancer Res,2004, 64 (2):765-771.
[9] MONTGOMERY RB, MOSTAGHEL EA, VESSELLA R, et al. Maintenance of intratumoral androgens in metastatic prostate cancer: a mechanism for castration-resistant tumor growth [J], Cancer Res,2008, 68 (11):4447-4454.
[10] BAKIN RE, GIOELI D, BISSONETTE EA, et al. Attenuation of Ras signaling restores androgen sensitivity to hormone refractory C4-2 prostate cancer cells [J]. Cancer Res, 2003,63(8):1975-1980.
[11] MULHOLLAND DJ, KOBAYASHI N, RUSCETTI M, et al. Pten loss and RAS/MAPK activation cooperate to promote EMT and metastasis initiated from prostate cancer stem/progenitor cells [J]. Cancer Res,2012, 72(7):1878-1889.
[12] CONTEDUCA V, AIETA M, AMADORI D, et al. Neuroendocrine differentiation in prostate cancer: Current and emerging therapy strategies [J]. Crit Rev Oncol Hematol,2014,92(1):11-24.
[13] MOSTAGHEL EA. Abiraterone in the treatment of metastatic castration-resistant prostate cancer [J]. Cancer Manag Res,2014, 28(6),39-51.
[14] SANFORD M. Enzalutamide: a review of its use in metastatic, castration-resistant prostate cancer [J]. Drugs,2013,73(15),1723-1732.
[15] MIYAMOTO H, RAHMAN MM, CHANG C. Molecular basis for the antiandrogen withdrawal syndrome [J]. J Cell Biochem, 2004, 91(1):3-12.
[16] AMATO R, STEPANKIW M, GONZALES P. A phase II trial of androgen deprivation therapy (ADT) plus chemotherapy as initial treatment for local failures or advanced prostate cancer [J]. Cancer Chemother Pharmacol,2013,71(6):1629-1634.
[17] O’KELLY F, ELAMIN S, CAHILL A, et al. Characteristics of modern Gleason 9/10 prostate adenocarcinoma: a single tertiary centre experience within the Republic of Ireland [J]. World J Urol,2014, 32(4):1067-1074.
[18] YOSHIMOTO M, DING K, SWEET JM, et al. PTEN losses exhibit heterogeneity in multifocal prostatic adenocarcinoma and are associated with higher Gleason grade [J]. Mod Pathol,2013,26(3):435-447.
[19] SIM HG, LAU WK, CHENG CW. Predictors of androgen independence in metastatic prostate cancer [J]. BJU Int, 2004, 93(9):1221-1224.
[20] HUSSAIN M, TANGEN CM, HIGANO C, et al. Absolute prostate-specific antigen value after androgen deprivation is a strong independent predictor of survival in new metastatic prostate cancer: data from Southwest Oncology Group Trial 9346 (INT-0162). J Clin Oncol,2006, 24(24):3984-3990.
[21] ARAI Y, YOSHIKI T, YOSHIDA O. Prognostic significance of prostate specific antigen in endocrine treatment for prostatic cancer [J]. J Urol. 1990, 144(6):1415-1419.
[22] WENISCH JM, MAYR FB, SPIEL AO, et al. Androgen deprivation decreases prostate specific antigen in the absence of tumor: implications for interpretation of PSA results [J]. Clin Chem Lab Med,2014, 52(3):431-436.
[23] SASAKI T, ONISHI T, HOSHINA A. Nadir PSA level and time to PSA nadir following primary androgen deprivation therapy are the early survival predictors for prostate cancer patients with bone metastasis[J]. Prostate Cancer Prostatic Dis,2011, 14(3):248-252.
[24] HUANG SP, BAO BY, WU MT, et al. Impact of prostate-specific antigen (PSA) nadir and time to psa nadir on disease progression in prostate cancer treated with androgen-deprivation therapy[J]. Prostate,2011, 71(11):1189-1197.
[25] KIPER A, YIGITBASI O, IMAMOGLU A, et al. The prognostic importance of prostate specific antigen in the monitorisation of patients undergoing maximum androgen blockade for metastatic prostate cancer[J]. Int Urol Nephrol,2006, 38(3-4):571-576.
(编辑 何宏灵)
Early castration resistant prostate cancer: analysis of prognostic factors
XU Fan1, DONG Bai-jun1, PAN Jia-hua1, SHA Jian-jun1, WEN Xiao-fei2, LIU Hui3, WU Peng-fei4, XUE Wei1, HUANG Yi-ran1
(1.Department of Urology, Renji Hospital Affiliated to Medical School of Shanghai Jiaotong University, Shanghai 200127; 2.Department of Urology,Shanghai Dongfang Hospital, Shanghai 200120; 3.Department of Urology, Shanghai Zhoupu Hospital, Shanghai 201318; 4.Department of Urology, Shanghai Guangming Chinese Medical Hospital, Shanghai 201300, China)
Objective To explore the prognostic factors of early castration resistant prostate cancer (CRPC) after maximal androgen blockade (MAB) in metastatic prostate cancer. Methods Clinical data of 102 patients with bone metastatic prostate cancer who received MAB in Shanghai Renji Hospital during 2010 and 2012 were retrospectively reviewed.LogranktestandCoxregression were used to analyze the prognostic factors of CRPC. Non-parametric test, chi-square test andLogisticregression were used to analyze the influencing factors of early CRPC (within one year after MAB). Results The average follow-up was 21.4±13.3 months, median CRPC time was 25.5 months. Gleason score (HR: 2.100; 95%CI: 1.236~3.567;P=0.006 1), PSA nadir value (HR: 5.287, 95%CI: 2.816~9.924;P<0.000 1) and time to PSA nadir (HR:0.275; 95%CI: 0.137~0.554;P=0.008 7) were all independent prognostic factors of CRPC. The interval time to nadir was the independent influencing factor of early CRPC after MAB (OR: 0.672; 95%CI: 0.497~0.908). Conclusions Bone metastatic prostate cancer with one or more of the following characters indicates a poor responses to pure MAB therapy: Gleason score ≥9, PSA nadir value after MAB ≥0.2 ng/mL and time to PSA nadir less than 9 months. Patients who have short interval time to nadir are more likely to have CRPC within one year.
prostate cancer; hormonal therapy; maximal androgen blockage; castration resistant prostate cancer; prognosis factor
2014-10-24
2014-12-03
浦东新区卫生系统重点学科群建设(No.PWZxq2014-05),上海市科委(No.14140901700),国家自然科学基金(No.91129725).
薛蔚,主任医师.E-mail:uroxuewei@163.com.
徐凡(1990-),男(汉族),硕士研究生,研究方向:前列腺肿瘤.E-mail:xusiran1990@163.com
R737.25
A
10.3969/j.issn.1009-8291.2015-02-003
